一种国产新型冠状病毒核酸检测试剂盒的性能验证
2020-12-04宗曾艳汤花梅陈大洋豆小文王萌萌张秀明
宗曾艳,熊 丹,武 薇,汤花梅,陈大洋,豆小文,王萌萌,张秀明
(1.深圳市罗湖医院集团医学检验实验室,广东深圳 518001;2.安徽理工大学医学院,安徽淮南 232001)
新型冠状病毒(SARS-CoV-2)是自2019年12月暴发的新型传染病毒,一种有包膜的RNA病毒,属β冠状病毒属[1]。2020年1月中国研究团队通过高通量测序技术获得了该病毒的全基因组序列,是由冠状病毒开放阅读框(ORFs)、核壳蛋白N基因和包膜蛋白E基因等基因组成[2-4]。感染患者常表现为发热、干咳和肺炎等症状[5],严重者可快速进展为脓毒血症休克、代谢性酸中毒、凝血障碍等。2020年1月20日,SARS-CoV-2被纳入《中华人民共和国传染病防治法》规定的乙类传染病,并采取甲类传染病的防控措施进行管理。国家卫健委在发布的1~7个版本新冠病毒诊疗指南中均将qRTPCR核酸检测作为SARS-CoV-2诊断“金标准”[6]。
SARS-CoV-2基因组序列公布后,各企业积极开展SARS-CoV-2核酸检测试剂盒研发,并实际应用到临床实验室,但此次疫情来势汹汹,临床急需大量试剂盒对SARS-CoV-2进行检测,因此研发时未能用足够临床样本确认其性能,可能存在试剂优化不充分、试剂批间差异大、“假阴性”等问题。为验证核酸检测试剂盒是否满足临床SARS-CoV-2核酸检测要求,本实验室对即将应用于临床检测的一款试剂盒进行性能验证。
本研究参照中国合格评定国家认可委员会(CNAS)制定的CNAS-GL039《分子诊断检验程序性能验证指南》[7]和EP15-A3文件对深圳市梓健生物科技有限公司(下简称梓健)研发的SARSCoV-2试剂盒关键性能指标进行评估,以验证该试剂盒是否满足本实验室检测要求,为新发传染病试剂盒快速研发提供评价参考。
1 材料与方法
1.1 研究对象 临床阳性标本:2020年1月29日~4月20日在本院初筛并由罗湖区疾病控制中心确诊的15例新冠患者临床检测后剩余的咽拭子标本。临床阴性样本:为健康人阴性样本。以上所有样本由专业人员按照《新型冠状病毒感染的肺炎实验室检测技术指南》采集并运输至实验室进行检测,不能立即检测的咽拭子-80℃保存。定值参考品和交叉反应混合质粒来源于梓健公司。干粉标准品来源于菁良基因科技有限公司(编号:GWCRPM001),该标准品包含新冠病毒ORF1ab部分区域序列,N基因和E基因全长序列。因为试剂盒ORF1ab引物位置不在该标准品ORF1ab基因片段内,因此该标准品只用于N基因检出限验证。
1.2 试剂与仪器 SARS-CoV-2核酸检测试剂盒(深圳市梓健生物科技有限公司,以下简称梓健,批号:2020021101),核酸提取纯化试剂盒(宁波海尔施基因科技有限公司,批号:REF1060167),NP968-C型核酸提取仪(天隆科技),ABI7500PCR仪(美国Applied Biosystems公司)。
1.3 方法
1.3.1 反应体系:该试剂盒使用ORF1ab和N基因作为检测靶标基因,人源性内参基因作为内标,CY5通道采集荧光信号。结果判读:根据说明书中循环阈值(cycle threshold,Ct)40和扩增曲线进行判读。
1.3.2 阴阳性符合率:阴阳性符合率分别使用定值标准品及临床样本验证。20例SARS-CoV-2阳性样本中包括15例阳性临床样本(编号P1~P15,N基因Ct值为27.93~37.00,ORF1ab基因Ct值为26.88~36.11)和5例定值参考品(R1:5×107copies/ml,R2:5×106copies/ml,R3:5×105copies/ml,R4:5×104copies/ml,R5:5×103copies/ml);20例阴性样本中包括15例健康人阴性临床样本和5例阴性定值参考品,分别统计阴、阳性符合率,若大于95%,则判断该试剂盒一致性符合要求。
1.3.3 精密度验证:使用2例阳性临床样本(1例弱阳性和1例强阳性)验证,参考EP15-A3文件,阳性样本每天重复检测5次,连续检测5天,记录每次检测结果,分别计算25个检测结果各靶基因Ct值重复性(批内不精密度)和实验室内变异系数(CV),若CV≤5%,则认为该试剂盒不精密度符合要求。
1.3.4 检出限验证:核酸提取时,使用300μl样本,得到60μl核酸,则提取后的核酸浓度为提取前的5倍,用该核酸进行检出限验证,对应浓度为5copies/μl。将含N基因1 200copies/管的标准品,使用12μl无RNase水溶解,得1 000copies/μl核酸溶液。再将溶液稀释200倍,得5copies/μl浓度N基因溶液,重复检测该溶液20次。计算N基因检出率,若有19次以上结果为阳性,即检出率≥95%,则厂家声明的检出限得到验证。
1.3.5 交叉反应验证:使用与其感染部位相同或感染症状相似且常见的其它病原体,包括人副流感病毒1型(2.4×106copies/ml)、鼻病毒(3.2×106copies/ml)、冠 状 病 毒HKU1(2.2×106copies/ml)、NL63(3.1×106copies/ml)、229E(5.2×106copies/ml)、OC43(3.7×106copies/ml)、MERS(2.9×106copies/ml)、SARS(2.6×106copies/ml)、甲型流感病毒(5.4×106copies/ml)和乙型流感病毒(2.5×106copies/ml),共10个质粒混合(各30μl)进行交叉反应。混合质粒分别加入至5例阴性样本中(每孔2.5μl阴性样本+2.5μl质粒),每个样本进行3个复孔扩增检测,统计5例标本结果,若5例样本结果均不出现扩增曲线或Ct值,则表明该试剂盒无非特异性扩增。
1.4 统计学分析 采用MicrosoftExcel 2019,SPPS 24.0和GraphPad Prism7.0 (GraphPad Software,Inc.,San Diego,CA,USA) 软件进行统计分析,不精密度采用标准差(s)和变异系数(CV)表示,计数资料采用率(%)或均值±标准差(±s)表示。
2 结果
2.1 阴阳性符合率 20例样本ORF1ab和N基因Ct值均<37,判断为阳性结果,阳性符合率100%,其中弱阳性临床样本(P13)N和ORF1ab基因Ct值分别为37和36.56,为阳性结果。阳性对照出现明显扩增曲线情况下,20例阴性样本均未检测出Ct值及扩增曲线,阴性符合率100%。见图1。
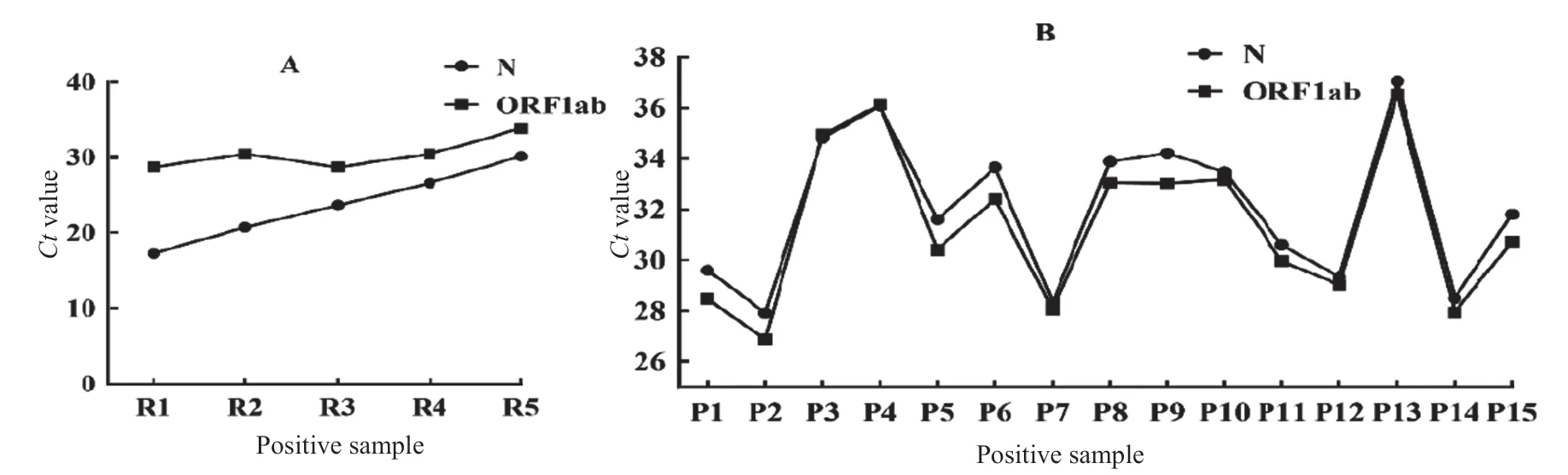
图1 5例阳性参考品和15例阳性样本ORF1ab基因和N基因检测Ct值
2.2 精密度 2例临床阳性样本ORF1ab基因和N基因重复性、实验室内总不精密度CV均<5%,该试剂盒不精密度符合要求,25次结果Ct值的标准差和CV见表1。

表1 2例临床阳性样本N基因、ORF1ab基因精密度
2.3 检出限 厂家声明的该试剂盒检出限为1 000 copies/ml,对应的标准品核酸浓度为5copies/μl,在阳性质控及20个样本内标都出现明显扩增曲线的情况下,N基因20次检测均出现了扩增曲线,Ct值为35.45±0.88,均<37,判断为阳性,检出率100%,厂家声明的检出限得到了验证,见图2。
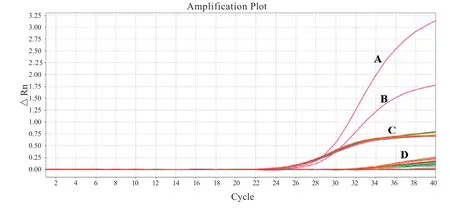
图2 RT-PCR检出限反应扩增曲线
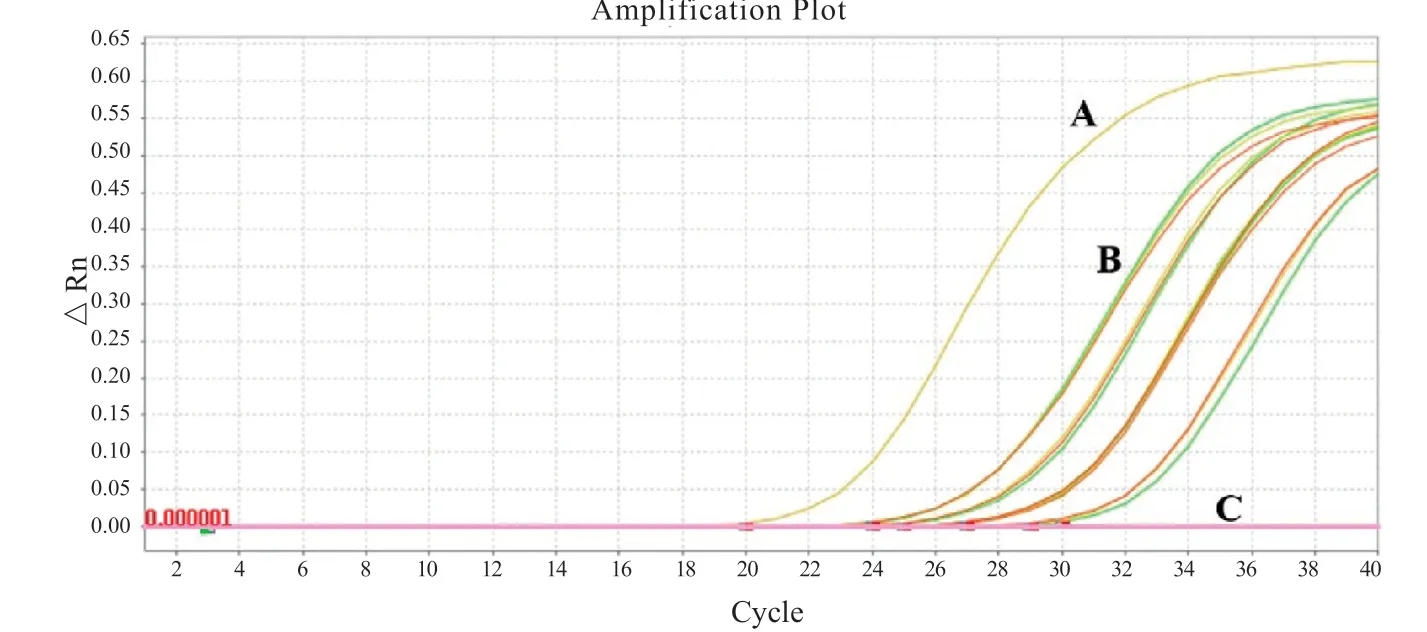
图3 RT-PCR交叉反应扩增曲线
2.4 交叉反应 该试剂盒检测5例加有人副流感病毒、鼻病毒、冠状病毒HKU1,NL63,229E,OC43,MERS,SARS,甲型流感病毒和乙型流感病毒质粒的阴性样本,每个样本3个复孔检测,以试剂盒内阳性质控为对照。检测结果见图3,阳性对照和内标有明显扩增曲线,但阴性标本N基因和ORF1ab未出现扩增曲线或Ct值,表明以上病毒间均不存在交叉反应,该试剂盒具有特异性。
3 讨论
此次暴发的新冠肺炎截至2020年5月17日,全球确诊病例数4 525 497例,累计死亡307 395例。我国开展系列防控措施以来,SARS-CoV-2感染上升的趋势得到一定程度的遏制,但是境外感染情况不容乐观,不断有境外输入病例,因此,仍应进一步加强对SARS-CoV-2的早期检测。截至目前,国家药品监督管理局已应急审批了11个新冠核酸检测试剂及6个抗体检测试剂[8]。我国核酸试剂盒按三类医疗器械标准进行管理,在投入临床使用前,应进行严格的评估与验证。因此本研究对实验室即将使用的梓健试剂盒性能进行验证。该试剂盒选取ORF1ab和N基因作为检测靶标,符合卫健委发布的《新型冠状病毒感染的肺炎实验室检测技术指南》[9]。通过对该试剂盒评价,判断是否满足本实验检测要求,以期为生产厂家持续改进试剂盒质量提供参考依据。
之前郭元元[10]等使用1例弱阳性样本平行比较了6种国产试剂盒性能,最终发现6种新冠试剂对该样本的检测能力有差异,并且各试剂的敏感度、重复性、特异度等有待提高。本实验室收集20例临床样本对7种新冠核酸试剂盒(达安、华大、圣湘、亚能、梓健等)的检测结果阴、阳性符合率和检出能力进行了评估(数据待发表),结果表明梓健试剂盒阴、阳性符合率达100%,验证了其声明的检出限为1 000copies/ml,基于这样的基础上,本次研究对梓健试剂盒进行了较全面评估。通过对10例定值参考品和30例临床样本检测,结果显示,阳性样本的N基因和ORF1ab基因Ct值均<37,且曲线明显,阴性双基因均未检出,N基因和ORF1ab阴、阳性符合率达100%;2例阳性样本N基因、ORF1ab基因重复性、实验室总不精密度CV均<5%,满足要求;该试剂盒声明的检出限为1 000copies/ml,使用标准品稀释到该浓度附近进行20次检测,N基因结果均为阳性,阳性率100%,该检出限与多数试剂盒检出限相同,表明检出限能满足临床基本需求。
已有报道表明有六种SARS-CoV-2病毒可以感染人类,包括冠状病毒229E,OC43,NL63,HKU1,SARS和MERS,此次的新冠病毒是第七种人冠状病毒,所有冠状病毒在其基因组表达上都有相似之处,根据基因序列设计引物和探针时,引物探针可能识别不了不同种属冠状病毒导致交叉反应,因此本研究使用10种与新冠病毒感染症状相似或具有相似基因序列的病毒质粒对该试剂盒交叉反应进行了验证,结果表明即使是较高浓度的人冠状病毒229E(5.2×106copies/ml)和甲型流感病毒(5.4×106copies/ml)质粒在5例新冠病毒阴性样本中仍没有任何扩增曲线,没有发生交叉反应,表明该试剂盒特异度好。
本研究对梓健试剂盒的重复性、阴、阳性符合率、交叉反应、检出限等参数进行了评价,结果表明该批号试剂盒性能良好,能满足实验室新冠样本筛查。但本研究仅对梓健试剂盒一个批号做了评价,不能反映整体试剂盒质量,应收集不同地区、不同来源临床样本,与其他多家试剂盒、多中心实验室进行结果比对,以便为实验室选择合适的试剂盒提供参考。
