盖子区域氨基酸的定点突变对T1脂肪酶酶学性质的影响
2020-12-04朱彩林吕祥夏小乐
朱彩林 吕祥 夏小乐
(工业生物技术教育部重点实验室 江南大学,无锡 214122)
脂肪酶是工业中应用最为广泛的酶之一,是一种绿色催化剂,可催化水解反应、酯化反应或者酯交换反应,主要用于油脂加工、保健品、手性化合物、生物能源、造纸和皮革等领域[1-2]。脂肪酶具有一个典型的盖子结构,覆盖住酶的活性位点,当脂肪酶位于油水界面时,蛋白分子构象发生改变,盖子结构打开,酶的活性中心暴露,酶与底物结合发生催化作用,称为界面激活现象[3-4]。由于脂肪酶应用范围广,并且催化条件复杂多变,良好的稳定性成为酶在实际应用中必备的重要性质[5],因此通过对盖子结构进行改造以增强脂肪酶性能的研究也很多。Shih等[6]将Geobacillus sp.NTU 03脂肪酶盖子区域189号的Asp残基进行定点突变,导致活性增强,但热稳定性降低。Santarossa等[7]将来源于Pseudomonas fragi的脂肪酶PCL盖子结构中的氨基酸残基Thr137和Thr138分别突变成Val和Asn,导致突变体对底物的链长选择性发生改变。Panizza等[8]对来源于 Pseudomonas sp.CR611 的 Lip I.3脂肪酶的盖子结构改造后,使突变体对底物4-甲基伞形酮庚酯水解活力明显增强。Karkhane 等[9]将来源于 Bacillus thermocatenulatus脂肪酶盖子结构中的苯丙氨酸突变成丙氨酸后,突变体水解活力增加2.6倍。林瑞凤等[10]通过对扩展青霉盖子结构域进行突变,使突变体T81P和K94E的酶活力为野生型的3.95倍和3.97倍。
T1脂肪酶是近年来研究比较火热的脂肪酶之一,该酶是一种高温嗜碱酶,来源于Geobacillus zalihae菌株,由于具有良好的耐热性,被广泛应用于食品、医药、化工等各个领域。T1脂肪酶的盖子结构由α6和α7螺旋组成,螺旋覆盖酶活性位点,α6螺旋在界面激活过程中会发生明显的二级结构重组现象,此时酶催化口袋打开,底物与酶结合并发挥催化作用[11]。由于T1脂肪酶在工业应用中经常受各种极端条件的压迫,如高温、极端pH、有机溶剂等,通过理性改造获得各种极端条件耐受性强的T1脂肪酶突变体显得尤其重要,高稳定性将能极大拓宽脂肪酶的可进化性,提高酶的发展和应用潜力[12]。
近年来,研究者们通过各种策略对T1脂肪酶进行修饰改造,Ruslan等[13]通过在环间引入额外的离子对设计了T1脂肪酶突变体D311E,增加了T1脂肪酶的热稳定性,突变体比野生型T1脂肪酶表现出更高的Tm值。Wang等[14]利用分子动力学(MD)模拟分析了不同温度下T1脂肪酶盖子构象的转变,通过活性位点处水分子的分布推测出T1脂肪酶的催化机制,并适用于其他耐热性脂肪酶。Tang等[15]研究了T1脂肪酶盖子结构域的疏水氨基酸对底物选择性和热稳定性的影响,使突变体A186S和A190S的催化效率(kcat/Km)提高了35%-50%,但热稳定性下降。Wahab等[16]将T1脂肪酶的Gln114突变成Trp,导致蛋白稳定性显著下降,催化活性降低。
然而,之前对于脂肪酶包括T1脂肪酶在内的改造重心主要集中在酶活和热稳定性两方面,很难使酶其他方面的酶学性质,如pH、金属离子、有机溶剂耐受性等尽可能同时得到改善,对这些酶学性质的详细研究比较少,由于T1脂肪酶作为生物催化剂在工业应用中会受到各种条件的胁迫,因此酶整体的酶学性质依旧有待改良。考虑到适当的压力会使酶的α螺旋和β折叠不易压缩,可提高酶在高温下的热稳定性[17]。此外,目前已知20多种酶在压力下会更稳定且存在明显的压力激活现象[18]。基于此,本研究前期通过压力扰动耦合分子动力学模拟的方法对盖子结构进行理性设计,最终得到3个效果较好的单点突变体A190L、L188M和A190Y。有趣的是,将氨基酸残基Ala190突变成疏水性强的Leu和疏水性较弱的Tyr后都产生使蛋白稳定性增强的趋势,于是将L188M与Ala190处的两个定点突变分别组合作深入探究,对突变体展开最适温度、温度稳定性、最适pH、pH稳定性、有机溶剂耐受性、金属离子耐受性以及底物选择性等酶学性质研究,同时将单点与复合突变效果进行比较,试图找到酶学性质改善更为全面的T1脂肪酶突变体,以进一步拓宽该酶的工业应用价值。
1 材料与方法
1.1 材料
1.1.1 主要模拟与分析软件 GROMACS 5.0.3、FoldX、I-mutant 2.0、STRUM、DynaMut。
1.1.2 菌种及质粒 本实验用到的克隆宿主Escherichia coli(E.coli)JM109和质粒pET28a均由本实验室保存;大肠杆菌表达宿主E.coli BL21(DE3)购自生工生物工程有限公司。
1.1.3 主要实验材料 蛋白胨、酵母粉、琼脂粉和卡那霉素,上海生工生物科技有限公司;咪唑、IPTG和酪氨酸,上海麦克林生化科技有限公司;T4 DNA连接酶、限制性内切酶(EcoR I 和 BamH I),TaKaRa公司;棕榈酸对硝基苯酯,碧云天生物术有限公司;胶回收试剂盒、PCR产物纯化试剂盒以及质粒提取试剂盒,AxyGen公司;Fast Mutagenesis Kit V2,诺唯赞生物科技有限公司;目的基因及引物由金唯智生物科技有限公司合成。引物如表1所示。

表1 突变体引物
1.1.4 主要实验仪器与设备 YP20002电子分析天平,上海越平科学仪器有限公司;TGL-16M 离心机,湘仪离心机仪器有限公司;SW-CJ-1FD 超净工作台,苏州净化设备有限公司;Tanon 电泳仪,上海天能科技有限公司;EDG-81 PCR仪,东胜创新生物技术科技有限公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;NanoDrop 2000c超微量分光光度计,美国Thermo Scientific公司;DRB200 金属浴,美国HACH公司。
1.2 方法
1.2.1 突变体的虚拟筛选 以野生型T1脂肪酶的晶体结构(PDB ID:2DSN)为初始模型,在不同压力(1 Bar、100 Bar、500 Bar、1 000 Bar、2 000 Bar、4 000 Bar)及313 k条件下,通过GROMACS进行分子动力学模拟,计算蛋白质的RMSD、Rg和RMSF,分析T1脂肪酶整体结构变化趋势,从而确定与T1脂肪酶功能密切相关的关键区域。对关键区域的氨基酸进行虚拟饱和突变,通过FoldX计算自由能变化小于0的突变体,构建初始突变体库,运用稳定性预测软件I-mutant 2.0、STRUM、DynaMut对初始突变体库进行再预测,选择3个软件预测结果的交集作为最终研究对象。
1.2.2 T1脂肪酶突变体构建 将目的基因和pET28a质粒分别用限制性内切酶BamH I和EcoR I进行双酶切,T4 DNA连接酶将酶切产物于16℃金属浴过夜连接,连接产物转入E.coli JM109感受态细胞,涂布于LB(含50 μg/mL的Kan)平板,37℃过夜培养。挑取单菌落进行PCR及核酸琼脂糖凝胶电泳验证,将显示目的条带的单菌落送样进行测序验证,对于测序验证成功的菌液扩大培养并提取质粒。设计突变体引物(表1),通过PCR扩增构建目标突变体,反应体系及条件分别如表2和表3所示。用Dpn I酶对PCR产物进行消化,转入E.coli JM109感受态细胞,涂平板,挑取单菌落验证,将验证成功的菌液扩大培养并提取质粒,转入E.coli BL21(DE3),-20℃保存。
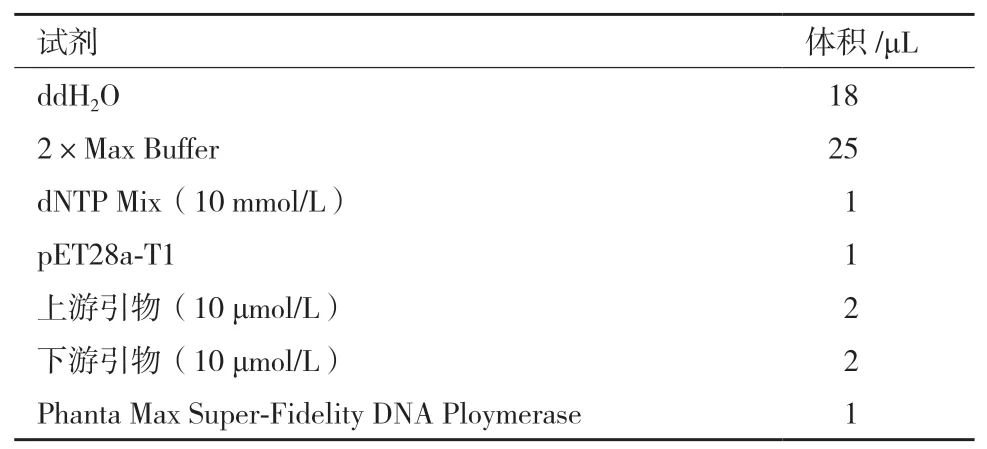
表2 突变体扩增反应体系

表3 突变体扩增条件
1.2.3 T1脂肪酶突变体表达及纯化 将突变体重组质粒菌株E.coli BL21(DE3)接种到LB培养基(含50 μg/mL的Kan)中,37℃振荡培养6-8 h,得种子液,再转接于LB培养基中,37℃振荡培养2-3 h至OD600为0.6-0.8,加入终浓度为0.5 mmol/L的诱导剂IPTG于16℃(200 r/min)振荡培养16 h。收集菌体,用10 mL pH7.4的磷酸盐缓冲液重悬、破碎(450 W,5 s/5 s/,25 min),10 000 r/min高速离心1 h,收集上清。利用1 mL His Trap FF镍离子亲和层析柱进行纯化并进行SDS-PAGE验证,以棕榈酸对硝基苯酯为底物检测酶活。
1.2.4 T1脂肪酶突变体最适温度及温度稳定性 测定最适温度时,以棕榈酸对硝基苯酯(pNPP)为底物,取100 μL纯化酶液于40-80℃条件下分别测定酶活,分别将野生型及突变体最高酶活定义为100%,计算其余温度下的相对酶活。测定温度稳定性时,取100 μL酶液于40-80℃条件下保温2 h后,在标准条件下测定各温度下的残余酶活,将未保温酶液在37℃条件下的酶活定义为100%。脂肪酶酶活单位定义:一定反应条件下每分钟产生1 μmol 对硝基苯酚的酶量为一个脂肪酶水解酶活国际单位。
1.2.5 T1脂肪酶突变体最适pH及pH稳定性 配制pH 4-12的缓冲液:50 mmol/L醋酸盐缓冲液(pH 4-6);50 mmol/L磷酸钾缓冲液(pH 7-8);50 mmol/L Tris-HCl缓冲液(pH 9.0);50 mmol/L glycine-NaOH缓冲液(pH 10-11);50 mmol/L Na2HPO3/NaOH缓冲液(pH 12.0),将缓冲液与酶液以1∶1比例混匀[19],以棕榈酸对硝基苯酯(pNPP)为底物检测酶活。测定最适pH时,将酶液分别与pH 4.0-12.0缓冲液混匀,检测酶活,分别将野生型及突变体的最高酶活定义为100%,并计算其余温度下的相对酶活。测定pH稳定性时,将酶液与pH 4.0-12.0缓冲液混匀,于37℃保温1 h后,在标准条件下测定酶活,将野生型及突变体的最高酶活定义为100%,测定其余pH下的残余酶活。
1.2.6 T1脂肪酶突变体的有机溶剂耐受性 将纯化得到的酶液分别与不同log P值的有机溶剂:二甲基亚砜(-1.38)、乙腈(-0.4)、乙酸乙酯(1.8)、甲苯(2.5)、二甲苯(3.1)、正己烷(3.5)、异辛烷(4.4)、正十四烷(7.6)、正十六烷(8.8)以1∶3的体积比混合,在30℃条件下孵育30 min,并以200 r/min的速度振荡混匀[16,20],最后以棕榈酸对硝基苯酯为底物测定酶活,将未经过有机溶剂处理的酶液酶活定义为100%,计算各有机溶剂处理后的相对酶活。
1.2.7 T1脂肪酶突变体的金属离子耐受性 金属离子是一种常见的添加剂,它对脂肪酶的反应活性会产生明显的影响[21-22],配制Na+、K+、Mg2+、Ca2+、Mn2+、Fe3+、Cu2+、Zn2+溶液,分别将各离子溶液添加到纯化后的脂肪酶液中,使离子终浓度为1 mmol/L,在65℃条件下孵育30 min[16,23],最后以棕榈酸对硝基苯酯为底物在标准条件下测定脂肪酶酶活。将未经过金属离子处理的酶液酶活定义为100%,计算各金属离子处理后的相对酶活[24]。
1.2.8 T1脂肪酶突变体的底物选择性 以不同链长的三酰基甘油酯(C12-C18)为底物测定野生型脂肪酶及突变体的底物偏好性,分别将野生型及突变体脂肪酶在不同链长底物下的最高酶活定义为100%,计算其余链长底物下的相对酶活[15]。
2 结果
2.1 突变体的虚拟筛选
通过不同压力下的分子动力学模拟及RMSD、RMSF和Rg分析发现组成T1脂肪酶盖子结构的α6螺旋为关键区域。该螺旋由15个氨基酸组成(176 FTDRFFDLQKAVLEA 190),为避免带电氨基酸的突变造成蛋白原有盐桥相互作用的损失,将螺旋上的5个带电氨基酸Asp178、Arg179、Asp182、Lys185和 Glu189排除,对其余10个氨基酸进行虚拟饱和突变并通过FoldX计算自由能变化小于0的突变体,得到36个突变体。运用稳定性预测软件I-mutant 2.0、STRUM、DynaMut对36个突变体进行再预测,选择3个软件预测结果的交集,最终得到该研究的3个突变体L188M、A190L和A190Y。
2.2 T1脂肪酶突变体的表达及纯化鉴定
T1脂肪酶及其突变体纯化酶液的SDS-PAGE验证结果如图1所示,图1-A为野生型T1脂肪酶纯化结果,图1-B为突变体纯化结果,由图可知蛋白纯化后在43 kD处出现一个明显的蛋白条带,与目的蛋白大小相符,证明本实验通过纯化得到了较纯的目的蛋白,可用于后续酶学性质的测定。
以棕榈酸对硝基苯酯(pNPP)为底物表征酶活并计算蛋白收率(表4)。结果显示野生型T1脂肪酶及突变体均表现出酶活,突变体酶活相比野生型提高为12%-22%,且复合突变体酶活较单点突变体略高,野生型及突变体的蛋白收率为43%-57%。

图1 纯化蛋白SDS-PAGE电泳验证结果图
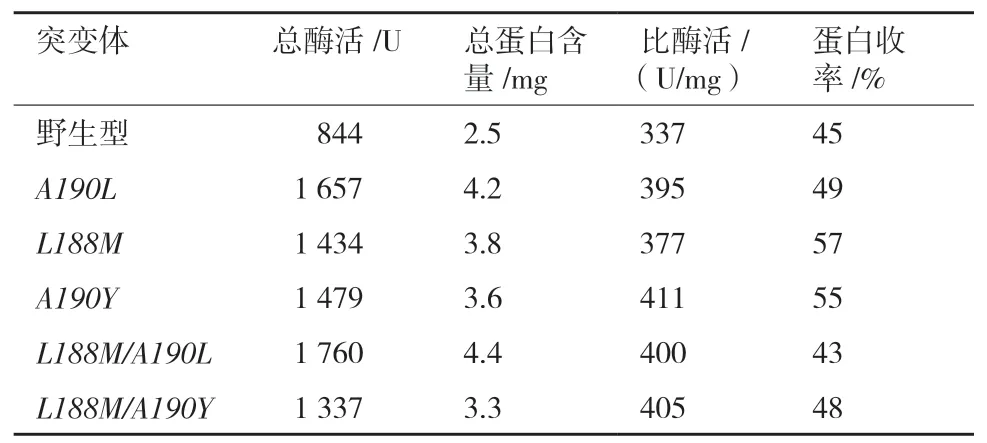
表4 突变体纯化小结
2.3 T1脂肪酶突变体最适温度及温度稳定性
最适温度及温度稳定性结果分别如图2和图3所示,图2显示野生型T1和3个单点突变体的最适温度为65℃,而复合突变体L188M/A190L和L188M/A190Y的最适温度为70℃。图3显示单点突变体及复合突变体的温度稳定性相比野生型均提高,并且复合突变体相比单点突变体提高幅度更明显,60℃时,野生型残余酶活为56%,L188M/A190L残余酶活为80%,相比野生型,复合突变体温度稳定性提高43%。L188M/A190Y的温度稳定性在70℃时提高显著,残余酶活为70%,而野生型残余酶活为48%,相比野生型,复合突变体温度稳定性提高了46%。
2.4 T1脂肪酶突变体的最适pH及pH稳定性
最适pH及pH稳定性结果分别如图4和图5所示,结果显示野生型T1及突变体的最适pH均为9.0,而突变体的pH稳定性相比野生型呈现不同程度的提高,单点突变体A190L比L188M和A190Y的pH稳定性略佳,在pH4-6的稳定性提高较明显,其中pH为6时提升效果更显著,A190L残余酶活为59%,野生型为41%,相比野生型,A190L的pH稳定性提高44%。而复合突变体整体pH稳定性高于单点突变体,其中L188M/A190L稳定性幅度提高更明显,对于pH 12的稳定性约为野生型的2倍。
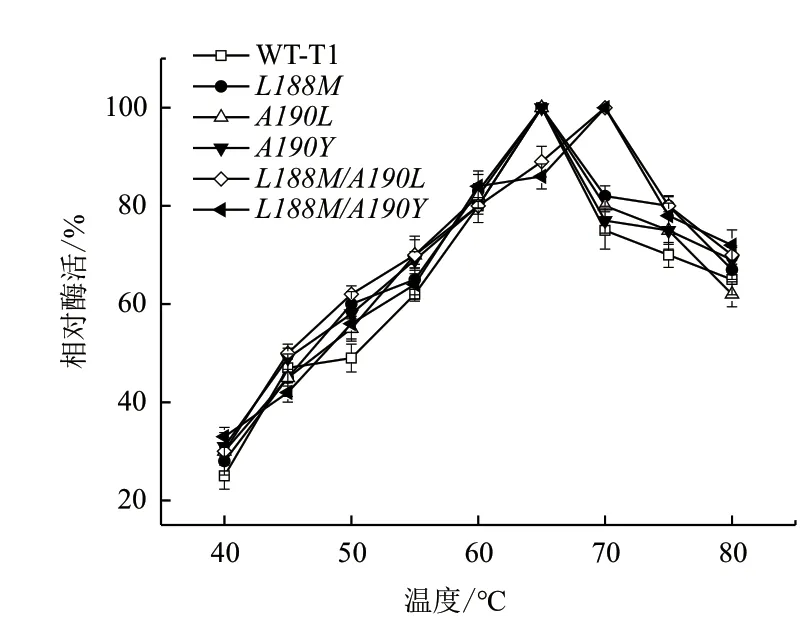
图2 野生型T1脂肪酶及突变体最适温度
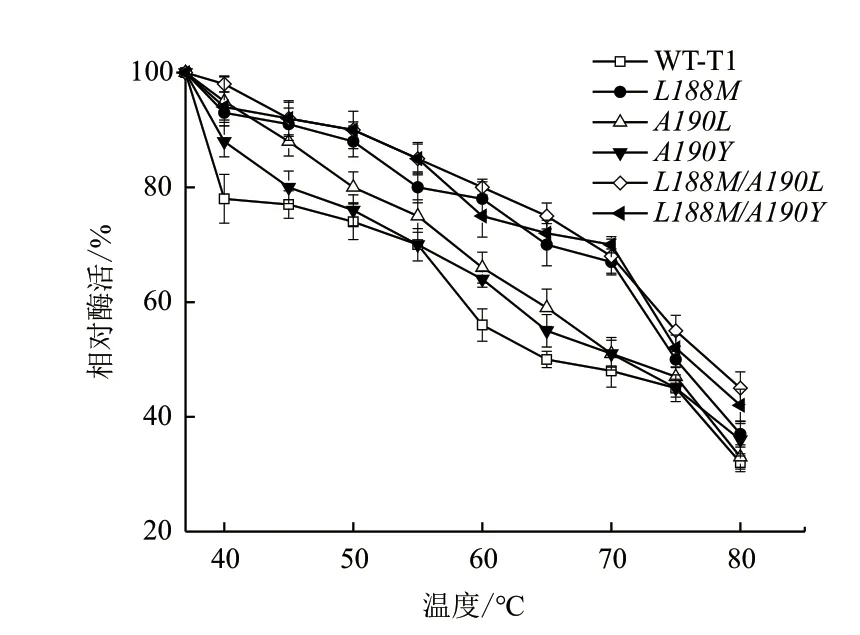
图3 野生型T1脂肪酶及突变体温度稳定性
2.5 T1脂肪酶突变体的有机溶剂耐受性
图6反映了突变体对不同logP值有机溶剂的耐受性,结果显示乙酸乙酯对野生型T1及突变体均有较强的抑制作用,酶活显著降低。对于野生型及单点突变体而言,有机溶剂的作用效果基本相同,但是单点突变体的耐受性略高于野生型。复合突变体的耐受性相比野生型及单点突变体显著增强,尤其是对二甲基亚砜及正十六烷的耐受性提高最为明显,野生型脂肪酶经两种溶剂处理后的残余酶活分别为45%和33%,L188M/A190L的残余酶活分别为85%和95%,L188M/A190Y的残余酶活为88%和85%,相比野生型,L188M/A190L对两种溶剂的耐受性分别为野生型的1.88倍和2.73倍,L188M/A190Y的耐受性为野生型的1.96倍和2.58倍。

图4 野生型T1脂肪酶及突变体最适pH
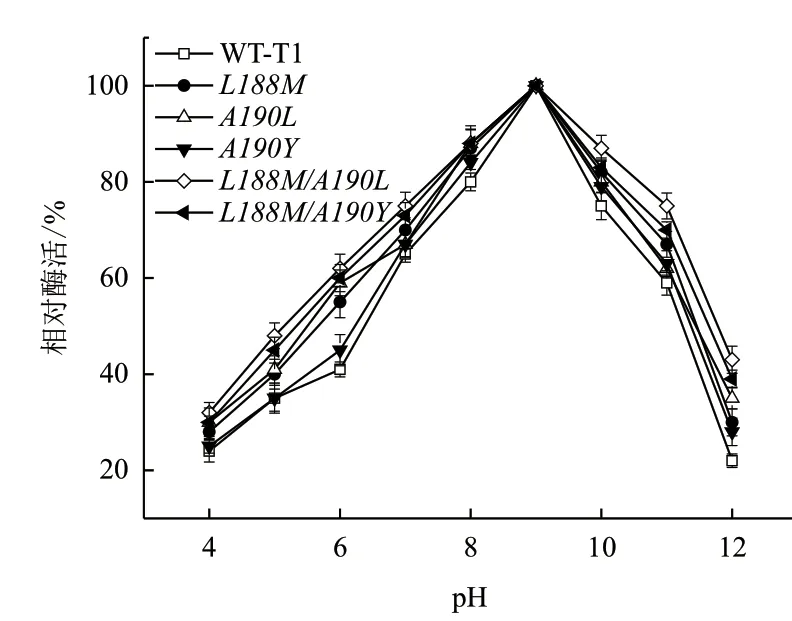
图5 野生型T1脂肪酶及突变体pH稳定性

图6 野生型T1脂肪酶及突变体有机溶剂耐受性
2.6 T1脂肪酶突变体的金属离子耐受性
如图7所示,经不同金属离子处理后,野生型T1及突变体在Na+、K+、Mg2+、Ca2+和Mn2+存在条件下依然能保持较高酶活,而Fe3+、Cu2+、Zn2+对酶活具有明显的抑制作用。突变体对于各种金属离子的耐受性相比野生型有不同程度的提高,复合突变效果更加显著,经Fe3+和Cu2+处理后,野生型残余酶活为30%和35%,L188M/A190L残余酶活为55%和62%,相比野生型脂肪酶,L188M/A190L对于Fe3+和Cu2+的耐受性分别提高50%和77%,且对Zn2+的耐受性为野生型的2倍。L188M/A190Y对Fe3+耐受性显著增强,处理后残余酶活为65%,对Fe3+的耐受性为野生型的2.17倍。
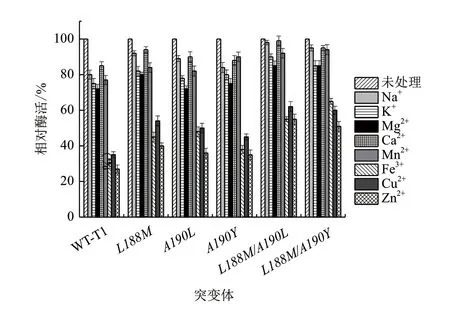
图7 野生型T1脂肪酶及突变体金属离子耐受性
2.7 T1脂肪酶突变体的底物选择性
野生型T1及突变体对不同链长底物的选择性如图8所示,结果表明底物链长为C12时,脂肪酶的反应活性最佳,偏好性次之的底物链长为C10,而底物链长为C14-C18时,反应活性较低。整体而言,突变体较野生型T1对不同底物的反应活性提高,复合突变体比单点突变体反应活性提高趋势更加显著,对于长链底物(C16-C18)的活性增强尤其明显,底物链长为C16和C18时,L188M/A190L反应活性分别为野生型的1.65倍和2.7倍,L188M/A190Y为野生型的1.5倍和2.25倍。
3 讨论
综合上述实验结果可以看出单点突变体L188M、A190L和A190Y的温度、pH稳定性以及有机溶剂耐受性、金属离子耐受性相比野生型均有不同程度的提高,表明突变体较野生型更加稳定,抗外界胁迫的作用力增强。推测L188M将Leu突变成侧链更大的Met,一方面增加了空间位阻,有利于酶稳定性的增强;另一方面,引入的Met可能增强了稳定蛋白质结构的作用力,如氢键等,因为蛋白质稳定性与氢键的数量成正比。疏水相互作用是指在水介质中,疏水性侧链或者基团为了避开水的需要而被迫接近的倾向,疏水作用主要影响蛋白质的构象熵,是维持蛋白质稳定性的关键因素[25-27]。A190L将Ala突变成疏水性较强的Leu,可能增加了α螺旋内部疏水侧链之间的相互作用,使α螺旋更加稳定,从而使蛋白整体刚性增加,稳定性增强。A190Y将Ala突变成Tyr后,疏水性减弱,但是抗外界因子胁迫能力增强,表明稳定性也得到了改善,推测突变后引入的酪氨酸因含有芳香环增强了与周围氨基酸,如Phe、Tyr、Trp之间的芳香环作用,即π-π堆积,该作用力会对蛋白质稳定性产生重要影响[28]。另外将Ala突变成侧链基团更大的Tyr,会增加空间位阻,也有利于蛋白稳定性的增强。突变体酶活及对不同链长底物的反应活性比野生型高,表明突变体除了整体稳定性提高外,催化性能也得到了改善,突变后酶的活性位点更容易打开,酶与底物结合更容易。脂肪酶活性中心的催化三联体一般位于疏水性裂缝中,活性位点打开主要依靠催化口袋周围疏水氨基酸的疏水作用力,推测突变后蛋白盖子结构疏水作用力增强,盖子作为活性位点的保护结构在强疏水力的环境下更易打开,活性中心暴露,底物更容易进入疏水通道与活性部位相结合发生催化反应[29-30]。
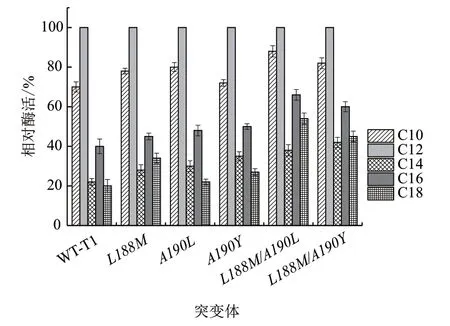
图8 野生型T1脂肪酶及突变体底物选择性
复合突变体L188M/A190L和L188M/A190Y较单点突变体而言,酶学性能改善效果更显著,可能由于两个突变位点之间产生了协同作用,另外由于两个位点相隔很近,同时突变后酶学性能达到叠加改善效果的可能性很高[31-32]。突变位点L188和A190都位于T1脂肪酶盖子结构的C端,进行组合突变后,由于C端氨基酸疏水等作用力增强,会使盖子结构C端与N端作用力发生变化,而两者之间的相互作用对蛋白稳定性会产生巨大的影响[33],因此推测盖子结构两端作用力的增强也是导致复合突变体酶学性质改善的重要原因。
4 结论
本研究对T1脂肪酶的盖子结构进行定点突变,对3个单点突变体L188M、A190L、A190Y和两个复合突变体L188M/A190L、L188M/A190Y进行酶学性质表征,结果显示突变体较野生型T1脂肪酶的酶学性能均呈现不同程度的增强,且复合突变体酶学性能改善更明显,温度稳定性、pH稳定性、有机溶剂、金属离子耐受性、底物选择性等酶学性质均得到综合性提高,组合突变比单点突变效果更突出。从而获得了酶学性能改善更为全面的T1脂肪酶突变体,使该酶抗外界环境因子胁迫的能力得到一定程度增强,对于扩大T1脂肪酶的应用价值具有重要意义,拓宽了T1脂肪酶的开发和应用前景。
