新型冠状病毒实时荧光双重逆转录RPA的建立及其在食品检测中的应用
2020-12-04吕继洲吴绍强张舟邓俊花袁向芬王彩霞冯春燕林祥梅
吕继洲 吴绍强 张舟 邓俊花 袁向芬 王彩霞 冯春燕 林祥梅
(中国检验检疫科学研究院,北京 100176)
自2019年12月以来,新型冠状病毒(SARSCoV-2)所致的新型冠状病毒肺炎(COVID-19)在湖北省武汉市暴发蔓延,感染人数不断增加。根据约翰霍普金斯大学数据显示,截至北京时间2020年11月6日07时03分,全球累计新冠肺炎确诊病例4897万例,死亡病例123万,传染力远超2003年的非典型肺炎(SARS)[1]。
SARS-CoV-2是β属单股正链RNA病毒,具有典型的5'端帽结构和3'端Poly(A)尾,属于巢状病毒目、冠状病毒科。冠状病毒分为α、β、γ、δ四个属,因其在电镜下的形状似皇冠,故命名为冠状病毒[2]。SARS-CoV-2基因在同一条编码链上有5个典型的开放读码框架(ORF),包括开放读码框架1ab多蛋白(ORF1ab,7096 aa),刺突糖蛋白(Spike gene,S gene,1273 aa),包膜蛋白(Envelope gene,E gene,75 aa),膜蛋白(Membrane gene,M gene,222 aa)以及核衣壳蛋白(Nucleocapsid gene,N gene,419 aa)[3]。SARS-CoV-2感染机体后,病毒RNA是最先能被检测的标志物,人体免疫系统产生的抗体(IgM、IgG)滞后于病毒核酸,目前对COVID-19确诊基本以SARS-CoV-2病毒核酸检测阳性为依据[4]。截止到2020年4月7日,国家药监局审批的新型冠状病毒检测试剂盒共25个,其中有16个试剂盒是核酸检测方法。实时荧光RT-PCR敏感度高、特异性强,成本较低,成为目前主要的检测方法。与此同时,宏基因高通量测序技术、数字PCR、LAMP、RPA以及基因芯片技术也已经应用于SARS-CoV-2核酸检测[4]。SARS-CoV-2病毒可能来源于蝙蝠以及穿山甲等动物[5-6]。因此,在动物组织和动物源性食品中开展SARS-CoV-2病毒的检测监测就成为防控COVID-19疫情的一个重要环节,目前尚未有相关SARS-CoV-2检测技术在食品及动物组织中应用的报道。
重组酶聚合酶扩增技术(Recombinase polymerase amplification,RPA)是2006年Piepenburg等研发出的一种等温扩增技术,它能在37-42℃恒温条件下快速完成数十亿DNA扩增。RPA反应体系中主要包括重组酶(uvsX)、单链结合蛋白(Gp32)和链置换DNA聚合酶Bsu,其反应原理不同于体外DNA复制的PCR技术,重组酶uvsX在常温下就能打开DNA双链进行变性,因此不需要热循环PCR仪[7]。RPA反应技术灵敏度高,反应快速,方法简便易行。本研究目的为建立针对SARS-CoV-2的荧光RPA快速检测技术,并初步应用于食品、动物组织器官以及临床样本中SARS-CoV-2的检测。
1 材料与方法
1.1 材料
试验中所需引物、探针以及靶标基因由北京六合华大基因科技有限公司合成并提供;食品(包括生羊肉片、生猪肉、熟牛肉、熟鸡肉、香肠以及速冻水饺)购自7fresh生鲜超市;实验用5-6周的Balb/C雌鼠购自北京维通利华实验动物技术有限公司;SARS-CoV-2病毒cDNA核酸由浙江大学生命科学学院提供;6份SARS-CoV-2病毒疑似临床样本(编号:2011、2012、2013、2014、2015及2016)由上海市临床检验质量控制中心提供。H1N1甲型流感病毒(influenza A/H1N1 virus)、冠状病毒猪流性腹泻病毒(PEDV)、冠状病毒猪传染性胃肠炎病毒(TGEV)、小反刍兽疫病毒(PRRV)、口蹄疫病毒(FMDV)、轮状病毒(RV)等其核酸RNA由中国检验检疫科学研究院动物检验与检疫研究所实验室保存。SARS-CoV-2病毒S基因全长质粒2019-nCoV S由生工生物工程(上海)股份有限公司提供,质粒载体为pUC57。
1.2 方法
1.2.1 RNA核酸的提取 相关样品材料的RNA核酸提取均采用“Qiagen QIAamp Viral RNA Mini Kit”试剂盒(Qiagen,Hilden,Germany),并按使用说明书操作。
1.2.2 SARS-CoV-2假病毒颗粒制备 以GenBank公布Wuhan-Hu-1分离株(登录号为NC_045512.2)基因序列为基准,选择N基因部分序列进行拼接重组,基因序列总长914 bp,加酶切位点后,送华大基因进行人工合成,连入噬菌体表达载体p-MS2。经过一系列表达与纯化,获得SARS-CoV-2的假病毒颗粒(VLPs),使用SM(0.1 mol/L NaCl,8 mmol/L MgSO4·7H2O,50 mmol/L Tris-Cl pH7.5,2%明胶溶液)溶液重悬VLPs,作为阳性质控品,模拟病毒。
1.2.3 RPA引物探针的设计 按照RPA引物探针设计原则[8],分析SARS-CoV-2的N基因以及S基因保守序列,设计两套RPA引物、探针(表1)。

表1 RPA试剂引物探针设计与序列
1.2.4 荧光RT-RPA反应 RNA恒温快速扩增试剂盒(荧光型)购自潍坊安普未来生物科技有限公司,货号WLRE8205KIT,含有逆转录酶、重组酶、聚合酶等,以RNA核酸为模板可在20 min内完成检测全过程。单重荧光RPA反应体系(50 μL):Buffer A 29.4 μL,上下游引物各2 μL(10 μmol/L),探针0.6 μL(10 μmol/L),核酸模板 2 μL,RNase-free Water 9.3 μL,ROX染料0.2 μL,Buffer B 2.5 μL。双重荧光RPA反应体系(50 μL):Buffer A 29.4 μL,上下游引物1各1 μL(10 μmol/L),探 针1 0.4 μL(10 μmol/L),上下游引物2各1 μL(10 μmol/L),探针2 0.4 μL(10 μmol/L),核酸模板2 μL,RNase-free Water 9.1 μL,ROX染料0.2 μL,Buffer B 2.5 μL。反应条件设置为:42℃,20 min,每30 s收集一次荧光信号。仪器自动采集荧光信号,可实时观察荧光扩增信号,使用ABI的7500荧光PCR仪。为了保证反应同时进行,2.5 μL Buffer B应该最后加在八连管的盖子上,小心翻转盖上,然后上下颠倒八连管混匀,离心。整个操作过程要在冰上进行。RPA 反应在 42℃恒温下反应4 min 后,取出反应管进行涡旋震荡并离心,再在42℃恒温下反应16 min。
1.2.5 N基因荧光RPA分析敏感度试验取50 μL的VLPs,RNA核酸由Qiagen QIAamp Viral RNA Mini Kit试剂盒提取,最终用50 μL Elution Buffer 洗脱RNA,放置于-80℃保存或直接用于RPA检测。提取VLPs核酸RNA,应用微滴式逆转录数字PCR对VLPs所含RNA进行精确定量(N基因拷贝数,结果未展示),其浓度为5.32×105copies/μL。然后经稀释,调整,使N基因拷贝数浓度为5×104-5 copies/μL,RPA反应体系加入2 μL核酸,反应体系中核酸终浓度为105-10 copies/μL。
1.2.6 S基因荧光RPA分析敏感度试验 以生工生物工程(上海)股份有限公司提供的2019-nCoV S质粒为模板,按照其浓度拷贝数换算公式1.492×1011copies/μg,经系列倍比稀释,使得2019-nCoV S质粒拷贝数浓度为5×104-5 copies/μL。RPA反应体系加入2 μL模板,最终浓度为105-10 copies/μL。
1.2.7 荧光RPA分析特异性试验 以influenza A/H1N1、PEDV、TGEV、PRRV、FMDV、RV等病毒的核酸RNA为模板,进行荧光RT-RPA反应。SARS-CoV-2的cDNA作为阳性对照,而Rnase-free water作为阴性对照。
1.2.8 荧光RPA应用于食品中检测SARS-CoV-2 6种常见食品,各取50 mg;阳性组,每份样品与10 μL新冠病毒VLPs混合;对照空白组,每份样品与10 μL SM溶液混合。RNA核酸由Qiagen QIAamp Viral RNA Mini Kit试剂盒提取,最终应用50 μL Elution Buffer 洗脱RNA,放置于-80℃保存或直接用于RPA检测。SARS-CoV-2的cDNA作为阳性对照,而Rnase-free water作为阴性对照。
1.2.9 荧光RPA应用于动物组织中检测SARSCoV-2 5-6周的Balb/C雌鼠,实验组尾静脉注射100 μL SARS-CoV-2的VLPs,静置15 min;对照组选用同一批5-6周的Balb/C雌鼠,尾静脉注射100 μL SM溶液,静置15 min。取心、肝、脾、肺、肾及肌肉组织(大腿)各50 mg,RNA核酸由Qiagen QIAamp Viral RNA Mini Kit试剂盒提取,最终应用50 μL Elution Buffer 洗脱RNA,放置于-80℃保存或直接用于RPA检测。SARS-CoV-2的cDNA作为阳性对照,而Rnase-free water作为阴性对照。
1.2.10 荧光RPA应用于临床样本中检测SARSCoV-2 上海市临床检验质量控制中心提供的样本为灭活的临床样本,600 μL/支。提取RNA时,取100 μL样品,用Qiagen QIAamp Viral RNA Mini Kit试剂盒提取,最终应用50 μL Elution Buffer 洗脱RNA,放置于-80℃保存或直接用于RPA检测。SARSCoV-2的cDNA作为阳性对照,而Rnase-free water作为阴性对照。
本研究涉及所有荧光RPA检测,包括灵敏度、特异性分析以及样品检测,每组试验均独立重复3次,结果一致的,展示其中一次结果。
2 结果
2.1 RPA引物探针灵敏度
首先,以倍比稀释的SARS-CoV-2病毒VLPs以及2019-nCoV S质粒作为模板,应用单重荧光RPA检验比较NF/NR/NP以及SF/SR/SP 两组引物探针组合的敏感性,结果显示SF/SR/SP组合的分析敏感性优于NF/NR/NP。SARS-CoV-2双重荧光RPA方法选择NF/NR/NP及SF/SR/SP组合。
双重荧光RPA反应体系下,以S基因为靶标基因的SF/SR/SP引物探针组合分析敏感度可达10 copies/reaction(图1),与WHO推荐的实时荧光PCR检测方法基本一致;以N基因为靶标基因的NF/NR/NP引物探针组合分析敏感度(检测限值)可达102copies/reaction(图2)。
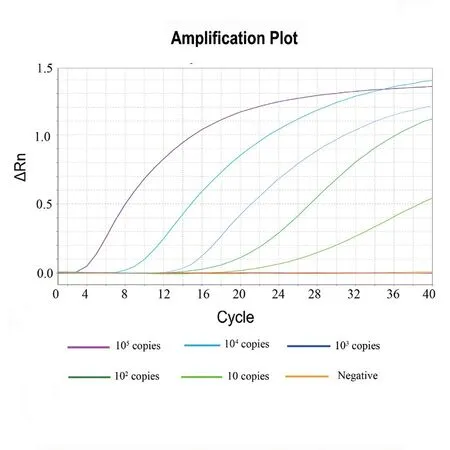
图1 双重荧光RT-RPA针对S基因的分析灵敏度检测
2.2 RPA引物探针特异性
以influenza A/H1N1、PEDV、TGEV、PRRV、FMDV、RV等病毒的核酸RNA以及SARS-CoV-2的cDNA为模板,进行双重荧光RT-RPA检测,结果只有SARS-CoV-2的cDNA模板出现扩增条带(图3),说明该方法具有良好的特异性。
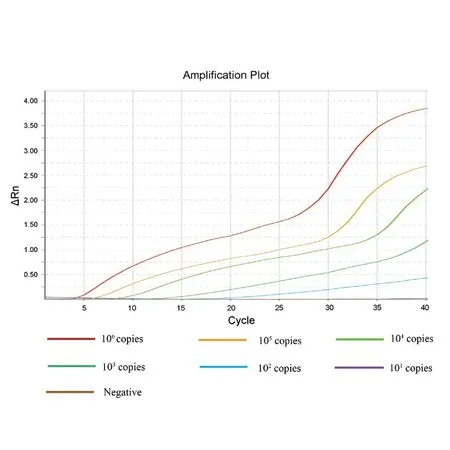
图2 双重荧光RT-RPA针对N基因的分析灵敏度检测

图3 双重荧光RT-RPA分析特异性检测
2.3 荧光RPA应用于食品中SARS-CoV-2的VLPs检测
将6种生或熟制食品与新冠病毒VLPs混合,与此同时,6种食品与SM溶液混合作为对照,提取RNA核酸,用做荧光RPA中的模板。结果(图4)显示:6种食品,包括生猪肉、生羊肉、熟牛肉、香肠、熟鸡肉及速冻饺子,不影响应用RPA荧光检测技术从中检测SARS-CoV-2的VLPs,添加了VLPs颗粒的样品呈现阳性,无VLPs添加样品食品均为阴性。
2.4 荧光RPA应用于动物组织中SARS-CoV-2的VLPs检测
取尾静脉注射100 μL SARS-CoV-2的VLPs的Balb/C小鼠的相关组织,注射SM溶液的Balb/C小鼠作为空白对照,提取RNA核酸,用做荧光RPA中的核酸模板。结果(图5)显示:心、肝、蜱、肺、肾、肌肉等动物组织样品不影响应用RPA荧光检测技术从中检测SARS-CoV-2的VLPs,添加了VLPs颗粒的样品呈现阳性,无VLPs添加样品动物组织均为阴性。
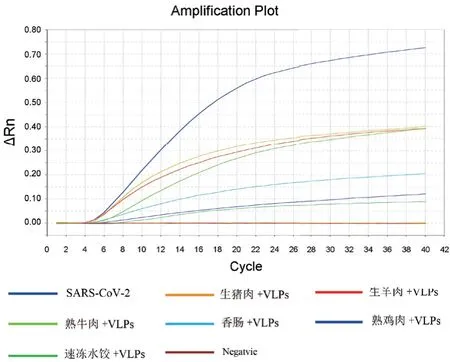
图4 双重荧光RT-RPA食品中检测新冠病毒VLPs

图5 双重荧光RT-RPA食品中检测小鼠组织中VLPs
2.5 荧光RPA应用于临床样本检测
提取6支临床样本的RNA核酸,作为荧光RPA中的模板。结果显示:临床样本2012/2014/2015/2016为阳性,2011/2013样本为阴性(图6-7)。经上海市临床检验质量控制中心审核,临床样本检测结果符合率100%,获得上海市临床检验中心组织颁发的证书。
3 讨论
荧光RT-RPA作为实时荧光RT-PCR的替代技术,其可在37-42℃下恒温扩增目标核酸,免去了传统PCR技术所需要的升降温过程。以实时荧光PCR为例,其整个检测过程约为80 min,包括20 min反转录以及60 min的PCR扩增及检测过程,而荧光RT-RPA检测过程总计为20 min,节约检测时间1 h。此外,接近于室温的恒温扩增条件,也简化了仪器设备中的升温、降温模块,使得荧光RPA检测仪器的小型化、手持化成为现实[9]。

图6 双重荧光RT-RPA检测临床样本(S基因)
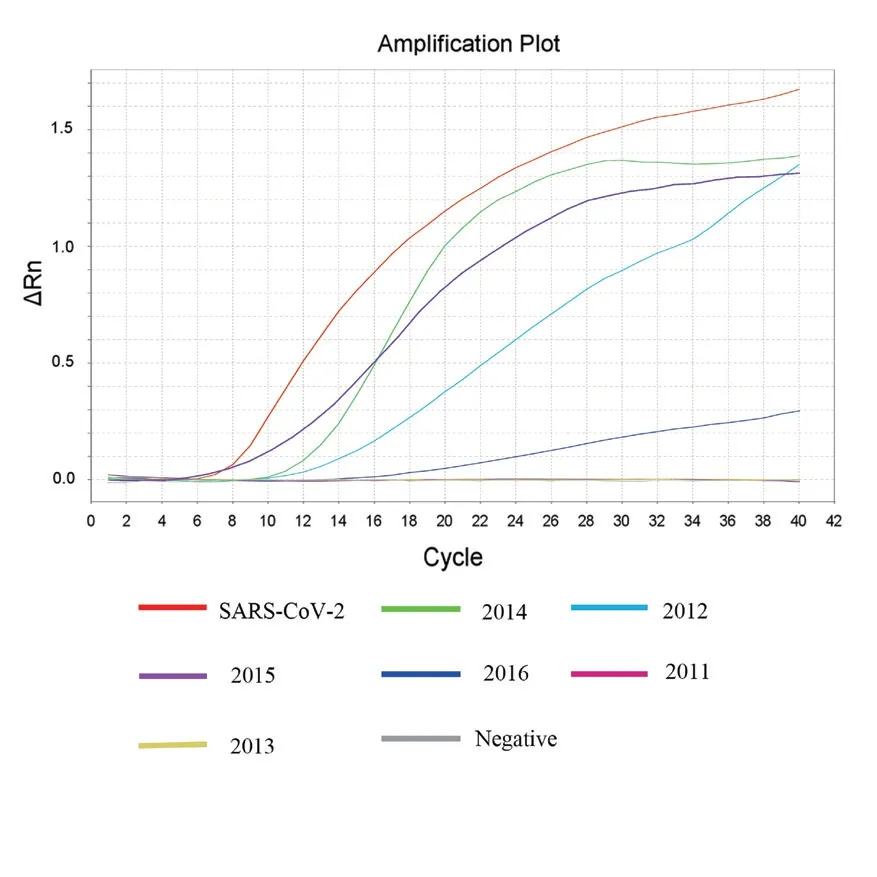
图7 双重荧光RT-RPA检测临床样本(N基因)
样品前处理及RNA核酸提取是病毒核酸检测的首要步骤。目前病毒核酸提取主要方法有离心柱法和磁珠法[10]。离心柱法采用特殊的硅基质吸附材料吸附核酸,核酸纯度高,操作标准化,但是也存在耗时长、提取步骤反复离心等缺点。磁珠法应用复合磁性微球,其表面连接可特异性可逆吸附核酸的功能基团,利用磁场实现核酸的富集与分离纯化,具有灵敏度高、自动化、高通量等优势,但整个提取过程耗时长,且成本较高。近期,一些病毒RNA核酸快速提取试剂上市,其基本原理减少核酸提取步骤,仅保留核酸裂解步骤[11]。通过去污剂以及95℃加热等破坏病毒外壳释放病毒核酸,同时加入RNA核酸稳定剂防止核酸降解,全程仅需5 min,配合荧光RT-RPA检测方法,可将整个SARS-CoV-2检测时间缩短到30 min内,适用于COVID-19的食品、动物产品以及快速现场检疫筛查及监管执法等特殊场景,具有明显的优势。然而,RNA核酸快速提取技术还不完善,其缺点为敏感度不高、核酸提取效率低、仅适用于咽喉拭子等简易样本等缺点,新一代的高灵敏度快速核酸提取技术尚待进一步研发。
目前,国家批准的新冠病毒的核酸检测试剂基本是通过靶向特定区域,对病毒的ORF1ab、N基因、E基因、S基因等位点开展检测,以双靶标为主,单靶标和三靶标均比较少见[12]。本研究建立的双重荧光RT-RPA检测方法,以N基因和S基因作为双靶标。N基因编码的N蛋白是SARS-CoV-2的核衣壳蛋白,位于病毒内部,在β属冠状病毒之间相对比较保守,此外N蛋白还是干扰素(Interferon,IFN)的拮抗剂和病毒编码的RNA干扰抑制因子,常用作冠状病毒检测的靶点[13]。S基因编码的S蛋白位于病毒外壳,通过识别宿主细胞受体介导病毒和细胞膜融合在病毒感染中发挥重要作用。S蛋白是宿主中和抗体的重要作用位点以及疫苗(尤其是多肽和mRNA疫苗)、治疗性抗体、小分子和诊断开发的关键靶点[14]。目前,正在研发的核酸疫苗(mRNA疫苗和DNA疫苗)基本是以S基因为基础,导入宿主细胞后产生S蛋白抗原,刺激机体产生体液及细胞介导的免疫反应。美国制药公司Moderna研发的mRNA疫苗就是携带S基因,第一批疫苗(mRNA-1273)已经开展了临床试验(NCT04283461)[14]。本研究建立的双重荧光RPA检测方法,可用于感染或免疫初期区分鉴定以S基因为基础的核酸疫苗免疫还是SARS-CoV-2病毒野毒株感染。长期看,区分免疫还是感染应以检测以S蛋白或N蛋白为靶标的特异性抗体的免疫学方法为主。
近期,国内外报道SARS-CoV-2病毒可感染犬、猫等宠物,另有研究证实SARS-CoV-2可在雪貂和猫的呼吸系统和消化系统高效复制,存在空气传播COVID-19的可能[15]。目前,作为人畜共患病病原,SARS-CoV-2病毒感染动物并通过食品链传入餐桌的可能性不能完全排除。因此,在食品、动物组织中开展SARS-CoV-2病毒的检测监测工作可以进一步阻断COVID-19通过动物源性食品传播的可能。然而,食品、动物组织样品基质复杂,含有大量的油脂、蛋白甚至植物纤维,对核酸提取、检测方法的影响未可知。本研究采用假病毒颗粒替代SARS-CoV-2,可提供从病毒核酸提取到检测的全流程质控,证实了本研究建立的双重荧光RT-RPA检测方法可用于食品、动物组织以及临床样本中SARS-CoV-2检测,应用场景丰富,检测效果良好。
4 结论
本研究建立的SARS-CoV-2病毒荧光RPA检测方法,操作简便,检测速度快(20 min),灵敏度高、特异性好、双靶标,经试验此方法适用于在食品、动物组织器官以及临床样本中检测SARS-CoV-2病毒。
