家蝇抗菌肽MDC协同庆大霉素抗普通变形杆菌作用研究
2020-12-04陈晴汝桂水清卢雪梅
陈晴汝 桂水清 卢雪梅
(1.广东药科大学生命科学与生物制药学院 广东省生物活性药物研究重点实验室,广州 510006;2.深圳市第二人民医院 深圳大学第一附属医院中心,深圳 518031)
普通变形杆菌(Bacillus proteus vulgaris)广泛存在于土壤、水体和粪便污染的物质之中。这种细菌是引起食物中毒的常见致病菌,当摄入变形杆菌污染的食物后,可引发中毒性肠炎和过敏性中毒等疾病[1]。庆大霉素对变形杆菌(吲哚阳性和阴性)属的细菌均有较强的抗菌活性。临床上庆大霉素可以用于治疗由细菌感染引起的轻微肠炎。由于不恰当的使用抗生素,普通变形杆菌的耐药率不断上升,对头孢唑林、复方磺胺甲噁唑都呈现比较高的耐药性(> 40%),所以寻找能够与庆大霉素联用治疗普通变形杆菌感染的药物,从而减少庆大霉素用量,减缓普通变形杆菌耐药率上升成为临床迫切所需[2-4]。
抗菌肽(Antimicrobial peptides,AMP)是一类广泛存在于生物体中的具有抗菌活性的肽类物质,可以抑制病毒、细菌、真菌、肿瘤细胞、寄生虫等的生长,还具有免疫调节的作用[5-9]。目前关于抗菌肽的抗菌机理主要涉及两类:膜结合型与非膜结合型[10]。膜结合型模式下阳离子型抗菌肽可通过静电作用结合到负电荷的细菌细胞膜表面,通过改变膜构象或形成疏水性离子通道,导致细菌因内容物泄露而死亡[11]。非膜结合型模式下抗菌肽可通过抑制细胞壁合成、抑制细胞呼吸、抑制细胞外膜蛋白合成等导致靶细胞死亡[12]。与传统的抗生素相比,抗菌肽不易产生耐药性,且副作用小。
昆虫抗菌肽是昆虫血淋巴中形成的一类抗菌肽,在昆虫受到外界微生物的刺激时,能够大量迅速地合成。家蝇抗菌肽(Musca domestica cecropin,MDC)是本实验室从家蝇幼虫脂肪体cDNA文库中克隆的一种昆虫抗菌肽。实验室的前期研究证明MDC能够在体外杀死金黄色葡萄球菌(Staphylococcus aureus,S.aureus),大肠埃希氏菌(Escherichia coli,E.coli)等多种革兰阳性菌和革兰阴性菌[13-14]。更为重要的是,我们发现家蝇抗菌肽可快速杀灭多重耐药大肠杆菌(临床分离株MDR E.coli,GIM1.457),且在高达200 μmol/L的浓度范围内对人红细胞没有毒性[13]。
庆大霉素是一种氨基糖苷类药,其抗菌机制是作用于细菌体内的核糖体,抑制细菌蛋白质合成,并破坏细菌细胞膜的完整性[15]。抗菌肽MDC能够破坏细菌细胞膜或穿过细菌细胞膜作用于胞内靶位点,作用机制独特,不易产生耐药性,从抗菌机制上分析二者可以联合应用,但两药联合对变形杆菌的抗菌作用研究未见报道。本研究拟通过对抗菌肽MDC和庆大霉素的体外联合抗菌作用及其机制研究,评价两药的联合用药效果,并利用流式细胞术和电子显微镜术对其作用机制进行初步探讨,以期为临床上两药的联合使用,减少庆大霉素用量及毒副作用提供实验依据。
1 材料与方法
1.1 材料
普通变形杆菌ATCC 49027购自广东省微生物菌种保藏中心;家蝇抗菌肽(纯度97.15%;分子量:4301.59 Da 由北京中科亚光生物科技有限公司合成);硫酸庆大霉素注射液购自广州白云山天心制药股份有限公司;TSBg培养基购自广东环凯微生物科技有限公司。CO2培养箱,德国New Brunswick公司;荧光倒置显微镜,德国 Leica公司;流式细胞仪,美国BD公司;酶标仪,美国 Bio-Rad公司。
1.2 方法
1.2.1 MDC和庆大霉素抗菌效果研究 采用微量肉汤稀释法分别测定MDC及庆大霉素对普通变形杆菌的最小抑菌浓度(Minimal inhibit concentration,MIC)和最小杀菌浓度(Minimum bactericidal concentration,MBC)。在96孔板的每个对应孔中加入100 μL稀释好的菌液(1×106CFU/mL),MDC(2 mg/mL-4 μg/mL)及庆大霉素(128 μg/mL - 0.25 μg/mL)药液倍比稀释后加入100 μL,放置在37℃恒温培养箱中培养18 h。次日取出96孔板,以小孔内完全抑制细菌生长的最小药物浓度为该药对普通变形杆菌的MIC值。在无菌条件下,取MIC值对应孔及扩大梯度浓度的前4个孔中的菌液各100 μL,依次均匀涂在LB固体培养皿中,倒置在37℃恒温培养箱中过夜培养。次日取菌落数小于5的最小药物浓度为该药对普通变形杆菌的MBC值。每个实验重复3次。
1.2.2 联用抗菌效果研究 以测得的MDC(药液甲)或庆大霉素(药液乙)单用时对普通变形杆菌的MIC值和MBC值为基础,运用棋盘法确定分级抑菌浓度(Fractional inhibitory concentration,FIC)。在96孔板的每个对应孔中首先加入100 μL的菌液,之后按梯度浓度差异顺序依次加入药液甲50 μL,然后垂直方向按梯度浓度差异顺序依次加入药液乙50 μL,此时每个孔中的反应体系为200 μL,放置在37℃恒温培养箱中培养18 h。次日小心取出96孔板,计算FIC。
FIC指数=MIC(AB联合)/ MIC(A单用)+MIC(AB联合)/MIC(B单用)
当FIC≤0.5时,表示A与B之间在抑菌作用中为协同作用;当0.5<FIC≤1.0,表示A与B之间在抑菌作用为相加作用;当1<FIC<2时,表示A与B之间在抑菌作用为无关作用;当FIC≥2时,表示A与B之间存在抑菌作用为拮抗作用。
1.2.3 生物膜实验
1.2.3.1 结晶紫染色实验 取无菌6孔板,每孔放入一张干净的盖玻片,加入500 μL的菌液(1×106CFU/mL),按照分组(MDC:2×MIC,1×MIC,0.5×MIC;庆大霉素:2×MIC,1×MIC,0.5×MIC;MDC混合庆大霉素,使两药终浓度均为1×MIC作为协同组)依次加500 μL药液,空白对照组只加TSBg培养基1 mL,阴性对照组只加菌液1 mL(每组3个复孔),在37℃条件下培养18 h。弃去6孔板中的溶液,加入无菌生理盐水重复清洗3次。然后取99%的甲醇溶液1 mL分别加入到每个孔中,用来固定成膜的细菌,将6孔板放置在室温约13 min,倒掉孔中溶液,自然挥干。取2%的结晶紫溶液1 mL分别加入到每个孔,室温染色5 min。倒掉孔中溶液,用轻缓的流水冲洗6孔板,将非特异吸附的结晶紫洗去,封片,标记,待稍微凝固后用显微镜观察拍摄。
1.2.3.2 药物对生物膜初始附着的影响 取无菌96孔板,每孔放入一张干净的盖玻片,加100 μL的菌液(1×106CFU/mL),按照分组依次加100 μL药液,空白对照组只加TSBg培养基200 μL,阴性对照组只加菌液200 μL(每组3个复孔),37℃恒温培养2 h。洗板,固定步骤同1.2.3.1。然后吸取33%冰乙酸溶液160 μL分别加入到每个孔中,将96孔板放在摇床上摇10 min。等结晶紫完全溶解后,在波长570 nm处检测吸光值。每个实验组都要重复3次。
1.2.3.3 药物对成熟生物膜的破坏作用 在无菌96孔板中,每孔加入100 μL浓度为1×106CFU/mL的菌液,在37℃条件下培养1 d,倒掉孔中的溶液,用生理盐水清洗3次,洗去游离状的细菌。按照分组依次加入100 μL药液(每个浓度3个复孔),在37℃条件下继续培养1 d,倒掉孔中的溶液,洗板,固定,染色,检测步骤同1.2.3.2。
1.2.4 对胞外物质含量的影响 取50 μL菌液转种于5 mL肉汤培养基中(170 r/min,37℃),培养至对数期,用MH肉汤培养基调节OD600值至0.05。摇菌管内加入5 mL菌液,同时加入相应药物组(MDC组终浓度为128 μg/mL,庆大霉素组终浓度为1 μg/mL,生理盐水作为对照组)每组重复6次,37℃恒温培养8 h。吸取1.8 mL菌液到EP管中,4℃,4 000 r/min,20 min离心弃上清,沉淀加入蒸馏水重溶,加入24 μL的37%的甲醛在4℃保存3 h;取出混合物放至室温,再加入0.16 mL的NaOH(1 mol/L)在4℃保存3 h,再次离心(4℃,4 000 r/min,20 min),弃上清,所得沉淀用蒸馏水溶解,后续测定总糖和总蛋白量。取2 mL菌液,4℃,4 000 r/min,15 min离心后,放置于100℃的烘箱过夜,次日称取细菌干重。蛋白含量用BCA试剂盒测定。
1.2.5 MDC和庆大霉素抗菌机制研究
1.2.5.1 荧光染色和流式细胞术 在4℃冰箱中取出已经复苏好的菌液,摇晃混匀,在超净工作台中用移液器吸取100 μL菌液,加入到含有5 mL液体LB培养基的摇菌管中,180 r/min,37℃恒温摇菌箱培养4 h,培养至对数期。取出摇菌管,将菌液加入到EP管中3 000 r/min,5 min离心弃上清,收集菌体,用生理盐水稀释至5×108CFU/mL,得到每管500 μL的菌液。4组药物(MDC:2 × MIC,1 × MIC,0.5 × MIC;庆大霉素:2×MIC,1 × MIC,0.5 ×MIC;MDC混合庆大霉素,使两药终浓度均为1 ×MIC作为协同组)分别加入到4管菌液中,最终每管混合液体1 mL。37℃静置处理1 h。取生理盐水 1 mL,加入3.7 μL(7.5 mmol/L)PI染液,0.5 μL(5 mmol/L)SYTO 9染液,充分混合后,将混匀夜加入6孔板中,将6孔板放在暗格里染色15 min,用生理盐水清洗6孔板,以除去未结合的荧光染料,封片。在荧光显微镜下观察细菌存活/死亡情况,按照分组情况每组40 ×各取5个视野。按照以上荧光染色的基本步骤,染色避光处理15 min后,取1 mL各自加入到流式管中,标记,用流式细胞术检测菌细胞凋亡情况。
1.2.5.2 透射电子显微镜 药物作用于细菌步骤同
1.2.5.1,药物作用1 h后3 000 r/min,10 min离心弃上清,收集菌体,加入2.5%戊二醛置于4℃固定2 h,用PBS洗涤3次后,再用1%四氧化锇固定1 h,用PBS洗涤3次。将透射电镜样品在分级乙醇系列中脱水,然后嵌入环氧树脂中制备蜡块,最后,超薄切片用乙酸铀-柠檬酸染色。在透射电镜下进行拍摄观察。
1.2.6 统计分析 实验数据采用SPSS 13.0统计软件进行分析处理,以平均值±标准差表示,采用双因素方差分析(Two-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 MDC和庆大霉素对变形杆菌的MIC、MBC和FIC值
2.1.1 两药单用时的MIC值和MBC值 MDC对普通变形杆菌的MIC为 > 128 μg/mL,MBC为 > 1 024 μg/mL(图1),庆大霉素对普通变形杆菌的MIC为32 μg/mL,MBC为32 μg/mL(图2)。

图1 MDC对普通变形杆菌的MBC测定
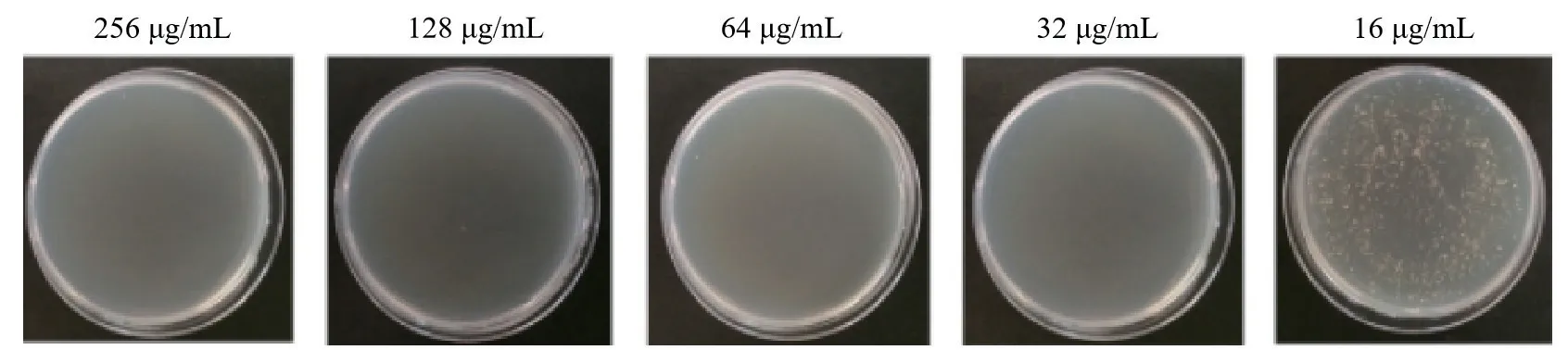
图2 庆大霉素对普通变形杆菌的MBC测定
2.1.2 两药联用的FIC指数 MDC和庆大霉素联用后,根据FIC指数计算方法计算FIC= 8/128+8/32 =0.313,FIC<0.5,说明MDC与庆大霉素具有协同作用,这与预期结果相一致。其中,庆大霉素联用时的MIC值是其单用时的1/4(表1)。
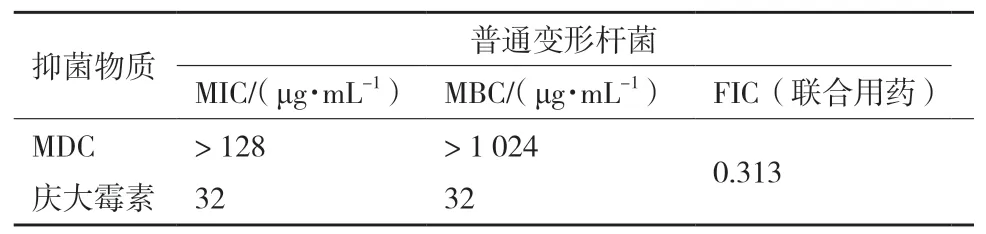
表1 MDC和庆大霉素对普通变形杆菌的MIC、MBC和FIC
2.2 MDC和庆大霉素对生物膜作用的研究
2.2.1 药物对菌生物膜的形成影响 结晶紫染色结果如图3显示,空白对照组中形成的细菌生物膜比较浓密,MDC和庆大霉素对其生物膜形成能力的影响随药物浓度的梯度变化呈相应的梯度变化,且与空白对照组相比,普通变形杆菌形成的细菌生物膜比较稀薄。联合用药组在同MIC倍数浓度组别中,其对生物膜形成能力的影响也都大于单个用药组,表明MDC和庆大霉素在抗普通变形杆菌生物膜方面也具有一定协同作用。
2.2.2 药物对菌初始生物膜附着的影响 从图4可以得出,与空白对照组相比,MDC和庆大霉素在低中高浓度均能够抑制初始生物膜的附着,在低浓度抑制效果不明显,在中高浓度具有显著的抑制效果(P<0.05)。同比MIC倍数下,两种药物单用时的作用效果相差不大,而两药联用时对生物膜的附着影响增强,说明MDC和庆大霉素具有一定的协同抑制初始生物膜附着的作用。
图3 普通变形杆菌生物膜结晶紫染色结果
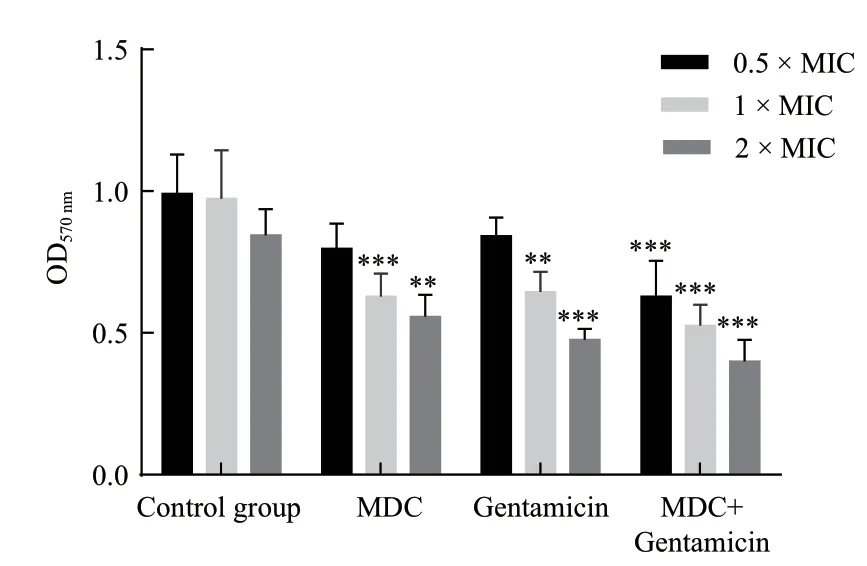
图4 药物对普通变形杆菌初始生物膜的影响
2.2.3 药物对菌成熟生物膜的破坏作用 统计学结果如图5所示,MDC对普通变形杆菌的成熟生物膜的破坏作用明显(P<0.001),但浓度依赖性不显著,而庆大霉素也对普通变形杆菌成熟生物膜具有明显的破环作用(P<0.001),破环作用随浓度增加而增强。
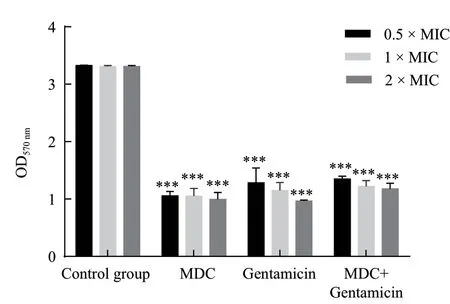
图5 药物对普通变形杆菌成熟生物膜的影响
2.2.4 生物膜胞外蛋白含量测定 检测药物对普通变形杆菌生物膜胞外蛋白含量的影响。图6为蛋白质含量与吸光度的标准曲线。如图7所示,与空白对照组相比,庆大霉素处理后,细菌产生总胞外蛋白质(μg)的能力显著降低(P<0.001)。MDC处理后,细菌产生总胞外蛋白质(μg)的能力升高,联合用药组蛋白含量低于任一药物单用时的蛋白含量,表明两药联用对生物膜胞外蛋白也有着一定程度的协同作用。

图6 普通变形杆菌胞外蛋白质标准曲线
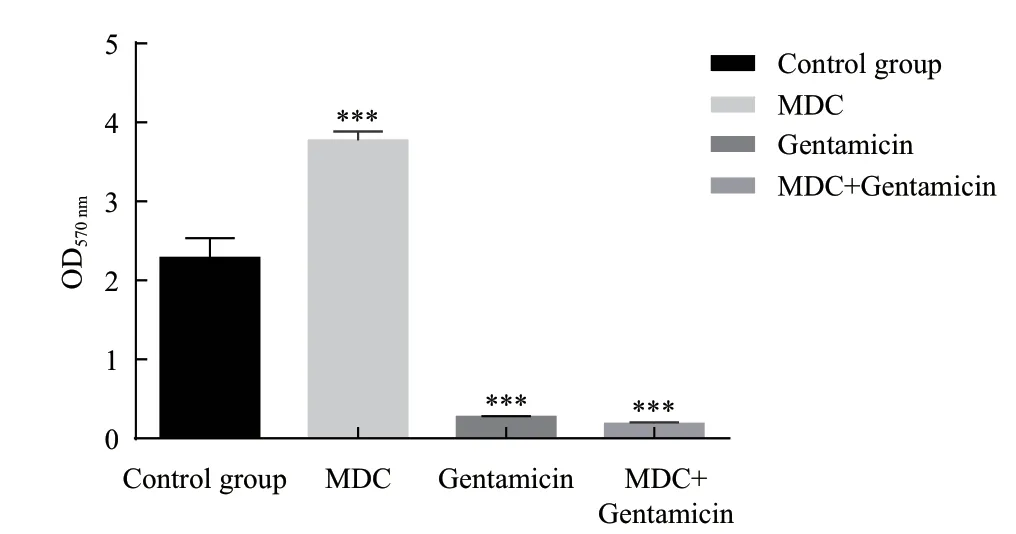
图7 普通变形杆菌胞外蛋白质浓度
2.3 抗菌肽MDC和庆大霉素联用抗菌机制结果
2.3.1 荧光结果 由图8可以看出,空白对照组经SYTO 9和PI荧光染色后,荧光显微镜下可见细菌全部被染成绿色,MDC组和庆大霉素组可见部分被染成红色的死菌,而两药联合作用后,被PI染成红色的死菌数量比单一用药组显著增多。
2.3.2 流式细胞术 结果如图9所示,PI染色后的M2区域反映了细菌的死亡数量,与空白对照组相比,MDC和庆大霉素给药后,细菌均有一部分死亡,而两药联合后,细菌死亡的数量显著上升。

图8 普通变形杆菌荧光染色结果
2.4 透射电子显微镜结果
透射电镜观察结果见图10,空白对照组为正常普通变形杆菌,菌细胞结构完整,具完整细胞膜及厚细胞壁,细胞质均匀,内部结构密实。MDC组出现菌体变形,内容物外泄。庆大霉素组出现细胞膜破损,细胞内结构变松散,内容物外泄。两药协同组不仅出现细胞膜破损,内容物外泄,同时胞内结构损坏程度相较于MDC组,庆大霉素组明显增强。
3 讨论
普通变形杆菌广泛存在于自然界之中,属于变形杆菌属,当机体抵抗力下降时,人们食用普通变形杆菌感染的食物后会引起食物中毒,轻者导致腹泻、胃肠炎等各种感染,重者危及生命[2]。本实验采用梯度倍数释法分别测定MDC及庆大霉素对普通变形杆菌的MIC值和MBC值,利用棋盘法计算 FIC值。实验发现庆大霉素单用时对普通变形杆菌有较好的抑制作用,庆大霉素对菌的最小抑菌浓度和最小杀菌浓度一致,而MDC单用时的抑制作用则不是很明显,但是将MDC与庆大霉素配伍后,两药联合对普通变形杆菌的抑制作用却十分明显,表明MDC和庆大霉素联合使用时可以明显增强庆大霉素的抑菌效果。
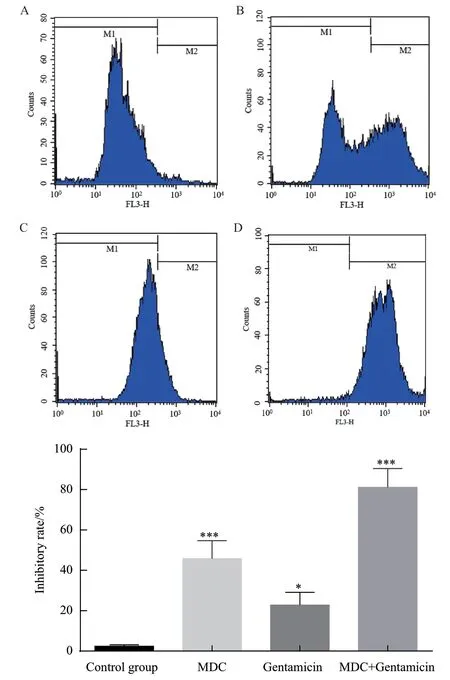
图9 流式细胞术检测PI染色细菌给药后死亡状况
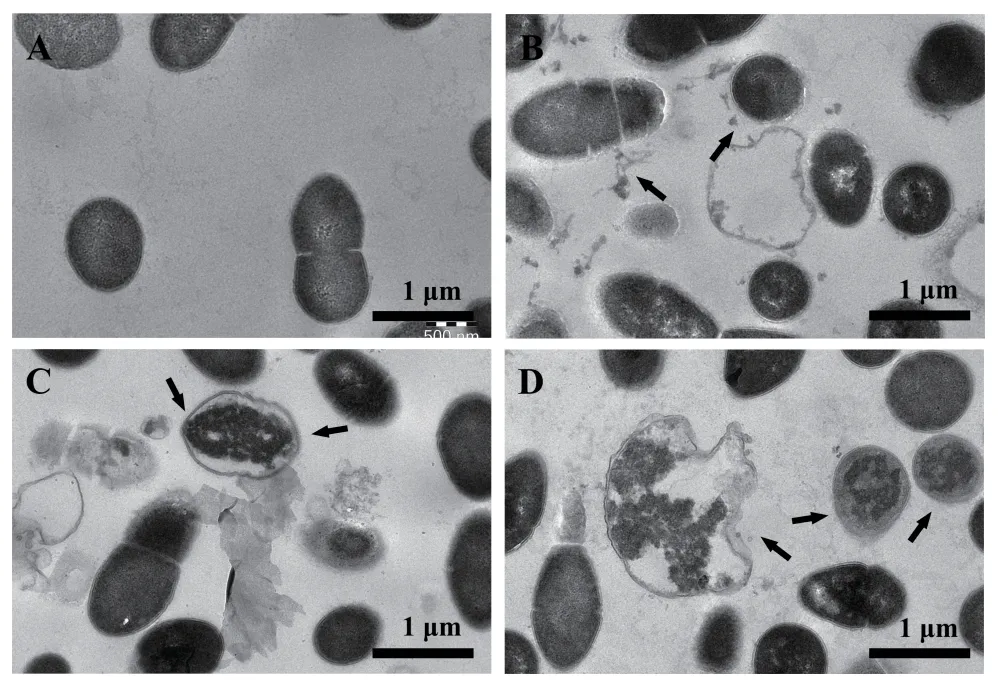
图10 透射电镜下普通变形杆菌的形态结构
由于普通变形杆菌有较强黏附作用,在某种条件下,它可以形成生物被膜来适应环境的变化。生物被膜能够帮助细菌逃避宿主免疫系统的攻击,使得病原菌能长时间存在,这也是造成慢性感染的重要原因之一[16-17]。我们用结晶紫染色对其生物膜的形成,初始附着,成熟后破坏以及胞外物质含量进行研究发现,MDC和庆大霉素都会抑制生物膜的形成和初始附着且对成熟生物膜具有杀伤作用,且两药同时作用后效果更明显。实验中我们还发现MDC组蛋白含量明显超标,此问题应是本身为多肽的MDC的残留影响,庆大霉素组蛋白含量相较于对照组有明显的减少,说明其对生物膜胞外蛋白有着一定程度的溶解作用,联合用药组蛋白含量低于任一药物单用时的浓度,可以推测两药联用对生物膜胞外蛋白也有着一定程度的协同作用。
抗菌肽MDC能破坏普通变形杆菌的细胞膜从而产生杀菌作用,这也与较多关于抗菌肽的作用机制报道一致[18-19]。SYTO 9可以穿透细胞壁结合DNA,PI也可以与DNA结合,而且能力更强,但是不能透过完整的细胞壁,只有细胞死亡后才可染色成功[20-21]。在氩激光488 nm激发光下,SYTO 9呈现弥散均匀的绿色荧光,表征活菌,而PI呈现红色荧光,表征死菌,因此通过SYTO 9/PI标记系统可以反映细菌的存活状态。通过荧光染色和流式细胞术检测细菌细胞膜通透性和膜势能的改变;结果显示MDC和庆大霉素作用后,会破坏菌细胞膜,造成一定比例的菌体死亡,且呈时间和浓度依赖性,两药联用后死亡数目显著增多,说明两者联用对该菌的杀伤效果具有协同作用。
进一步利用透射电镜观察两药作用后细菌的细胞内部超微结构变化,结果显示MDC会损伤菌体细胞膜结构,使其内容物溢出,庆大霉素作用后菌细胞胞内结构变松散,细胞膜的完整性被破坏,两药联用后效果更为显著,提示MDC和庆大霉素的作用机制存在着相辅相成互补的关系。MDC主要作用机制为破坏细胞膜,庆大霉素主要作用于细菌体内的核糖体,抑制细菌蛋白质合成,并破坏细菌细胞膜的完整性,这使得配伍后的协同抗菌作用得以大大提高。
4 结论
本研究发现家蝇抗菌肽MDC对普通变形杆菌的抑菌效果和杀菌效果较弱,庆大霉素对普通变形杆菌具有较强的抑制和杀菌效果,而两药联合使用时,MDC可以显著增强庆大霉素对普通变形杆菌的抑制和杀菌效果,抗菌机制涉及破坏细菌细胞膜和细菌胞内结构,两药形成互补作用。两药单用均能够有效抑制普通变形杆菌生物膜的形成,破环成熟生物膜的结构,减少胞外蛋白的合成,联用后效果更为明显。
