嗜水气单胞菌acrA缺失菌株的构建及其生理功能的测定
2020-12-04李小艳李泽琦汪玉倩于晶林镇平林向民
李小艳 李泽琦 汪玉倩 于晶 林镇平 林向民
(1.福建农林大学生命科学学院,福州350002;2.福建农林大学福建省农业生态过程与安全监控重点实验室,福州 350002)
AcrA蛋白是革兰氏阴性菌中的一种含有398个氨基酸序列的内膜蛋白,由α-螺旋发夹结构域、脂肪结构域、β-桶状结构域和膜近端结构域等4个结构域组成,通常具有药物外排泵的功能[1]。其中α-螺旋发夹结构域与TolC相互作用,膜近端结构域和物外排结构域则参与了与AcrB的相互作用[2]。AcrA在组装为外排泵时常常作为二聚体组装,通过将内外膜组件结合在一起来完成泵的组装。其通常与外膜蛋白和周质空间蛋白组成三联体复合物行使蛋白功能,将多肽、蛋白质、碳水化合物或药物等泵出到革兰氏阴性细菌的胞外,在革兰氏阴性细菌的物质转运过程中起重要的作用[3-4]。例如,大肠杆菌的AcrAB-TolC系统中,AcrA蛋白将周质空间蛋白AcrB与外膜蛋白TolC连接形成复合物,从而起到药物泵的作用,可以促进氯霉素、四环素、红霉素和溶剂的外排[5-6];这种外排泵的过度表达还增加了大肠杆菌对异丁醇的耐受性及环丙沙星的耐药性[7]。此外,Yutaka等研究发现,acrA的缺失或突变会导致细菌对多种抗生素(左氧氟沙星、林可霉素、米诺环素、头孢他啶和头孢呋辛等)、染料(吖啶黄素等)及去污剂(SDS和Triton等)的敏感性增加,还会显著增强细菌对胆盐和癸酸(一种脂肪酸)的敏感性[8-9]。还有研究者提出,AcrA蛋白质中具有较高保守性的氨基酸残基是不同种属菌株进化的关键位点,当细菌在外在环境发生变化时(如不同种类、浓度的抗菌药物等),菌株为了适应新的生长条件,在选择性压力下产生氨基酸残基的突变,如第51-60位、141-150位等氨基酸残基的突变;从而能更加有效的泵出抗菌药物,使其能耐受极端的环境[10]。由于AcrA蛋白质在膜转运过程中的重要作用,当前关于该蛋白的研究大多数集中于AcrA在药物泵中的功能,而对其在细菌其他生理功能的研究较少。嗜水气单胞菌是广泛存在的一类条件性致病菌,对鱼类、禽类、两栖动物和哺乳动物等有较强的感染力。此外,该菌对人类公共卫生与食品安全造成了严重的威胁[11]。因此,研究该菌的各项生理功能对其防治具有深远的意义。本实验以水产病原菌嗜水气单胞菌为研究对象,成功构建acrA敲除菌株ΔacrA,探究acrA在嗜水气单胞菌中的生理功能,丰富与补充了对该基因功能的认识。
1 材料与方法
1.1 材料
1.1.1 菌株该实验所用到的菌株,自杀载体pRE112,嗜水气单胞菌ATCC 7966均为本实验室保存。
1.1.2 试剂和引物LB培养基胰蛋白胨 10 g/L,酵母提取物5 g/L,NaCl 10 g/L,蔗糖购买于广州赛国生物科技有限公司;抗生素氨苄青霉素(Amp)100 μg/mL,氯霉素(Cm)30 μg/mL 均购买于上海拜力生物科技有限公司,绵羊血和脱脂牛奶均购买于索莱宝生物科技有限公司。胶回收和质粒提取试剂盒购买于 Omega;总DNA提取试剂盒购买于北京康为世纪生物技术公司;常用的Xba I和Sac I限制性内切酶购买于Thermo FisherScientific;ClonExoress Multis®One Step Cloning Kit C113多克隆片段连接酶购买于南京诺唯赞生物科技有限公司,引物由福州博尚生物公司合成(表1)。
1.2 方法
1.2.1 acrA敲除菌的构建 根据acrA基因序列设计目的基因上下游同源臂,以嗜水气单胞菌ATCC 7966总基因组为模板进行PCR扩增,得到目的基因上下游各500 bp左右的两条同源臂,将上下游两条同源臂用多克隆片段连接酶与经过(Xba I和Sac I)双酶切的pRE112进行连接得到重组质粒。将重组质粒转化至MC1061感受态细胞中,提取阳性克隆的质粒,转入S17感受态细胞;将携带两条同源臂的pRE112载体的S17菌与嗜水气单胞菌按1∶4的比例在滤纸片上结合培养16-18 h,进行第一次同源重组,然后将无菌LB培养液洗涤下来的混合菌液涂于双抗板上(氨苄青霉素和氯霉素),挑取阳性克隆;将该阳性克隆的过夜菌涂布于含有20% 蔗糖的LB平板上,然后挑取单克隆,分别点在氯霉素和正常LB平板上。最后选取在氯霉素板上不长的阳性克隆用P5P6及P7P8进行菌液PCR验证,P7P8 PCR得到的1 000 bp左右的片段进行测序验证,获得ΔacrA敲除菌株,稳定遗传20代后,-80℃保菌。以上步骤根据表1设计对应引物进行菌液PCR验证并测序,PCR体系(20 μL:DNA模板3 μL,2×Hieff®PCR Master Mix(With Dye)10 μL上下游引物(10 μmol/L)各1 μL,ddH2O 15 μL,PCR程序:94℃ 5 min,94℃ 30 s,X℃ 30 s,72℃ Y s,72℃ 10 min,30个循环。
1.2.2 培养基配置 LB 液体培养基(固体培养基加入1.5%琼脂),抗性培养基为在 LB 培养基灭菌温度降至60℃后,按相应比例加入Amp(终浓度为100 mg/L),Cm(终浓度为30 mg/L)。0.7%绵羊血琼脂平板,按0.7%(V/V)将无菌绵羊血与无菌固体LB培养基均匀混合,倒无菌0.7%绵羊血琼脂平板;1.0% 牛奶琼脂平板,10%的液体牛奶115℃,20 min灭菌温度降至60℃按1.0%(V/V)将牛奶与固体无菌LB培养基均匀混合,倒无菌1.0% 牛奶琼脂平板。
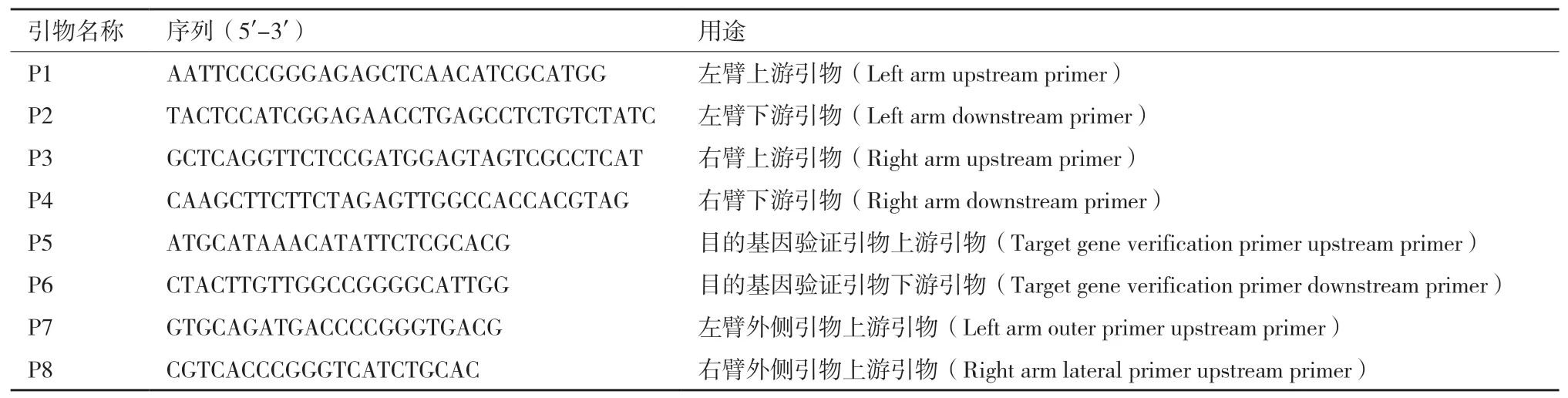
表1 嗜水气单胞菌acrA基因缺失以及验证引物列表
1.2.3 溶血性的测定 将过夜的野生菌株和敲除菌株按1%(V/V)转接至新鲜LB中,30℃,200 r/min培养至OD600nm为1.0后,将上述菌液各取5 μL 点于挖好孔的1.0%绵羊血琼脂平板上,30℃正置培养16 h,观察并测量溶血斑直径。上述实验皆重复3次,并用Graph Pad Prism 5进行数据分析。
1.2.4 胞外蛋白酶活的测定 将过夜的野生菌株和敲除菌株按1%(V/V)转接至新鲜LB中,30℃,200 r/min培养至OD600nm为1.0后,将上述菌液各取5 μL 点于挖好孔的1.0%牛奶琼脂平板上,30℃正置培养16 h,观察并测量牛奶斑直径。上述实验皆重复3次,并用Graph Pad Prism 5进行数据分析。
1.2.5 ΔacrA 对抗生素及染料的敏感性测定 将过夜16 h的野生菌株和敲除菌株按1%(V/V)转接至新鲜LB,30℃,200 r/min至OD600nm为1.0,将10 μL菌液接入到1 mL新鲜LB中,然后进行梯度稀释(10-2-10-8),每个梯度取2 μL菌液点在含抗生素或染料的琼脂平板上,30℃培养16 h,拍照,重复3次。1.2.6 生长曲线的测定 分别挑取野生菌和敲除菌的单克隆于液体LB培养基中,30℃或42℃,200 r/min培养16 h;将上述菌液以1∶100(V/V)转接培养至OD600nm约为1.0 然后按 1∶100 稀释,将稀释后的菌液加入生长曲线板的孔隙中,每孔加入300 μL,每个菌做3次重复,随后将生长曲线板置于全自动生长曲线分析仪(Bioscreen)中培养16 h。最后用GraphPad Prism 5对数据进行分析。
1.2.7 生物膜的测定将培养16 h的野生菌株和敲除菌株按 1%(V/V)转接至新鲜LB,30℃或42℃,200 r/min培 养 至OD600nm为1.0,再按1%(V/V)转接至96孔微量板中30℃静置培养24 h;用SpectraMax® i3多功能酶标仪(Molecular devices)检测其OD600nm波长下的吸光值;弃去菌液,用双蒸水缓慢洗涤3次后晾干;每孔中加入 250 μL的0.01%(W/V)结晶紫溶液,室温静置染色30 min;弃去结晶紫染液,再用双蒸水缓慢洗涤3次晾干;最后每孔加入300 μL的 95%(V/V)的乙醇溶液,用SpectraMax®i3多功能酶标仪检测其OD595nm波长下的吸光值,每个样品做8孔重复,并做3次生物学重复。最后将数据用GraphPad Prism 5进行分析。
2 结果
2.1 acrA敲除菌构建的结果
利用同源重组原理,通过目的基因的验证引物P5P6及同源臂外侧引物P7P8对获得的敲除菌株进行PCR验证,结果如图1所示:泳道1和2分别是P5P6对敲除菌株及野生菌株进行PCR验证的结果,泳道3和4分别是P7P8对敲除菌株及野生菌株进行PCR验证的结果。
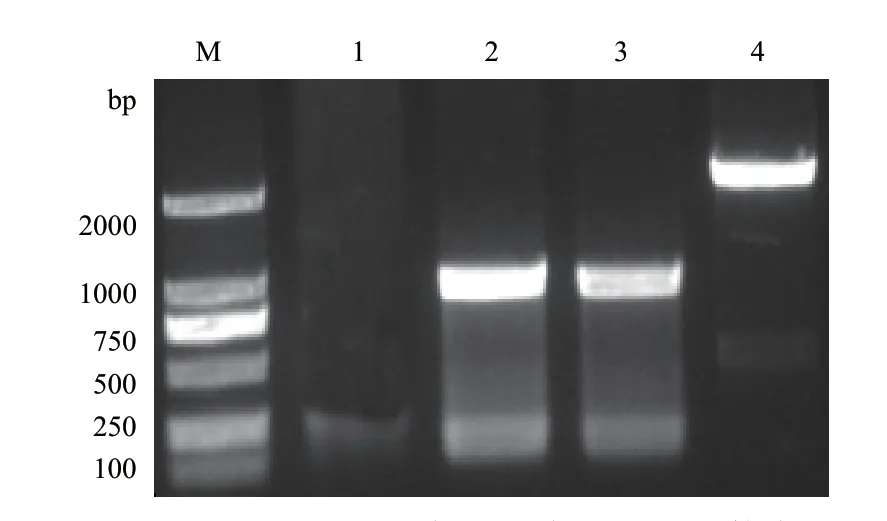
图1 acrA敲除菌株PCR验证
2.2 溶血性测定的结果
实验中为测定野生菌株和敲除菌株的溶血性,在0.7%绵羊血琼脂平板的孔隙中培养敲除菌和野生菌16 h,对溶血斑的大小进行观察并用GraphPad Prism 5对溶血斑直径的数据进行统计分析,得到如图2所示的实验结果。
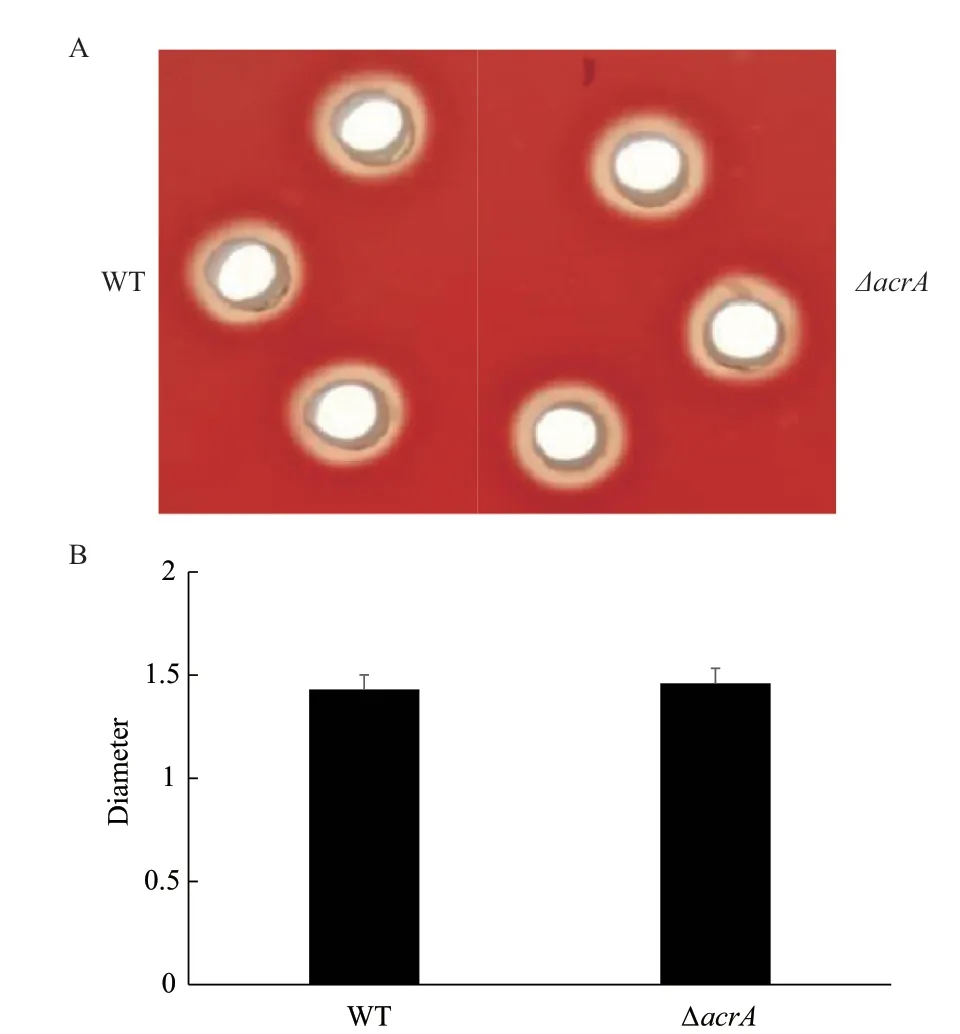
图2 野生菌株与敲除菌株溶血性测定
2.3 胞外蛋白酶活测定的结果
研究中为测定野生菌株和敲除菌株的胞外蛋白酶活,将野生菌和敲除菌在1.0% 牛奶琼脂平板的孔隙中培养16 h,对牛奶水解圈的的大小进行观察并用GraphPad Prism 5对牛奶水解圈的直径数据进行统计分析,得到如图3所示的实验结果。
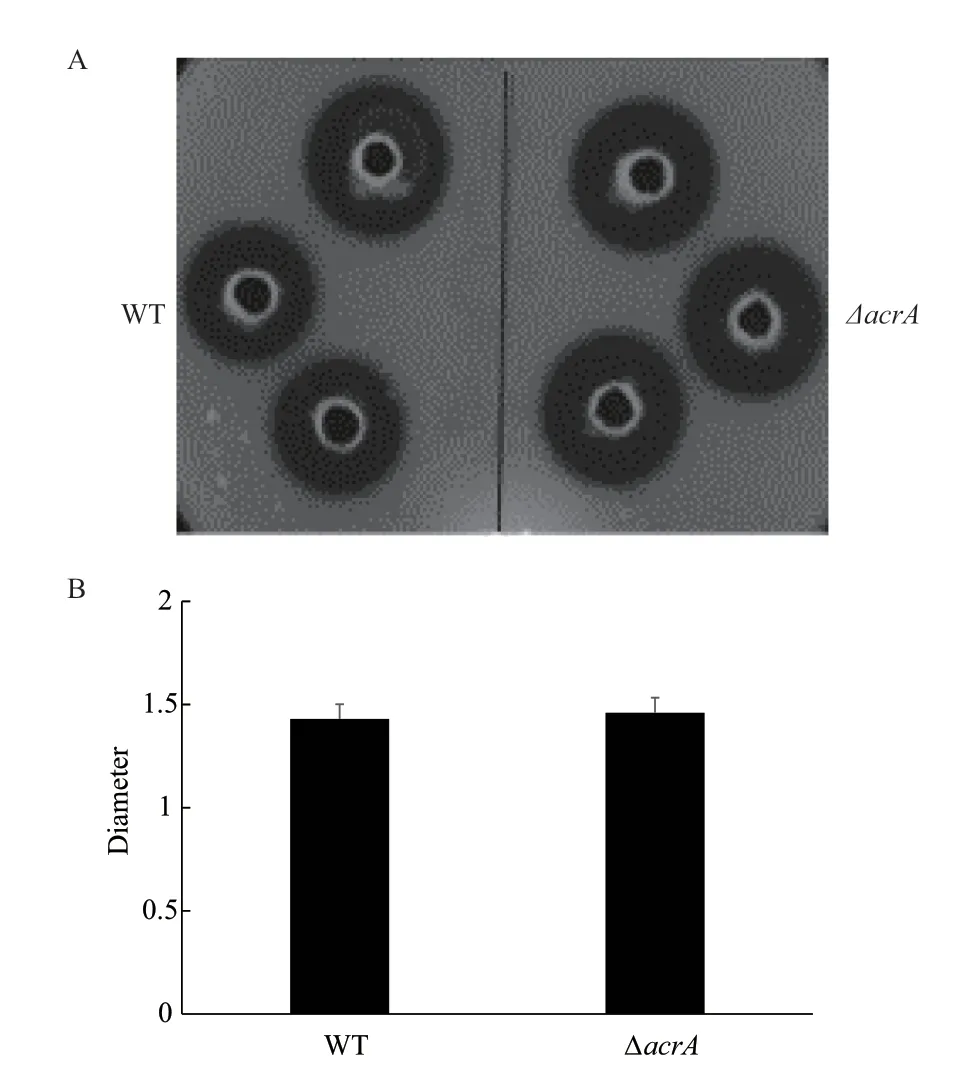
图3 野生菌株与敲除菌株胞外蛋白酶活测定
2.4 ΔacrA对抗生素及染料的敏感性测定结果
为了探究 acrA缺失后,嗜水气单胞菌对抗生素及染料敏感性的变化,将野生菌株和敲除菌株分别在含有卡那霉素(Kanamycin 6.25 μg/μL)、罗红霉素(Erythromycin 32 μg/μL)、巴洛沙星(Balofloxacin 0.05 μg/μL)抗生素及吖啶黄素染料(Acriflavinium chloride 10 μg/μL)的琼脂平板上的进行稀释点板,得到如图4所示的实验结果。
2.5 生长曲线测定的结果
为了探究acrA缺失后对嗜水气单胞菌生长及高温胁迫性的影响,利用全自动生长曲线分析仪(Bioscreen)在30℃和42℃下分别测定野生菌与敲除菌16 h的生长趋势,通过GraphPad Prism 5对实验的数据结果进行统计分析,得到如图5所示的实验结果。
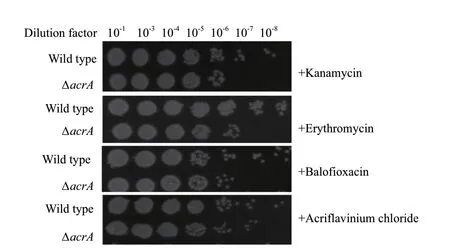
图4 野生菌株与敲除菌株对Kanamycin、Erythromycin、Balofloxacin抗生素及Acriflavinium chloride染料敏感性的测定
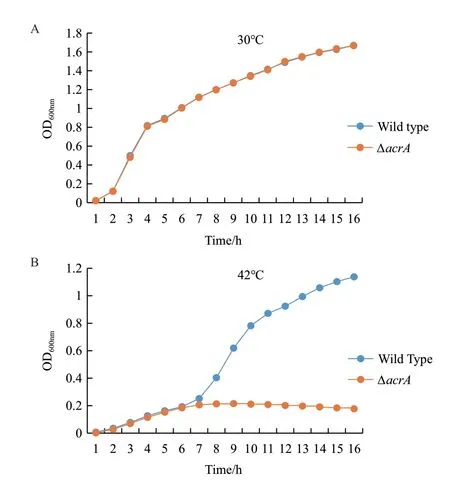
图5 野生菌株与敲除菌株生长趋势测定
2.6 生物膜测定的结果
将野生菌株和敲除菌株分别培养16 h,再利用结晶紫染色法测定野生菌株和敲除菌株在30℃和42℃条件下生物膜的形成能力,通过GraphPad Prism 5对实验的数据结果进行统计分析,得到如图6所示的实验结果。
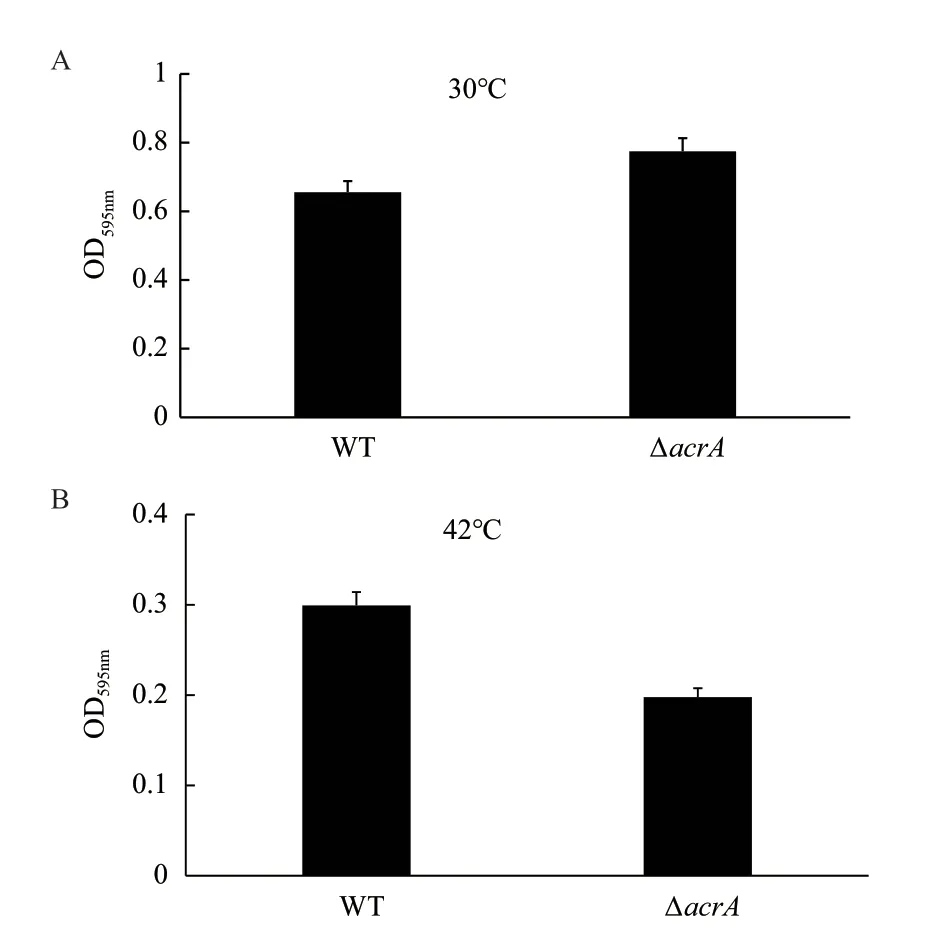
图6 野生菌株与敲除菌株生物膜形成能力测定
3 讨论
AcrA蛋白一般通过与AcrB和TolC的相互作用形成AcrAB-TolC多药泵系统,从而排出如氯霉素、四环素、红霉素等多种抗生素,在细菌的药物外排中起着至关重要的作用[12-14]。有研究结果表明AcrA在一些染料试剂的渗透过程中也有关键作用[15-17],acrA基因的突变或缺失会提高细菌对许多抗生素和染料试剂的敏感性。曾有文献报道嗜水气单胞菌中的acrA基因也有这样的功能,把嗜水气单胞菌中的acrA基因在大肠杆菌中高表达发现,acrA增加了大肠杆菌对奎诺酮类药物的外排作用[18],这与本实验结果相符。迄今为止acrA基因的研究几乎都是与药物外排及膜的通透性相关[19],而关于该基因在细菌中其他生理方面的功能知之甚少。为了充分了解该基因在细菌生长中所起的作用,本实验首先成功敲除了嗜水气单胞菌中的acrA基因,如图1实验结果所示,通过P5P6及P7P8分别对敲除菌株和野生菌株进行PCR验证,得到的实验结果与同源重组技术的理论结果一致。本文还研究了嗜水气单胞菌中acrA基因在溶血性、胞外毒理性、抗生素和染料的敏感性、生物膜形成及高温耐受性等方面的功能。
本研究通过对图2和图3的实验结果进行分析得到溶血斑及牛奶水解圈的直径几乎没有差别,这表明了acrA基因可能与细菌中的毒理因子无关。但是由图4的实验结果分析发现acrA基因的缺失可以提高嗜水气单胞菌对卡那霉素,罗红霉素,巴洛沙星及吖啶黄素的敏感性。随后图5生长曲线测定的结果说明:30℃条件下野生菌株与敲除菌株的生长趋势没有差别,但是在42℃条件下野生菌株的生长趋势明显比敲除菌株的好,表明acrA基因的缺失本身不会影响嗜水气单胞菌的生长,但会降低嗜水气单胞菌的高温耐受性,提示acrA基因与高温耐受性有关;同时图6的实验结果表明在30℃条件下野生菌株生物膜的形成能力明显比敲除菌的能力弱,而在42℃下野生菌生物膜的形成能力明显强于敲除菌,这说明在高温刺激下野生菌生物膜形成能力也比敲除菌株的强,与高温环境下野生菌株和敲除菌株的生长趋势一致,暗示着嗜水气单胞菌中acrA基因可能通过影响嗜水气单胞菌的高温耐受性,从而影响该菌生物膜的形成,研究者已经证明在42℃高温下培养嗜肺乳杆菌菌株和肺炎链球菌菌株,其生物膜的形成能力能够得到显著的提高[20]。但是在嗜水气单胞菌中acrA基因是如何通过影响高温耐受性进而调节生物膜的形成还有待进一步研究。除此之外,我们还在正常温度下对野生菌和敲除菌株的生物膜形成能力进行测定,发现在正常温度下野生菌株的生物膜形成能力明显弱于敲除菌株,因此推测在嗜水气单胞菌中acrA基因对生物膜的形成有负调控的功能。曾有研究表明适宜温度下分别缺失沙门氏菌中的tolC、acrE和acrF基因都会产生沙门氏菌的csgB基因表达下调,减少curli菌毛产生,影响细菌形成成熟生物膜的现象,但是并未发现acrA基因的缺失会对细菌生物膜的形成产生影响[21]。而本研究发现在嗜水气单胞菌中acrA的缺失会显著增强生物膜形成能力,说明在不同细菌中可能存在多个调控因子影响其对生物膜形成的作用。
4 结论
本研究成功构建了acrA基因的敲除菌株,通过溶血性、胞外蛋白酶活性、抗生素及染料的敏感性、生长趋势和生物膜形成的检测发现,嗜水气单胞菌中acrA基因与毒理能力无关,但在抗生素外排中可能起一定的调节作用。而且研究还发现acrA基因起着热胁迫抗逆性的功能,并参与调控细菌的生物膜形成。这一发现丰富了我们对acrA基因功能的认识,为进一步探究AcrA蛋白在细菌中高温耐受性及对生物膜形成的调控机制奠定基础。
