姜黄素异硫脲修饰嘧啶类衍生物1g对结肠癌细胞自噬和迁移侵袭的影响*
2020-12-04夏芮东孙加琳尹瑞娟隋忠国
夏芮东,孙加琳,尹瑞娟,隋忠国,
(1.青岛大学药学院,青岛 266071;2.青岛大学附属医院药学部,青岛 266000;3.中国海洋大学医药学院,青岛 266003)
姜黄素是一类从姜黄中提取的植物多酚[1]。大量研究表明,姜黄素具有抑制肿瘤细胞活性、降低迁移侵袭能力、诱导自噬及促进凋亡等作用,具有良好的临床应用价值[2-4]。但姜黄素具有水溶性较差、生物利用度低、代谢率高等缺点,极大地限制其临床开发和使用[5-6]。因此以姜黄素为基础结构进行合理的结构改造,获取具有临床应用价值的抗肿瘤药物具有较好的研发前景。本团队前期通过在姜黄素结构骨架基础上,先后进行嘧啶环取代和四甲基异硫脲取代得到了新型异硫脲修饰姜黄素嘧啶类衍生物(简称1g)[7]。本实验通过人结肠癌HCT116和HT29细胞株开展了1g对结肠癌细胞增殖、迁移侵袭和自噬的作用研究,并进一步探讨其发挥作用的可能分子机制。
1 材料与方法
1.1细胞与试剂 人结肠癌细胞株HCT116(批号:TCHu99)、HT29(批号:SCSP5032)细胞来自中国科学院细胞库;1g来自中国海洋大学医药学院;Transwell小室(批号:3422)购自美国Corning公司;CD147克隆载体(批号:G114754)购自长沙优宝生物公司;胎牛血清(FBS,批号:FNA500)购自上海依科赛生物公司;RIPA裂解液(批号:P0013E)、二喹啉甲酸(BCA)蛋白浓度测定试剂盒(批号:P0012)、CCK-8检测试剂盒(批号:C0042)购自上海碧云天生物;PI3K抑制剂LY294002(批号:HY-10108)购自美国MCE公司; CD147(批号:A1566)购自武汉Abclonal有限公司;AKT(批号:AF6261)、p-AKT(批号:AF0016)、GAPDH(批号:AF7021)购自江苏Affinity有限公司;兔抗LC3(批号:2775)购自美国CST有限公司;兔抗PI3K(批号:ab191606)、p-PI3K(批号:ab182651)购自英国abcam有限公司。
1.2实验仪器 离心机(5415D)购自德国艾本德公司;光学显微镜(E100)购自日本尼康公司;超低温冰箱(DW-86L388J)购自中国海尔公司;微量移液器(3120)购自德国艾本德公司;透射电镜(Tecnai G2 F20)购自美国FEI公司;电子天平(CPA,感量0.1 mg)购自北京赛多利斯仪器系统有限公司;二氧化碳(CO2)恒温培养箱(MCO-18AIC)购自日本三洋公司。
1.3细胞培养 人结肠癌细胞株HCT116、HT29细胞在含10%FBS、1%青霉素和链霉素的RPMI-1640培养基中生长,并置于37 ℃、5%CO2细胞培养箱中培养。根据细胞生长情况,2~3 d传代1次,用0.25%胰酶消化,取对数生长期生长状态良好的细胞进行实验。
1.4siRNA序列合成及过表达载体构建 siRNA序列合成根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中CD147基因登记号NM_198589.1及siRNA设计原则,使用siRNA在线设计工具(http://sidirect2.rnai.jp/)设计CD147基因的siRNA(CCUCACCUGCUCCUUGAAU),由上海吉玛制药技术有限公司合成。CD147过表达载体构建通过用限制性内切酶Hind III和BamHI将克隆质粒pDONR223-CD147与pCMV3.1过表达载体分别进行双酶切,然后将酶切产物用连接酶连接构建CD147-pCMV3过表达载体,构建的CD147-pCMV3过表达载体进行DNA测序鉴定。
1.5CCK-8实验 分别取对数生长期生长状态良好的HCT116、HT29细胞,用含10% FBS及1%青霉素和链霉素的RPMI-1640培养基调整细胞密度到1×105个·mL-1,接入96孔板,每孔100 μL细胞悬液,实验分2组,即正常组和1g组。其中1g组分别加入不同浓度的1g(1,2,4,6,8,10,12,14 μmol·L-1),另每组设空白对照孔,每孔重复3次。加药后37 ℃培养24 h,加药培养结束后加入CCK-8溶液10 μL,37 ℃孵育4 h,然后酶标仪测定各孔吸光度值(A450)。
1.6细胞迁移能力的检测 实验分为2组,正常组、1g(6 μmol·L-1)组。药物处理细胞24 h后收集各组细胞,用无血清培养基稀释细胞浓度至2×105个·mL-1。在24孔板中加入10%FBS培养基800 μL,并放入Transwell小室,在Transwell上室加入各组细胞悬液200 μL,37 ℃、5% CO2培养箱培养24 h。拿出Transwell小室后,通过磷酸缓冲盐溶液(PBS)缓冲液清洗小室,70%乙醇溶液固定细胞1 h,0.5%结晶紫溶液染色后室温下孵育20 min,显微镜下观察摄像。
1.7细胞侵袭能力的检测 实验分为2组,正常组、1g(6 μmol·L-1)组。药物处理细胞24 h后收集各组细胞,用无血清培养基稀释细胞浓度至2×105个·mL-1。在24孔板中加入含10%FBS培养基800 μL,并放入Transwell小室,在Transwell上室加入1 mg·mL-1的Matrigel 100 μL后,37 ℃孵育4~5 h,待Matrigel干成胶状物后于Transwell上室加入的各组细胞悬液200 μL,37 ℃、5% CO2培养箱培养24 h。拿出Transwell小室后,通过PBS缓冲液清洗小室,70%乙醇溶液固定细胞1 h,0.5%结晶紫溶液染色后室温下孵育20 min,显微镜下观察摄像。
1.8透射电镜观察细胞 药物处理细胞24 h后收集正常组、1g(6 μmol·L-1)组细胞,以2.5%戊二醛和1%锇酸固定后,乙醇和丙酮梯度脱水,环氧树脂浸透包埋后制备超薄切片,醋酸铀和柠檬酸铅分别染色5 min,透射电镜观察摄像。
1.9Western blotting检测LC3的表达 实验分为4组,正常组、低浓度1g(2 μmol·L-1)组、中浓度1g(6 μmol·L-1)组、高浓度1g(10 μmol·L-1)组。通过相应浓度1g处理各组细胞24 h后收集细胞,用预冷的PBS洗涤细胞3次;1500 r·min-1离心半径r=6.5 cm,离心5 min,弃上清液;随后加入蛋白裂解液,于冰上震荡裂解30 min;12 000 r·min-1,离心半径r=6.5 cm,4 ℃离心20 min后,通过BCA蛋白测定试剂盒检测蛋白浓度。取等量40 μg蛋白样品以通过凝胶电泳分离,取出凝胶后聚偏氟乙烯(poly vinylidene fluoride,PVDF)转膜。转膜结束后于5% 脱脂奶粉缓冲液室温下封闭2 h,随后将PVDF膜浸泡于用封闭液稀释的一抗孵育液中,4 ℃孵育过夜,再在室温下用二抗孵育2 h,加电化学发光显影后扫描胶片,通过ImageJ软件分析灰度值。
1.10Western blotting检测CD147、LC3、p-PI3K、PI3K、p-AKT、AKT的表达 实验分为7组,正常组、1g(6 μmol·L-1)组、CD147干扰组(6 μmol·L-11g+CD147 siRNA)、干扰对照组(6 μmol·L-11g+对照siRNA)、CD147过表达组(6 μmol·L-11g+CD147过表达质粒)、过表达对照组(6 μmol·L-11g+对照过表达质粒)、CD147过表达+PI3K抑制剂组(6 μmol·L-11g+ CD147过表达质粒+ 20 μmol·L-1PI3K抑制剂LY294002)。过表达质粒或siRNA转染细胞24 h后,通过6 μmol·L-1浓度1g及20 μmol·L-1PI3K抑制剂LY294002处理相应组细胞24 h后收集各组细胞后,Western blotting法检测各组细胞中CD147、LC3、p-PI3K、PI3K、p-AKT、AKT的蛋白表达,方法同“1.9”。

2 结果
2.1CD147过表达载体构建鉴定 结果如图1所示,构建的CD147过表达载体经测序分析表明插入的序列正确,目的基因CD147的过表达载体质粒构建成功。

图1 CD147过表达质粒测序鉴定
2.2CCK-8检测不同浓度1g对HCT116、HT29细胞增殖的影响 由图2的CCK-8检测结果可知,1g能够抑制人结肠癌细胞株HCT116、HT29细胞的增殖,随着浓度的增加,1g对HCT116、HT29细胞的抑制作用逐渐增强。
2.31g对HCT116、HT29细胞迁移及侵袭能力的影响 Transwell迁移实验结果见图3,与正常组相比,1g组HCT116、HT29细胞的迁移能力下降。Transwell侵袭实验结果见图4,与正常组相比,1g组HCT116、HT29细胞的侵袭能力下降。
2.41g对HCT116、HT29细胞自噬的影响 透射电镜结果表明,正常组HCT116、HT29细胞质中线粒体、内质网等结构清晰,未见明显自噬体,1g组细胞胞膜轮廓不清,细胞核皱缩,明显可见自噬体,结果见图5。
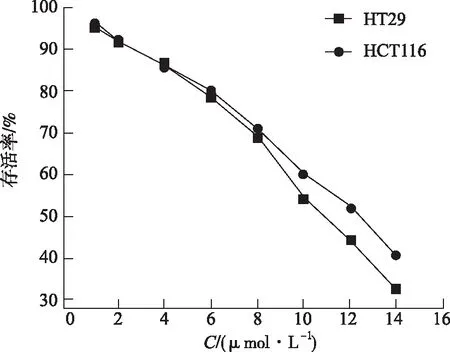
图2 不同浓度的1g对HCT116、HT29细胞增殖的影响
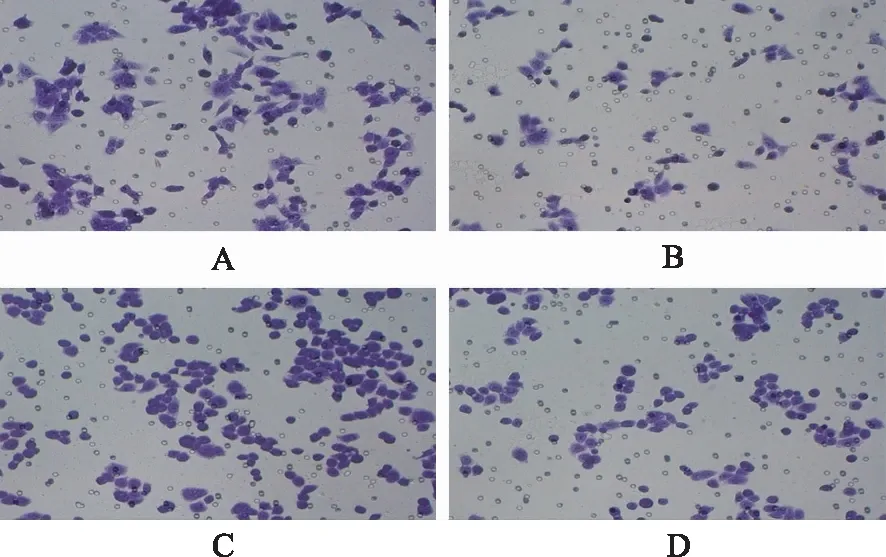
A.HCT116细胞正常组;B.HCT116细胞1g组;C.HT29细胞正常组;D.HT29细胞1g。
2.51g对HCT116、HT29细胞中CD147、p-PI3K/PI3K、p-AKT/AKT、LC3II/LC3I蛋白表达的影响 Western blotting检测结果显示,相比于正常组,2,6,10 μmol·L-11g处理HCT116和HT29细胞后细胞中LC3II/LC3I蛋白表达显著增加(F=2.136,0.633,0.121,P<0.05;F=4.32,0.071,1.401,P<0.05),呈剂量依赖性,结果见图6。另1g(6 μmol·L-1)组与正常组相比,细胞中CD147、p-PI3K/PI3K、p-AKT/AKT蛋白表达显著减少(F=0.004,2.156,1.162,P<0.05;F=3.782,0.574,1.752,P<0.05);相对于1g(6 μmol·L-1)组,CD147过表达组细胞中CD147、p-PI3K/PI3K、p-AKT/AKT蛋白表达显著性增加(F=0.112,5.313、0.634,P<0.05;F=6.044,0.433,8.25,P<0.05),LC3II/LC3I蛋白表达显著减少(F=1.632,P<0.05;F=1.331,P<0.05),CD147干扰组则呈相反趋势;相对于CD147过表达组,通过PI3K抑制剂处理后CD147、PI3K/PI3K、p-AKT/AKT蛋白表达显著减少(F=0.003,5.53,2.454,P<0.05;F=0.263,3.313,0.226,P<0.05),LC3II/LC3I蛋白表达显著增加(F=0.663,P<0.05;F=1.056,P<0.05),结果见图7,8。

A.HCT116细胞正常组;B.HCT116细胞1g组;C.HT29细胞正常组;D.HT29细胞1g组。

A.HCT116细胞正常组;B.HCT116细胞1g组;C.HT29细胞正常组;D.HT29细胞1g组。

A.正常组;B.低浓度1g组;C.中浓度1g组;D.高浓度1g组;①与正常组比较,P<0.05。
3 讨论
结肠癌是消化系统较为常见的一种癌症,其发病率及死亡率在恶性肿瘤中排名第3位,严重威胁人们的生活和健康[8]。近年来,结肠癌的发病率出现了上升趋势,这一趋势与不良的生活方式、饮食习惯以及环境污染等有很大关系[9]。姜黄素是一类具有开发成抗肿瘤药物的多酚类化合物,然而因为姜黄素的水溶性较差、代谢率高等缺点极大地限制了姜黄素的进一步应用[5-6]。1g是本团队通过嘧啶环取代和四甲基异硫脲取代得到水溶性高、化学性稳定的新型异硫脲取代姜黄素嘧啶类衍生物[7]。本研究CCK-8结果表明,1g对HCT116和HT29细胞的增殖都有抑制作用,呈剂量依赖性,表明1g有发展为新药的潜力。结肠癌细胞的转移是导致其恶化和复发的关键原因,严重影响患者的生存及预后。自噬与肿瘤细胞的转移紧密相关,研究认为肿瘤细胞的过度自噬能抑制其迁移及侵袭能力[10-11]。与姜黄素对肿瘤的迁移侵袭及自噬方面的作用[12-13]类似,本研究发现1g作为新型异硫脲取代姜黄素嘧啶类衍生物能够诱导结肠癌HCT116和HT29细胞自噬的发生,对其迁移及侵袭能力有一定的抑制作用。
CD147是细胞表面粘附分子,又叫细胞外基质金属蛋白酶诱导因子(extra-cellular matrix metallo proteinases inducer,EMMPRIN),在多种恶性肿瘤细胞中高表达,其可以通过自分泌的方式增加基质金属蛋白酶(matrix metallo proteinase,MMPS)的合成。高表达的CD147还可刺激纤维母细胞分泌MMPS,促进肿瘤细胞基底膜和间质成分降解,并和MMPS形成致密复合物,高度集中在肿瘤细胞膜上,加快肿瘤间质的降解,由此促进了肿瘤细胞的浸润和迁移[14-17]。PI3K/AKT信号通路由PI3激酶(PI3K)、蛋白激酶B(AKT)等分子组成与肿瘤的发生发展密切相关[18]。PI3K/AKT通路中PI3K主要指I类PI3K(PI3KC I),它是有一个催化亚基和一个调节亚基组成的异源二聚体,可被G蛋白耦联受体、蛋白酪氨酸激酶受体、RAS蛋白等激活。PI3K活化后可产生脂质类产物PIP3,PIP3可作为第二信使与含有PH结构域的AKT蛋白结合使其磷酸化从而活化 AKT,因此p-PI3K/PI3K、p-AKT/AKT表达高低能体现PI3K/AKT通路的活化程度。激活后的PI3K/AKT通路经过一系列的调控能抑制自噬相关蛋白LC3表达从而抑制细胞自噬[19-20]。近年来有研究显示,CD147对肿瘤细胞的自噬具有抑制作用,CD147可能通过调节PI3K/Akt信号通路而影响细胞的自噬[21-22]。FEI等[23]认为CD147与CD98的重链在肿瘤细胞膜上可以形成复合物,该复合物可以通过激活PI3K/Akt通路来影响肿瘤细胞的生长,下调CD147的表达可以进一步降低肿瘤细胞中激活丝氨酸/苏氨酸激酶AKT的表达。GOU等[24]研究也显示,CD147通过影响PI3K/Akt通路的表达而下调自噬相关蛋白Beclin1的表达,进而证实CD147通过PI3K/Akt信号通路调节肝癌细胞的自噬。本研究Western blotting检验结果表明,1g能够抑制HCT116和HT29细胞中CD147表达和PI3K及AKT的磷酸化,诱导细胞自噬。而高表达的CD147明显逆转了1g的作用,促进HCT116和HT29细胞中PI3K及AKT的磷酸化,激活PI3K/AKT通路。以PI3K抑制剂处理CD147过表达的细胞后,其细胞内PI3K及AKT的磷酸化明显下降,PI3K/AKT通路活化程度降低,说明1g能抑制肿瘤细胞中CD147表达和PI3K/AKT通路。由此,lg有望在结肠癌的治疗中,抑制肿瘤细胞的迁移和侵袭,达到减缓肿瘤的发展的目的,成为新的治疗药物。但其作用效果以及副作用均有待临床研究和验证。

A.正常组;B.1g组;C.CD147干扰组;D.干扰对照组; E.CD147过表达组;F.过表达对照组;G.CD147过表达+PI3K抑制剂组;①与1g组比较,P<0.05;②与CD147过表达组比较,P<0.05。
Fig.7ExpressionofCD147,p-PI3K/PI3K,p-AKT/AKTandLC3II/LC3IinHCT116cells
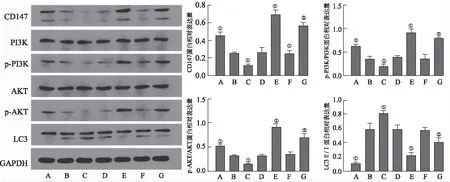
A.正常组;B.1g组;C.CD147干扰组;D.干扰对照组;E.CD147过表达组;F.过表达对照组;G.CD147过表达+PI3K抑制剂组;①与1g组比较,P<0.05;②与CD147过表达组比较,P<0.05。
Fig.8ExpressionofCD147,p-PI3K/PI3K,p-AKT/AKTandLC3II/LC3IinHT29cells
综上所述,抑制CD147及PI3K/AKT通路可能是1g诱导HCT116和HT29细胞发生自噬,抑制其增殖、迁移侵袭能力的分子机制之一。
