长效生长激素治疗青春期前生长激素缺乏症的疗效分析
2020-12-04何肖华马华梅李燕虹李思勤
何肖华,马华梅,李燕虹,李思勤
(中山大学附属第一医院儿科,广东广州 510080)
生长激素缺乏症(growth hormone deficiency,GHD)是由于腺垂体合成和分泌生长激素(growth hormone,GH)部分或完全缺乏,或由于GH 分子结构异常等所致的生长发育障碍性疾病。患者身高处于同种族、同年龄和同性别正常健康儿童生长曲线第3 百分位数以下或低于平均数减两个标准差[1]。GHD 是导致儿童身材矮小的内分泌原因之一。在GHD 的治疗中,重组人生长激素(recom⁃binant human growth hormone,rhGH)替代疗法已被广泛应用,疗效确切且安全性较好[2-3]。身高追赶是渐进的过程,因此达到身高改善的治疗时间通常需要多年。短效rhGH 需要每晚睡前30 min皮下注射一次。目前,国内外临床使用的rhGH 多为短效制剂,长期频繁注射既带来了许多痛苦,同时也降低了患者用药依从性而影响疗效。因此,通过改变rhGH 的剂型,从而改善药物的代谢参数,最终有效地降低病人的痛苦,显得日益重要。国内唯一已上市的rhGH新剂型聚乙二醇重组人生长激素(polyethylene glycol recombinant human growth hormone,PEG-rhGH)注射液是在rhGH 分子的N-末端偶联了一个聚乙二醇(poly ethylene glycol,PEG)修饰剂分子,药物经PEG 修饰后,可以提高被修饰药物的水溶性、增加生物相容性、改善组织分布、降低毒性作用、延长循环半衰期和增强疗效等[4]。本研究对青春期前GHD 患儿采取不同剂量的PEG-rhGH 治疗,对比观察不同剂量疗效和药物不良反应,以期为GHD 儿童的临床治疗提供依据和指导。
1 材料与方法
1.1 研究对象
2015 年6 月至2016 年10 月在我院儿童生长发育中心就诊并确诊的GHD 患儿37 例(男20例,女17 例)。入选标准:①根据病史、临床症状和体征、GH 激发试验和影像学检查等确诊为GHD:身高低于同年龄、同性别正常儿童生长曲线第3百分位数或减2 个标准差;身高增长速率(height velocity,HV)≤5.0 cm/years;两项作用机制不同的药物GH激发试验GH峰值<10.0 ng/mL;骨龄(bone age,BA)女孩≤9 岁、男孩≤10 岁,骨龄比实际年龄落后1 年以上;②青春发育期前(TannerⅠ期),年龄≥3 岁;③未接受过生长激素治疗;④受试者愿意并能够配合完成预定的访视、治疗计划和实验室检查等程序;⑤治疗期间受试者不能使用任何可能影响研究药物疗效评价的药物,如促性腺激素释放激素类似物(GnRHa)、雄激素、蛋白同化激素及他影响生长发育的药物(例如长期应用糖皮质激素等)。排除标准:头颅及垂体MRI 检查发现颅内肿瘤或脑动脉异常者,先天性、系统性、其他内分泌疾病,染色体异常,骨骼发育不良,心理情感障碍等其他原因导致的身材矮小及潜在肿瘤患者(家族史)。
1.2 研究方法
1.2.1 分组与给药方案 本研究得到中山大学附属第一医院伦理委员会批准,监护人签署知情同意书,患者采用随机数字表法分为两组,低剂量组PEG-rhGH(商品名“金赛增”,长春金赛药业股份有限公司)每周每公斤体质量皮下注射0.12 mg(n=19),高剂量组每周每公斤体质量皮下注射0.20 mg(n=18),均为每周皮下注射1 次,疗程26 周。
1.2.2 随访观察指标 所有患儿在基线和治疗后4、13 和26 周进行访视。监测身高、体质量,由专一固定的身高尺和体质量秤,以及检查性征等变化。以上检查均在固定的上午时间由固定和经过培训的专业人员操作。
1.2.3 辅助检查指标 在基线、第13 周、第26 周测定血、尿常规、肝肾功能、空腹胰岛素、空腹血糖、糖化血红蛋白(HbA1c)、血甲状腺功能、血总胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、血皮质醇,促肾上腺皮质激素、胰岛素样生长因子(IGF-1);骨龄用Greulich-Pyle 法判定。统计两组患儿PEG-rhGH治疗4、13和26周时HV、身高标准差积分(height standard deviation score,HtSDS)的变化。观察注射部位、治疗期间不良反应情况。
1.3 统计学分析
研究对象的身高以2005 年中国九大城市儿童的体格发育统计身高数据为标准[3,6]进行标化。标化方法:年龄身高标准差积分(Ht SDS CA)=(评价时间点身高-同年龄同性别正常儿童身高均值)/同年龄同性别正常儿童身高标准差;年生长速率(HV,cm/years)=12×(治疗结束时身高-治疗开始时身高)/完成治疗的时间(月)。采用SPSS 23.0 软件对数据进行统计学分析。针对两组(LDG 组和HDG 组)患儿治疗前的统计学描述和组间比较,对性别等计数资料,以例数和率的形式描述,组间比较采用χ2检验或Fisher 确切概率法;对于计量资料,先进行正态性检验和方差齐性检验,经检验,年龄、BMI、生长速度、IGF-1、BA、身高和体质量均满足正态分布,HtSDS 不满足正态分布,但从专业角度判断,认为应符合正态分布,此外,上述变量均满足方差齐性,因此上述计量资料均以均数±标准差的形式描述,组间比较均采用两独立样本t检验。采用多元方差分析(MANOVA)和双因素重复测量方差分析方法,分别对各个指标(HV、HtSDS、IGF-1、骨龄等)在基线、4、13 和26 周等不同时点、不同剂量组别下进行分析比较,考察时点和剂量组的主效应,并针对存在交互作用的情况进行时点和剂量组单独效应的考察,检验水准α=0.05,P < 0.05 认为差异有统计学意义。针对不同时点的多重比较,采用Bonferroni 法调整检验水准。
2 结果
2.1 治疗前两组基本情况
采用t检验对基线时IGF-1、年龄、身高、体质量、BMI、HtSDS、骨龄、GV 进行组间比较,采用卡方检验对基线时两组性别进行组间比较,治疗前两组基本情况相比较,差异无统计学意义(P>0.05;表1),具有可比性。
表1 两组患儿治疗前一般资料Table 1 General baseline information of the two groups of children(,n/N)

表1 两组患儿治疗前一般资料Table 1 General baseline information of the two groups of children(,n/N)
LDG:low-dose group;HDG:high-dose group
2.2 PEG-rhGH 治疗前后各项生长指标的比较
2.2.1 PEG-rhGH 治疗前后HV 比较 两剂量组患儿治疗前与治疗4、13 和26 周后各个治疗时段的HV(以折合为年增长速率cm/年)比较见表2。多元方差分析结果表明,治疗后不同时点的HV不全相同,即HV 有随治疗时间变化的趋势,HV差异有统计学意义(P<0.001)。两组治疗后相比较球形假设不满足(P< 0.001),故重复测量方差分析采用Greenhouse-Geisser 的校正的结果,结果与多元方差分析一致。组间比较结果表明,尚不能认为两剂量组患儿治疗后的HV 不同(P=0.055 >0.05),但由于P值与检验水准十分接近,因此在结果外推时需谨慎。
2.2.2 PEG-rhGH 治疗前后HtSDS 变化比较 两剂量组患儿治疗前、治疗后4、13 和26 周的HtSDS和HtSDS 增加值比较见表3。多元方差分析结果表明,治疗后不同时点患儿的HtSDS 不同,差异有统计学意义(P< 0.001);组别与时点的交互作用没有统计学意义(P=0.177),尚不能认为不同剂量组患儿HtSDS 随时间变化的趋势不同。由于球形假设不满足(P< 0.001),因此重复测量方差分析采用Greenhouse-Geisser 的校正结果,交互项的统计学检验与多元方差分析结果不同,此时应以多元方差分析结果为准,即交互效应无统计学意义,并用重复测量方差分析中校正的结果作为补充。组间比较结果表明,两剂量组患儿治疗后的HtSDS 差异无统计学意义(P=0.959>0.05),尚不能认为不同剂量组患儿治疗后的HtSDS 不同。
两剂量组儿童治疗后4、13 和26 周的HtSDS增加量比较,多元方差分析结果表明,治疗后不同时点,患儿的HtSDS 增加量不同,差异有统计学意义(P<0.001);组别与时点的交互作用无统计学意义(P=0.107),尚不能认为不同剂量组患儿HtSDS增加量随时间变化的趋势不同。由于球形假设不满足(P< 0.001),因此重复测量方差分析采用Greenhouse-Geisser 的校正结果,组别与时点的交互作用项P=0.05,结合多元方差分析结果,可以认为交互项无统计学意义。从组间比较结果看,P=0.052,两剂量组患儿治疗后的HtSDS 增加量差异可能无统计学意义。
2.2.3 PEG-rhGH 治疗前后IGF-1 比较 两剂量组患儿治疗前、治疗后13 和26 周的IGF-1 比较见表4。多元方差分析结果表明,治疗后不同时点患儿的IGF-1 不同(P< 0.001);组别与时点的交互作用有统计学意义,即不同组别患儿IGF-1 变化趋势不同(P=0.033)。由于球形假设不满足(P<0.015),因此重复测量方差分析采用Green⁃house-Geisser 的校正结果,时点主效应的结果与多元方差分析一致,但组别*时点交互项检验结果与多元方差分析不同,应以后者为准,即交互作用有统计学意义,应进一步分析时点的单独效应。组间比较结果表明,尚不能认为两剂量组患儿治疗后的IGF-1 差异不同(P=0.054>0.05),不同剂量组患儿的IGF-1 可能相同,但由于P 值接近检验水准,因此结果外推需谨慎。
表2 治疗后两组患儿HV 比较Table 2 Comparison of HV between the two groups of children after treatment()
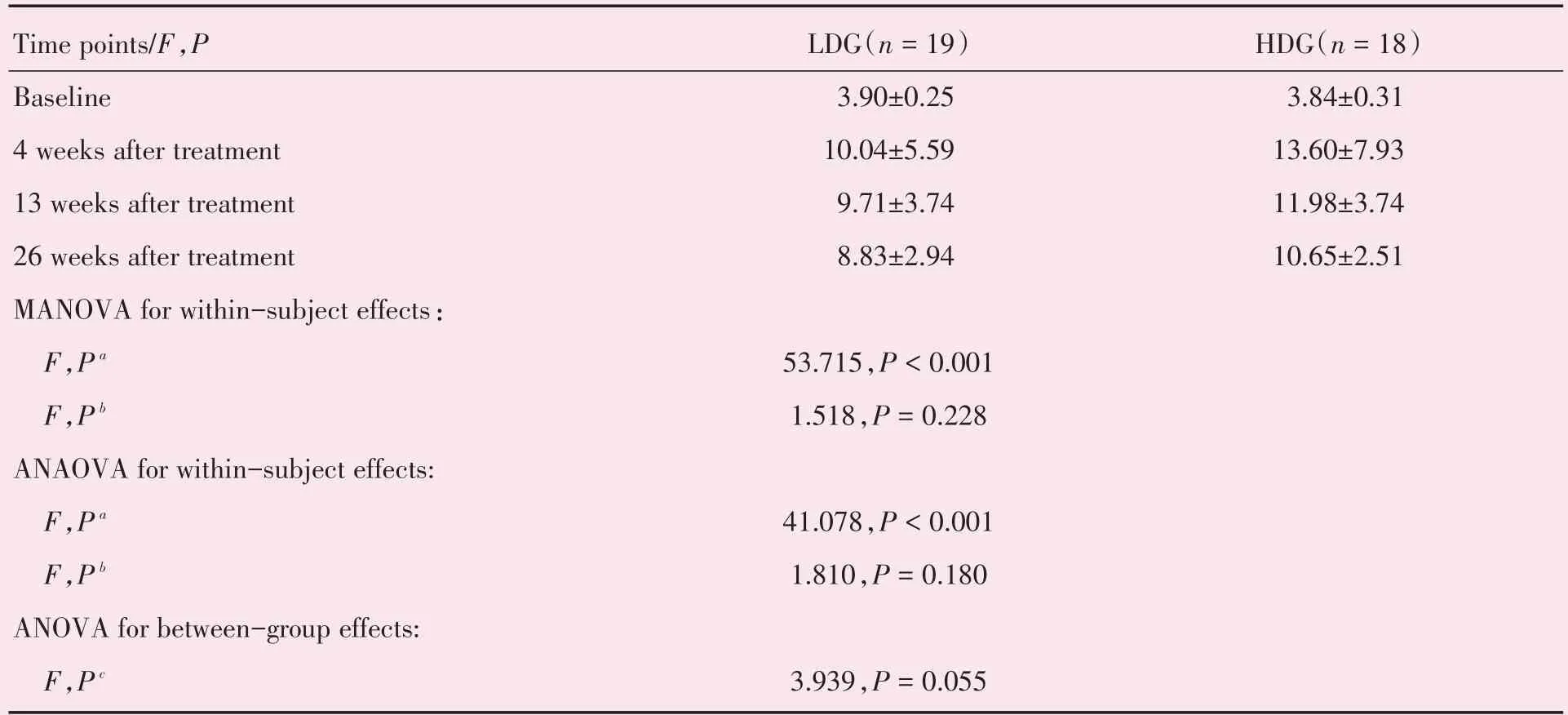
表2 治疗后两组患儿HV 比较Table 2 Comparison of HV between the two groups of children after treatment()
HV:height velocity;LDG:low-dose group;HDG:high-dose group;Pa for within-subject effect;Pb for interaction effect;Pc for between-group effect.
表3 治疗后两组患儿HtSDS 和HtSDS 增加值比较Table 3 Comparison of HtSDS and ΔHtSDS between the two groups of children after treatment()

表3 治疗后两组患儿HtSDS 和HtSDS 增加值比较Table 3 Comparison of HtSDS and ΔHtSDS between the two groups of children after treatment()
HtSDS:height standard deviation scores;LDG:low-dose group;HDG:high-dose group;Pa for within-subject effect;Pb for interaction effect;Pc for between-group effect.
进一步分析时点的单独效应,并进行两两比较,可见固定两剂量组后,时点的单独效应均具有统计学意义(P<0.001),见表5;时点间两两比较见表6,可见无论是在哪个剂量组,治疗前和治疗后13 周、治疗后26 周相比,IGF-1 值差异均有统计学意义,而治疗后13 周和26 周相比,差异无统计学意义。对剂量组别进行单独效应分析见表7,剂量组单独效应无统计学意义。
2.2.4 PEG-rhGH 治疗前后BA 变化比较 两剂量组患儿治疗26 周比较,多元方差分析和重复测量方差分析结果一致。结果表明,治疗前后患儿的骨龄不同,差异有统计学意义(P<0.001),组别与时点的交互作用无统计学意义,即不同剂量组别的患儿,治疗前后患儿骨龄变化没有差别(P=0.296)。组间比较结果表明,两剂量组患儿骨龄比较,差异无统计学意义(P=0.939),尚不能认为不同剂量组患儿的骨龄不同。两组的骨龄进展定义为ΔBA/ΔCA=[(治疗后BA-治疗前BA)]/[治疗后年龄(CA)-治疗前CA],由于轻度违背正态性,因此采用非参数检验进行组间差异比较,结果无统计学意义(P=0.680),可以认为两组的骨龄进展相同,无统计学差异(表8)。
表4 治疗后两组患儿IGF-1 比较Table 4 Comparison of IGF-1 between the two groups of children after treatment [(),n(%),M(P25,P75)]
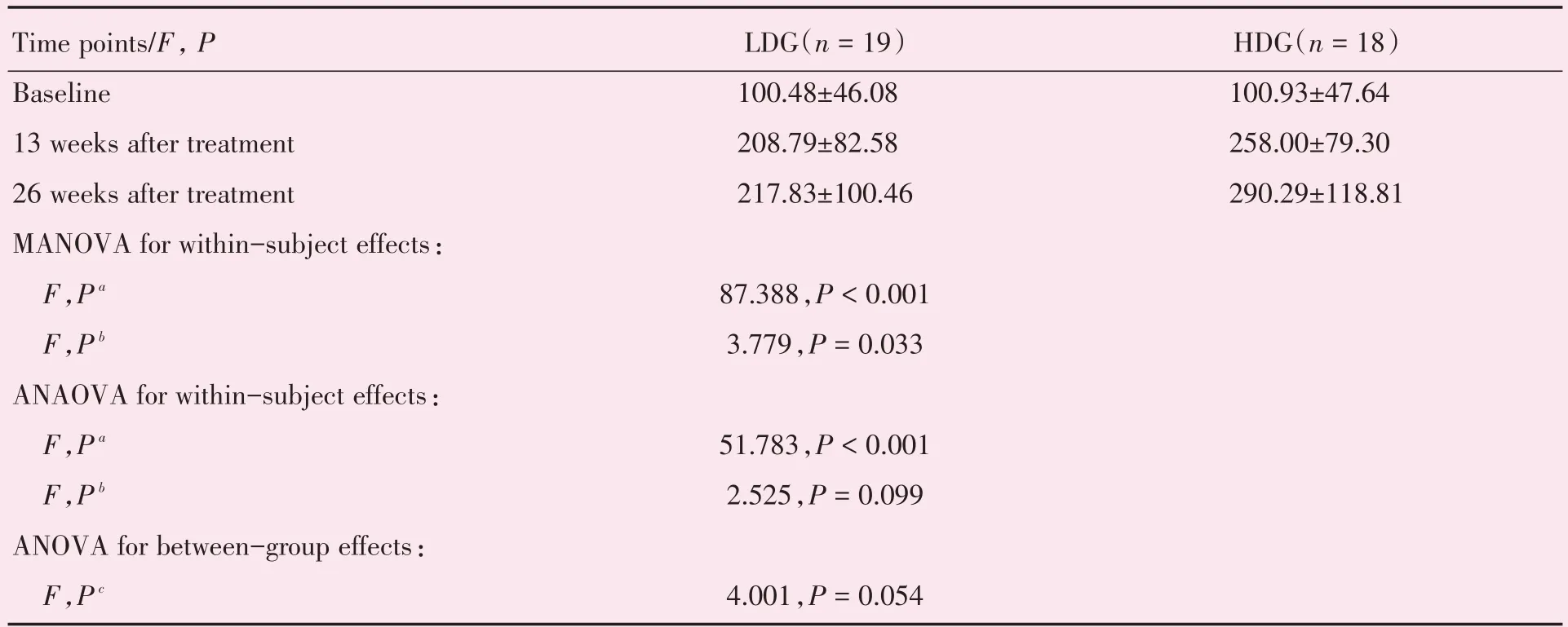
表4 治疗后两组患儿IGF-1 比较Table 4 Comparison of IGF-1 between the two groups of children after treatment [(),n(%),M(P25,P75)]
IGF-1:insulin-like growth factor-1;LDG:low-dose group;HDG:high-dose group;Pa for within-subject effect;Pb for interaction effect;Pc for between-group effect.

表5 两剂量组患儿时点因素单独效应的多元方差分析Table 5 MANOVA for the simple effects of the time points for the two groups of children

表6 不同剂量组内各时点间的两两比较结果Table 6 Multiple comparison of the time points within the two groups
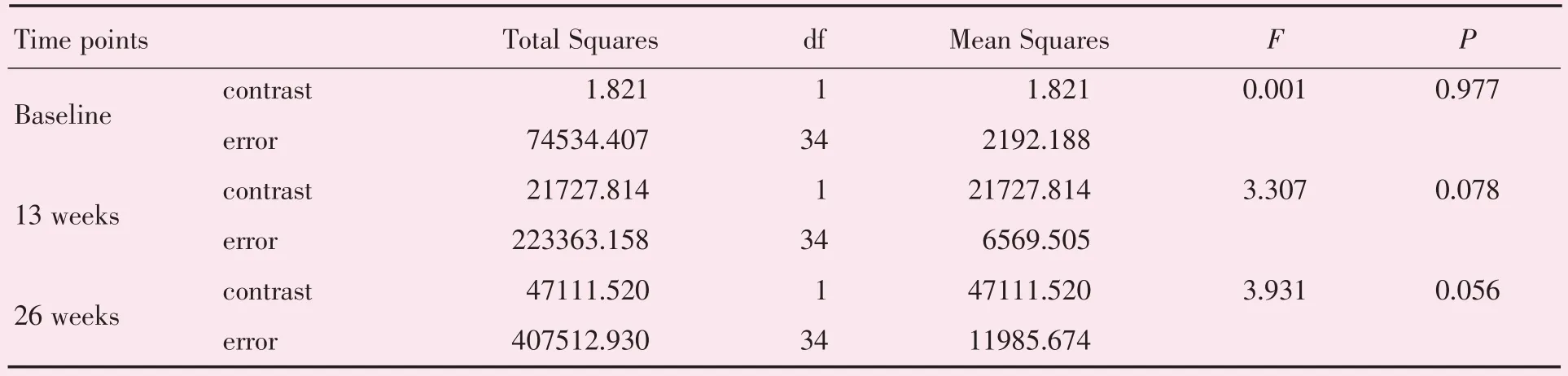
表7 不同时点下剂量组的单独效应Table 7 Simple effects of group at different time points
表8 治疗后两组患儿BA 比较Table 8 Comparison of BA between the two groups of children after treatment [(),M(P25,P75)]
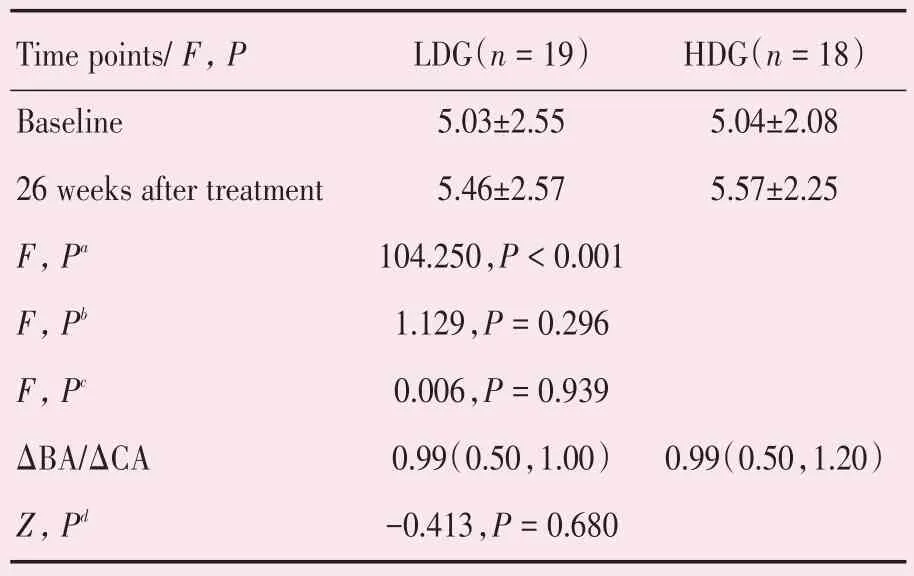
表8 治疗后两组患儿BA 比较Table 8 Comparison of BA between the two groups of children after treatment [(),M(P25,P75)]
BA:bone age;LDG:low-dose group;HDG:high-dose group;Pa for within-subject effect;Pb for interaction effect;Pc for between-group effect;Pd forbetween-group effect of ΔBA/ΔCA
2.2.5 不良事件发生情况 两组儿童均没有治疗中断。两组儿童治疗全程无出现严重事件反应,发生不良事件共25 件,总发生率为67.6%。PEG-rh⁃GH 治疗13 周时有6 例出现上臂注射部位脂肪萎缩(图1、2)。轻微5例、比较明显1例;分布其中男性5例,女性1例;年龄分布在4岁至8岁;高剂量组3 例,低剂量组3 例。因家长固定在上臂部位注射。发现后立刻指导家长停止该部位注射,改轮换注射脐部周围、大腿中段外侧。轻微萎缩者表现为双上臂脂肪变薄,停止该部位注射后3个月内自行恢复正常;明显萎缩病例上臂注射部位脂肪明显减少,无累及肌肉,停止该部位注射6 个月自行恢复正常。治疗后胰岛素、糖化血红蛋白、血、尿常规、肝功能无出现异常,其他不良反应分布见表9。
2.3 发生脂肪萎缩患儿与无脂肪萎缩患儿的生长情况比较
共发生脂肪萎缩患儿6 例(男性5 例,女性1 例)与没有发生脂肪萎缩患儿31 例治疗前一般情况比较差异均无统计学意义(P> 0.05)。治疗过程、终结时发生脂肪萎缩的患儿与没有发生脂肪萎缩的患儿IGF-1 值和生长速度比较,差异均无统计学意义,脂肪萎缩与注射剂量、IGF-1 水平均无关联(P>0.05,表10)。

表9 治疗期间不良反应比较Table 9 Comparison of adverse events between the two groups
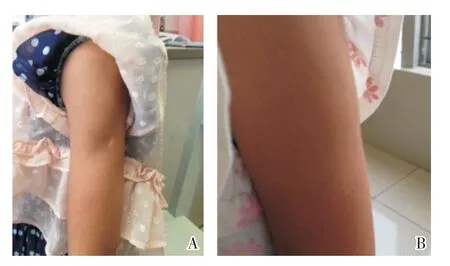
图1 患儿脂肪萎缩Fig.1 Lipoatrophy of the patient No.11
3 讨论
生长激素(GH)是脑垂体前叶分泌的一种激素,由191 个氨基酸组成,是人体内最重要的促进生长的激素。rhGH 具有与人体内源GH 同等的效应[5]。GHD 是儿童身材矮小的内分泌原因之一,是由于生长激素合成和分泌部分或完全缺乏而引起的生长发育障碍[6],人类身高的线性增长受下丘脑-垂体GH-IGF 轴的调节,生长激素在调控人体正常生长中起重要作用,除需要产生足够生长激素外,还需要有IGF-1-靶器官-环境等之间的相互协同作用。目前GHD儿童的主要治疗手段是以外源性的生长激素替代治疗。临床应用rhGH 治疗GHD 的生长迟缓已经有30 多年,其促生长疗效目前已被广泛认可[5-7],短效rhGH 需要通过每晚注射给药,给患者带来痛苦使依从性差会影响治疗效果[5,8],长效制剂的面世克服了此不足。

图2 患儿脂肪萎缩Fig.2 Lipoatrophy of the patient No.31
本研究结果发现,PEG-rhGH 治疗GHD 患儿无论低剂量和高剂量组患儿治疗后HV、HtSDS、和IGF-1 均增加,表明PEG-rhGH 治疗对促进生长的有效性,与文献报道一致[9-11]。
IGF-1水平是评价rhGH 安全性和依从性的主要指标,应在每次随访中监测[12-13]。生长激素可以刺激肝脏等脏器合成IGF-1,IGF-1 是一种与胰岛素结构和功能相似的促细胞生长多肽,IGF-1是介导生长激素促生长作用的主要物质。IGF-1在血液中的水平随生长激素的改变而变化,而IGF-1 负反馈调节生长激素的分泌,是生长激素的生理性调节因子[14]。本研究观察到PEG-rhGH治疗后3 个月和6 个月,两组儿童的血清IGF-1 水平均较基线和随着治疗时间升高,表明PEG-rh⁃GH 治疗后能够有效提升GHD 儿童GH-IGF-1 轴的生物效应,促进线性生长。
表10 发生脂肪萎缩与无脂肪萎缩患儿的生长资料比较Table 10 Comparison of growth data between children with and without lipoatrophy [(),n(%),M(P25,P75)]

表10 发生脂肪萎缩与无脂肪萎缩患儿的生长资料比较Table 10 Comparison of growth data between children with and without lipoatrophy [(),n(%),M(P25,P75)]
HtSDS:height standard deviation scores;BA:bone age;IGF-1:insulin-like growth factor-1;HV:height velocity.1)for Fisher′s exact test;ΔBA/ΔCA used Z for nonparametric test,other variables in this table used t for independent t test.
PEG-rhGH 用于治疗身材矮小,要关注的另一问题是否会致骨龄增长加快。国内外大量临床资料证明,生长激素治疗后骨龄增长与年龄增长平行,不会引起骨龄加快增长。使用推荐剂量的生长激素治疗,并不会引起骨龄及青春期发育提前,长期GH 治疗将改善身高不足,大部分患者能够达到目标身高[12,15-16]。本研究使用PEG-rhGH治疗后两组患儿骨龄均没有差异,观察终点未观察到骨龄提前及青春发育提前现象。
rhGH 的治疗,除了对身高增长有效性监测外,还要重视安全性检测,而安全性是规范性治疗的重点之一[5-6,9]。目前报道rhGH 治疗的相关不良反应有良性颅内高压、糖代谢影响、甲状腺功能低下、股骨头滑脱、脊柱侧弯、诱发肿瘤的可能性、色素痣、手脚变大等[5-9],本研究全程观察无发生良性颅内高压、股骨头滑脱、诱发肿瘤、色素痣、手脚变大等不良反应。我们研究中观察到注射部位脂肪萎缩6 例,注射部位脂肪萎缩是一些长效rh⁃GH 制剂中常见问题[17-18],我们在治疗13 周回访时观察到上臂注射局部脂肪萎缩6 例(轻度5 例,比较明显1 例,均无局部红肿、热、痛和硬结),比例达16.2%,即停止注射上臂,改轮换注射脐周和两大腿中断外侧,轻微萎缩部位3 个月自行恢复正常,比较明显的1 例6 个月自行恢复正常,与文献报道的[18]聚乙二醇化rhGH 至局部脂肪萎缩2-3 月自行恢复结果一致。此6 例患儿,分析原因可能是发生注射部位脂肪萎缩患儿没有执行好注射部位的更换原则,改注射脐周、大腿中段外侧轮换,轻度局部萎缩症状5 例在停止该部位注射3 个月后萎缩局部自行恢复正常,明显1 例在6 个月恢复正常。说明不连续在同一部位注射是可以避免局部脂肪萎缩的,聚乙二醇会在局部降解吸收,对脂肪组织的影响也是可逆的。因此,提示我们在生长激素治疗中指导家长和患儿重视注射部位轮换的重要性、必要性,使他们认识到注射部位不轮换所带来的危害,克服畏难情绪。同时研究发现发生局部脂肪萎缩与无发生萎缩的患儿生长速度比较没有差异,也说明及时采取措施停止萎缩部位的注射,没有引起促生长的受损。因此生长激素治疗除了做好身高增长的有效监测外还要重视生长激素治疗的注射部位观察。虽然在本研究中PEG-rhGH 注射出现的脂肪萎缩,对患儿的生长速率无影响,提示我们在治疗期间每次随访时评估注射部位局部情况,及时发现问题及时处理,也进一步提示规范生长激素治疗注射的重要性和必要性,包括如下:评估家长和患儿的心理状况,与家长建立信任友好的关系,做好访谈,解除心理负担和困惑忧虑,鼓励和树立信心,使患儿保持身心愉快;做好监护人注射技术培训,教会如何执行无菌技术、药物剂量抽吸、注射方法、无痛注射技术、注射部位指导、固定时间注射、注射部位轮换方法指导;特别强调每次注射后观察注射部位有无红、肿、痛、局部组织凹陷等皮肤异常,避免反复注射同一部位发生局部萎缩,影响药物吸收;药物的保管,药物2 ℃~8 ℃冷藏保存,避免震荡和冻结;健康指导,充足均衡的营养是生长发育的物质基础,鼓励患儿摄入足够的蛋白质、碳水化合物、脂肪、维生素等;保障每天运动使骨骼、组织供血增加,每天22:00 前入睡,保障睡眠时间10 h。建立微信群,家长与医护及时沟通,及时得到专业的指导。
综上所述,本研究证实PEG-rhGH 治疗GHD儿童是安全有效的,但是PEG-rhGH长时间治疗需要配合长期综合管理。本研究尚存不足:一样本量较少;二是观察时间较短,需要继续观察其治疗剂量与远期效益及不良反应,更要关注PEG-rhGH 治疗的长期管理,使治疗更加安全有效。PEG-rhGH治疗GHD 儿童应具有广阔的应用前景。
(致谢:参与此项研究的患儿、家长及全体研究人员;及杜敏联教授对本文章撰写做出指导)
