抗N-甲基-D-天冬氨酸受体脑炎与髓鞘少突胶质细胞糖蛋白抗体相关疾病并存的临床特征
2020-12-04曹丽平马晓宇吴远华王婧琪舒崖清孙晓渤李小晶
曹丽平 ,马晓宇,吴远华,王婧琪,舒崖清,孙晓渤,李小晶,邱 伟
(1.广州中医药大学第五临床医学院,广东广州510405//贵州中医药大学第一附属医院脑病内科贵州贵阳 550001;2.中山大学附属第三医院神经内科,广东广州 510630;3.广州市妇女儿童医疗中心神经内科,广东广州 510000)
抗N-甲基-D-天冬氨酸受体(N-methyl-D as⁃partate,NMDAR)脑炎是自身免疫性脑炎(autoim⁃mune encephalitis,AE)中最常见类型,约占AE 患者的80%[1-2]。通常由自身免疫介导而引起脑实质弥漫性或多发性炎性病变,临床表现为精神行为异常、癫痫发作、认知障碍、言语及运动障碍等一系列复杂的神经精神综合征[3]。髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)是表达于中枢神经系统少突胶质细胞膜和髓鞘表面的一种糖蛋白,具有高度免疫原性。近年来,MOG 抗体作为一种新的脱髓鞘疾病诊断的血清学生物标志物而被报道[4],认为是中枢神经系统炎性脱髓鞘疾病(ADS)中的重要自身免疫抗体和细胞免疫反应的靶点[5],在急性播散性脑脊髓炎(ADEM)、视神经脊髓炎(NMO)、多发性硬化(MS)、视神经炎(ON)等疾病中均有发现。抗髓鞘少突胶质细胞糖蛋白免疫球蛋白G 抗体(antimyelin oligodendrocyte glycoprotein,IgG MOG-IgG)相关疾病(MOG-IgG associated disorders,MOGAD)被认为是一种免疫介导的中枢神经系统炎性脱髓鞘疾病,抗MOG-IgG 可能是MOGAD 的致病性抗体[6]。近年国内外开始报道,临床上患者同时合并抗NMDAR 脑炎与MOGAD 的病例[7-9],然而报道样本量少。本文通过回顾性分析抗NMDAR脑炎与MOG 抗体相关疾病并存患者与单纯抗NMDAR 脑炎患者的临床资料特点,探讨其并存的可能免疫机制,以期为临床早期诊治该病提供依据。
1 材料与方法
1.1 研究对象
回顾性收集2015 年2 月至2019 年8 月广东省中山大学附属第三医院神经内科和广州市妇女儿童医疗中心神经内科共同收治的36 例抗NMDAR脑炎患者,其中17 例为与MOG 抗体相关疾病同时存在的并存组,19 例为单纯抗NMDAR 脑炎的对照组。抗NMDAR 脑炎的诊断,参照2016 年Graus 与Dalmau 提出的诊断标准和2017 年中华医学会发布的《中国自身免疫性脑炎诊治专家共识》[10-11]。MOGAD 参考Jarius 诊断标准[12]和2020年中国免疫学会神经免疫分会发布的《抗髓鞘少突胶质细胞糖蛋白免疫球蛋白G 抗体相关疾病诊断和治疗中国专家共识》[6]。本研究取得中山大学附属第三医院伦理委员会同意及患者知情同意。
1.2 研究方法
收集研究对象的临床资料,具体包括一般资料、首发症状、实验室检查、影像学特征、治疗和预后情况。通过门诊复诊及电话途径进行随访。应用改良Rankin 量表(Modified Rankin Scale,mRS)评分进行生活能力及预后评估,mRS 评分≤2 分视为预后较好,>2 分者视为预后不良。
所有患者的脑脊液抗NMDAR 抗体滴度和血清MOG 抗体滴度的检测均在广东省中山大学附属第三医院神经内科实验室采用基于细胞的免疫荧光检测(cell based assay,CBA),此方法使用转染全长人MOG 或NMDAR 的活细胞测定患者血清中的MOG-IgG 或NMDAR-IgG。将全长人MOG或NMDAR 亚克隆到pIRES2-EGFP 质粒中。使用Lipofectamine2000 试剂将它们用于瞬时转染HEK293T 细胞。转染后36 h,将细胞用40 g/L 多聚甲醛固定20 min 后,在室温下与来自患者和对照组的离心血清(1∶20,用含10%山羊血清的PBS稀释)孵育30 min。除去孔内液体,并用PBS 洗涤3次后。然后用抗人IgG(1∶1 000;Thermo Scientific)的AlexaFluor 546 二抗在室温下对细胞进行免疫标记1 h。使用Zeiss Axiovert A1 荧光显微镜获得图像(图1)。
1.3 统计方法
本研究采用SPSS 25.0 软件进行统计分析,对于符合正态分布及方差齐性要求的数据,用表示,非正态分布的计量资料用中位数和四分位数M(P25~P75)描述。两组计量资料比较采用独立样本t检验或Wilcoxon 秩和检验进行比较,两组分类资料比较采用Fisher 确切概率法,统计学检验水准α=0.05。
2 结果
2.1 一般资料
两组患者一般资料中,从发病性别方面分析,并存组男性多于女性,而对照组女性多于男性;从发病年龄方面分析,两组患者均趋于年青化,但两组在性别、年龄方面差异无统计学意义(P>0.05;表1)。

图1 脑脊液NMDAR-IgG 及血清MOG-IgG 检测情况Fig.1 Detection of NMDAR-IGG and serum MOG-IGG in cerebrospinal fluid

表1 两组患者一般临床资料特征Table 1 General clinical data characteristics of patients in both groups [n,M(P25~P75)]
2.2 首发症状
并存组17例患者中,头痛、发热者4例(4/17),癫痫发作者3 例(3/17),精神行为异常者3 例(3/17),复视者2 例(2/17),言语障碍者1 例(1/17),不自主运动者1 例(1/17),面部麻木者1 例(1/17),视物模糊者1 例(1/17),视物旋转者1 例(1/17)。对照组19例患者中,头痛、发热者5例(5/19),癫痫发作者4 例(4/19),精神行为异常者5 例(5/19),失眠1 例(1/19),认知障碍2 例(2/19),不自主运动者1 例(1/19),肢体麻木者1 例(1/19)。两组患者的首发症状多表现为抗NMDAR 脑炎典型临床表现,如头痛、发热,癫痫发作和精神行为异常,但并存组部分患者表现为不常见的脱髓鞘症状,如复视、面部麻木和视物模糊,两组患者在首发症状表现方面差异无统计学意义(P>0.05;表2)。
2.3 实验室检查
2.3.1 血清学检测 两组患者均接受过甲状腺功能及抗体、结缔组织病相关抗体和肿瘤标志物的检测,其中并存组2 例患者(2/17)和对照组13 例患者(13/19)甲状腺功能及抗体异常,余检测结果未见明显异常。两组患者血清学检测结果的异常多表现为甲状腺功能及抗体异常,其中对照组患者例数多于并存组(13>2)。
2.3.2 脑脊液检查 两组患者均接受过腰椎穿刺术取脑脊液检查,其中并存组13 例患者(13/17)完成了压力检测,3 例(3/17)压力升高,分别为220、250 和250 mmH2O;14 例(14/17)脑脊液白细胞计数升高,为(6~473)×106/L,细胞学分类以淋巴细胞为主;5 例(5/17)脑脊液蛋白水平升高,为0.46~2.24 g/L;17例患者脑脊液糖、氯水平基本正常。对照组15例患者(15/19)完成了压力检测,6例(6/19)压力升高,波动在185~330 mmH2O;11 例(11/19)脑脊液白细胞计数升高,为(6~210)×106/L,细胞学分类以淋巴细胞为主;18例(18/19)脑脊液蛋白、糖、氯水平基本正常。两组患者脑脊液检查中,部分表现为脑脊液压力、白细胞数升高,但两组患者的脑脊液蛋白、糖、氯水平基本正常。
2.3.3 神经元抗体滴度检测 两组患者均完成了脑脊液抗NMDAR 抗体滴度、血清MOG 抗体滴度检测,其中并存组脑脊液抗NMDAR 抗体滴度波动在(1∶1~1∶100),血清MOG 抗体滴度波动在(1∶25~1∶1 280);对照组脑脊液抗NMDAR 抗体滴度波动在(1∶1~1∶320),血清MOG 抗体滴度阴性。两组患者神经元抗体滴度检测中,针对脑脊液抗NMDAR 抗体滴度(1∶1)患者中,并存组有1 例,对照组有2 例;抗体滴度(1∶10)患者中,并存组和对照组各有1 例;抗体滴度(1∶32)患者中,并存组有6 例,对照组有5 例;抗体滴度(1∶100)患者中,并存组有9 例,对照组有10 例;抗体滴度(1∶320)患者中,仅对照组有1 例;经统计分析两组患者在脑脊液抗NMDAR 抗体滴度方面差异无统计学意义(P>0.05;表2)。
2.4 脑电图检查
并存组17 例患者中有16 例接受过脑电图检查,其中2 例患者(2/16)提示癫痫样放电,另14 例表现为非特异性慢波。对照组19例患者中有11例接受过脑电图检查,其中1 例患者(1/11)提示癫痫样放电,另10 例(10/11)表现为非特异性慢波。两组患者脑电图检查表现为非特异性慢波患者居多,癫痫样放电见于少部分患者。
2.5 影像学检查
2.5.1 MRI 检查 并存组17 例患者均接受过头颅MRI 检查,其中15 例(15/17)出现颅内病灶,病灶累及皮质、皮质下15 例(15/17),脑干5 例(5/17),基底节区6 例(6/17),丘脑2 例(2/17),小脑2 例(2/17),胼胝体1 例(1/17),脑膜1 例(1/17)。病灶表现为斑点、斑片状长T2WI 及FLAIR 异常信号;4例(4/17)病灶表现为点状、斑片状异常强化;部分病例详见图2。5 例患者(5/17)接受过颈胸髓MRI检查,其中2 例(2/5)发现异常病灶,表现为受累脊髓肿胀,病灶呈斑片T2WI 及FLAIR 异常信号,且>3 个椎体节段,未见强化;部分病例详见图3。1 例以视物模糊为首发症状的患者接受过视神经MRI 检查,表现为双侧视神经内斑片状稍长T2WI异常信号,增强见轻度强化。
对照组19 例患者均接受过头颅MRI 检查,其中11 例(11/19)出现颅内病灶,病灶累及皮质、皮质下11 例(11/19),脑干1 例(1/19),基底节区1 例(1/19),丘脑2 例(2/19),胼胝体1 例(1/19)。病灶表现为斑点、斑片状长T2WI 及FLAIR 异常信号;19例患者均未见病灶异常强化。1例患者(1/19)接受过颈胸髓MRI 检查,表现为受累脊髓肿胀,病灶呈斑片T2WI 及FLAIR 异常信号,且> 3 个椎体节段,未见强化。
两组患者MRI 病灶均表现为累及皮质及皮质下,但并存组患者还表现为皮质下白质病灶,可累及脊髓。两组患者在病灶区域分布方面差异无统计学意义(P>0.05;表2)。
2.5.218F-FDG PET/CT检查 并存组17例患者中,3 例(3/17)患者接受过此项检查,其中2 例(2/3)异常,1 例提示颞叶、枕叶及丘脑代谢低;另1 例提示脑桥、延髓代谢高。同时均未提示合并有其他系统肿瘤病变。对照组19 例患者中7 例(7/19)患者接受过此项检查,6 例(6/7)异常,5 例分别提示顶叶、颞叶、枕叶代谢低;另1 例提示额叶、基底节代谢高。同时均未提示合并有其他系统肿瘤病变。两组患者中部分完成了18F-FDG PET/CT检查,病灶区域表现为颞叶、枕叶代谢低的特异性表现。
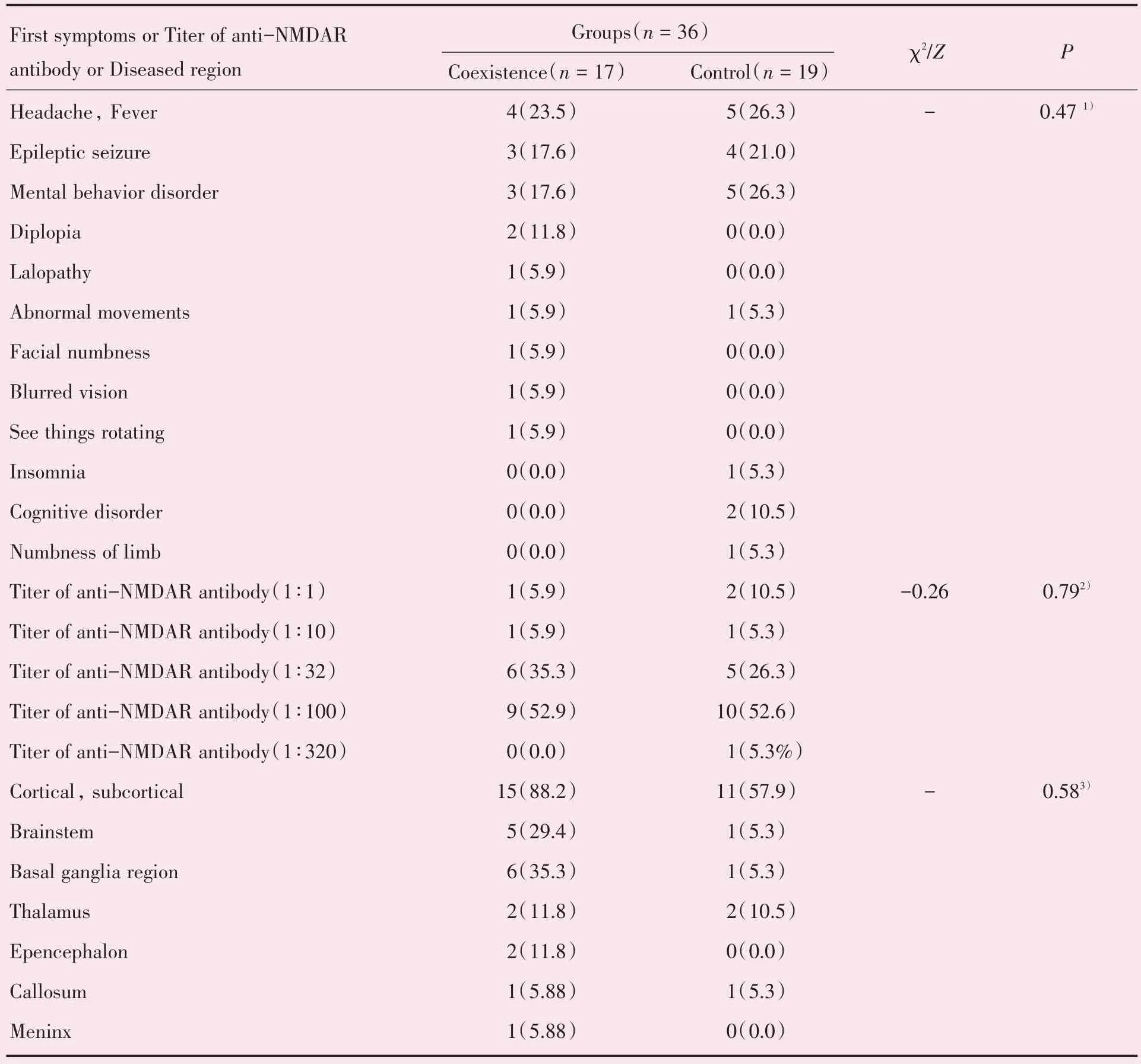
表2 两组患者首发症状、抗NMDAR 抗体滴度及头颅MRI 病灶区域比较Table 2 Comparison of initial symptoms,Anti-NMDAR antibody titer and cranial MRI lesion area between the two groups [n(%)]

图2 并存组病例8 患者MRI-FLAIRFig.2 MRI-FLAIR images of case 8 in the coexisting group

图3 并存组病例11 患者头颅MRI-T2 FLAIRFig.3 MRI-T2 FLAIR images of case 11 in the coexistence group
2.6 治疗及预后情况
两组患者均应用了甲泼尼龙静脉治疗后小剂量口服维持,部分联合使用了免疫球蛋白、利妥昔单抗注射液、硫唑嘌呤或吗替麦考酚酯。所有患者的症状均有所改善,mRS 评分均下降1~2 分。经3~50 个月的随访,并存组3 例有复发,对照组1 例有复发,4 例患者复发症状的严重程度均较首次发作为轻,经再次免疫治疗后症状改善,后续随访期内未再见复发。
3 讨论
抗NMDAR 脑炎是一类由抗NMDA 受体Glu N1 亚基抗体作用于中枢神经系统(CNS)引起的脑部异常炎症反应疾病,其发病以青年女性为多见,常合并卵巢畸胎瘤,与颅内病毒感染存在可能的联系[13-15]。MOG 抗体是免疫球蛋白IgG1 的一种亚型,参与维持CNS 髓鞘的完整性及相关免疫调节[16],可介导自身免疫性脱髓鞘病。近年来,随着抗NMDAR 脑炎合并多重神经元自身抗体叠加综合征的报道逐渐增多,初步表明临床客观存在抗NMDAR 脑炎与MOGAD 并存的情况,两者存在共同的免疫致病机制。一方面,可能是针对少突胶质细胞的靶向免疫致病,NMDAR 和MOG 这两种抗原同时存在于少突胶质细胞表面,当受到异常免疫攻击时,这两种抗原可能同时或相继受累,从而产生抗体共同致病。另一方面,可能归因于免疫重建,在减少剂量或停止免疫治疗后,免疫系统将从免疫抑制中逐渐恢复,这就导致免疫细胞攻击自身抗原[17],可能诱发抗NM⁃DAR 抗体和MOG 抗体共同引起中枢神经系统炎症病变。
本研究发现抗NMDAR脑炎与MOGAD并存患者具有相对特异的临床特征。此类患者发病年龄趋向青年化22(15~32)岁,男性多于女性(10∶7)。除此外,并存患者中仅有1 例合并卵巢畸胎瘤,这与单纯的抗NMDAR 脑炎以青年女性多见,常合并畸胎瘤有所不同,提示畸胎瘤可能不直接参与并存患者的致病过程,与Titulaer 等[18]报道的结果一致。本研究中并存组和对照组患者均以抗NMDAR 脑炎典型表现多见,首发症状以头痛、发热、癫痫发作和精神行为异常为主;但并存组部分患者中出现了抗NMDAR 脑炎不常见的与MOGAD相关症状,如复视、视物模糊、面部麻木,而未出现失眠、认知障碍此类抗NMDAR 脑炎常见的症状。因此,当抗NMDAR脑炎患者临床合并有其他症状时,需及时对抗MOG 抗体等指标进行检测。
抗NMDAR 脑炎头颅MRI 可表现为无明显异常,或仅有散在的皮质、皮质下点片状病灶,部分可累及边缘系统;少数病例兼有MOGAD 的影像学特点,大脑白质或者脑干受累[14]。而18F-FDG PET/CT 敏感度高于MRI,表现为双侧枕叶代谢明显减低,伴额叶与基底节代谢升高[19]。本研究中并存组和对照组患者的头颅MRI 主要表现与既往报道相符,此外,2 例并存组患者的颈胸髓MRI 提示脊髓受累;1 例视神经MRI 提示双侧视神经受累,表明当抗NMDAR 脑炎患者出现脱髓鞘相关临床症状时,进行必要的脊髓、视神经MRI 检查有助于并存患者的早期诊断。脑脊液抗NMDAR 抗体滴度和血清MOG 抗体滴度可作为并存患者的诊断性辅助指标,但两者对病情的评价作用尚未明确[20-22]。本研究表明,在并存患者中,两种抗体滴度与病情预后尚无明显直接关系。治疗方面,并存组和对照组所有患者经免疫抑制治疗后,mRS评分均下降1~2 分,临床症状均有所改善,提示并存患者对免疫治疗反应仍然良好,可以得到较好的转归,且持续免疫抑制治疗有减少并存患者复发可能。
综上分析,临床上抗NMDAR 脑炎与MOG 抗体相关疾病并存的患者在发病性别上以男性居多,成人多于儿童,合并肿瘤的情况少见,对免疫治疗反应良好,推测此类患者在免疫致病机制上具有相对的特异性。后续尚需扩大样本量的研究。
