进化中的肿瘤经导管动脉化疗栓塞术
2020-12-04黄勇慧
黄勇慧
(中山大学附属第一医院放射介入科,广东广州 510080)
经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是最常用的一项治疗肿瘤的放射介入技术。它是将导管选择性或超选择性插入到肿瘤供血靶动脉后,以适当的速度注入适量的化疗药物和栓塞剂,使化疗药物达到局部高浓度,以充分发挥抗癌作用的同时,利用栓塞剂使肿瘤靶动脉闭塞,引起肿瘤组织缺血坏死。该技术诞生于上世纪70 年代,在多年的发展历程中,它不断推演变化,经历了被质疑到被认可被优化以及逐步标准化和规范化的过程,最终蜕茧成蝶成为了一项实体肿瘤重要治疗手段和放射介入的支柱技术[1-2]。目前,基于高级别的循证学依据,TACE 已被多数肝癌的国际治疗指南列为不可切除的肝癌的一线治疗策略(表1)。正如著名肝病学家Lencioni[2]选择了“(进化evolution)”这个词来形容TACE 的产生和发展历程,我们也能从其历史的脉络预见其未来的发展方向。
1 TACE的产生和发展
TACE 的发展历程,可以简要概括为技术诞生和地位确立两个历史性阶段。上世纪中期,随着人们对化疗的应用和认识的深入,开始探索化疗药物的局部灌注。Chuang 等[9-10]率先开始研究明胶海绵等经动脉栓塞治疗肝肿瘤的可行性和疗效。1978年日本大阪市立大学Yamada等[11]开始尝试将碘化油经肝动脉注入治疗肝癌,并于1983 年首次报道了其对120 例肝癌患者采用TAE 治疗的临床结果,奠定了现在常规TACE 技术(conventional-TACE,cTACE)的基础。随后,cTACE技术被广泛应用于肿瘤治疗中。但是,在强调循证学依据的欧美医疗体系中,TACE的疗效一直存在争议。主要是TACE 疗效肯定的研究证据级别较低[12-13]。1995 年《新英格兰杂志》的报道[14]更是对TACE 的疗效提出了质疑。该研究通过随机对照研究认为TACE 虽能有效控制肿瘤生长,但对比支持治疗并不能明显延长患者生存期。该研究也发现影响TACE 整体疗效的重要原因就是急性肝功能衰竭的发生率较高。随着肝癌病情评价体系的完善和TACE 技术的成熟,极大地减少了对正常肝组织的损害,TACE的疗效和安全性在不断提高。2002年,Llovet[15]和Lo[16]的两项前瞻性随机对照研究结论确立了TACE 在肝癌治疗中的地位,证明与最佳支持治疗相比,TACE 治疗能明显延长不能手术根治肝癌的生存期。Lencioni 等[17]对101 篇关于TACE 论文中10 108 例肝癌患者的系统回顾分析显示,TACE 的客观有效率为52.5%,1、2、3、5 年生存率分别为70.3%、51.8%、40.4%、32.5%,中位生存期为19.4 个月,从而进一步明确了TACE 的疗效和安全性。回顾TACE 的发展归功于技术的不断改进和适应症的进一步明确,同时这也贯穿TACE 今后发展的两个主题。
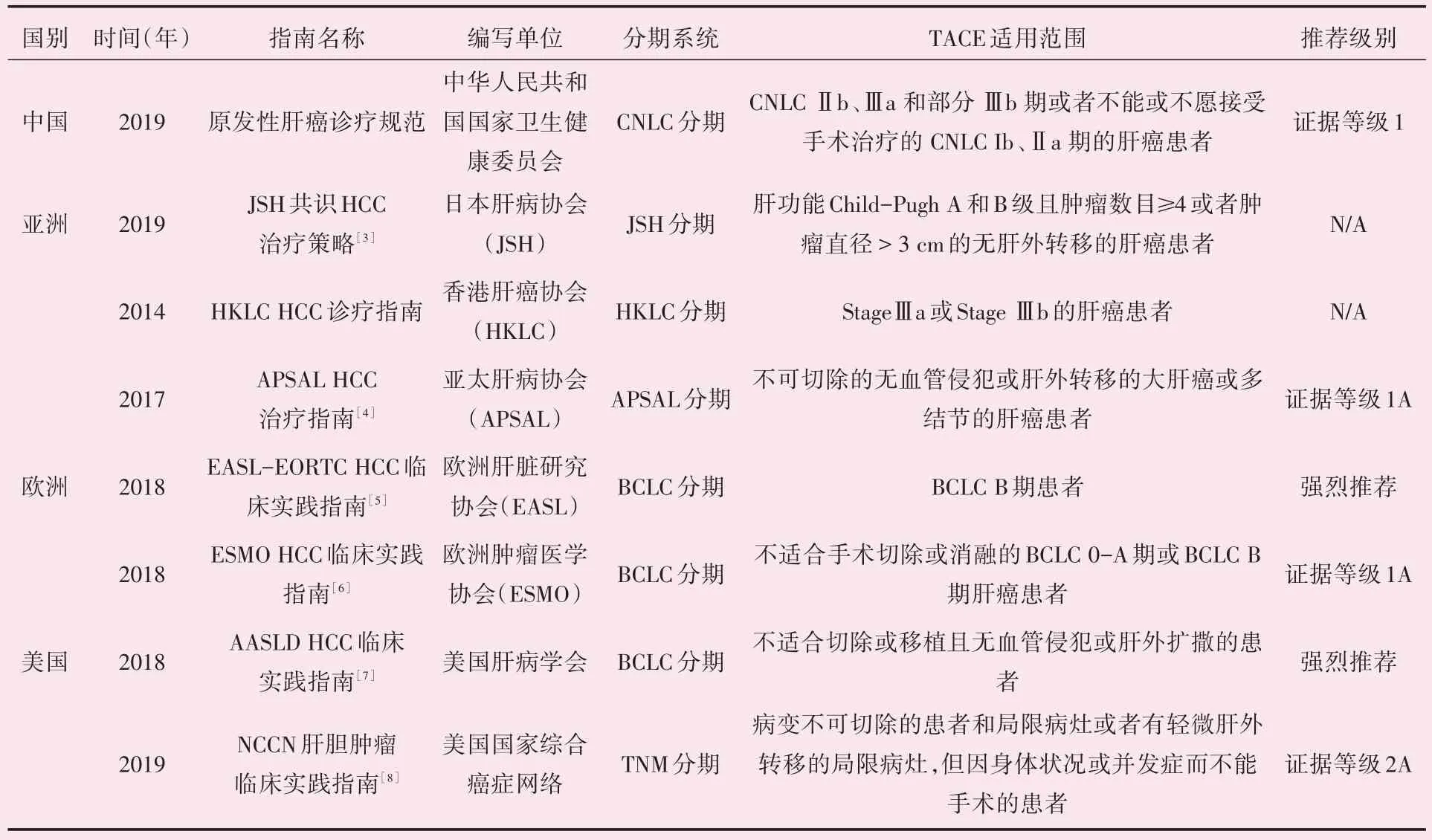
表1 全球范围内关于肝细胞肝癌临床诊疗指南中TACE 适用的范围Table 1 Scope of application of TACE in clinical guidelines for diagnosis and treatment of hepatocellular carcinoma worldwide
2 进入精准医学时代的TACE技术
正如前述,早期的TACE 技术没有统一的标准,各医疗中心之间差异很大。广义的TACE 技术涵盖了动脉灌注术、动脉栓塞术、单纯碘油栓塞术、碘油酒精乳化剂栓塞术、常规TACE 技术(cTACE)。近年来产生的DEB-TACE 技术(trans⁃arterial chemoembolization with drug eluting micro⁃spheres,DEB-TACE)也加入到这一行列。2012年,Lencioni 等[2]提出了DEB-TACE 规范化的建议。随之,2016 至2018 年,在肝病权威杂志Hepatology和介入医学权威杂志JVIR 和CVIR 上,又先后刊登数篇关于cTACE 的标准化和规范化建议[17-21]。这些建议和指引的刊发,起到了排沙简金、提要钩玄的作用,将焦点集中到cTACE 和DEB-TACE 两个重点技术上,开启了今天TACE的精准医学时代。
2.1 栓塞技术的提升和标准化探索
在技术方面最为突出的就是栓塞技术的精细化,在治疗肿瘤的同时,尽可能保护非肿瘤器官成为提升整体疗效的保证,而超选择插管是实现这一要求的基本手段。超选择插管技术是指将导管插管至肝癌的供血动脉内,尽可能避开正常肝段供血动脉[20]。
超选择插管技术的实现主要依赖两方面的进步,首先是微导管的广泛应用和导管设计的不断改进,其次是影像引导技术的提高。在微导管设计方面,微导管不仅具备了更好的可视性和可操控性,同时带有阻塞球囊以及带侧孔的微导管也被生产和应用到肿瘤的TACE 中。这些微导管极大地降低了返流性误栓的可能性同时也保障了肿瘤栓塞的充分性,提高了栓塞效率和安全性[20,22-23]。影像引导设备的提升为超选择插管提供了保障。目前angio-CT 和CBCT(cone beam CT)已成为TACE 治疗不可或缺的评价手段。Angio-CT 是将血管造影和CT 扫描同步进行,与普通CT 扫描相比能更加清晰地显示病灶供血动脉的关系。但是要进行angio-CT 必须将介入手术室和CT 扫描室融合成一体的复合手术室,对硬件要求比较高[24-25]。CBCT 是angio-CT 的实用替代版。CBCT 通过血管造影机(DSA 机)配备的旋转平板探测器系统实现CT 扫描的功能。虽然其清晰度不及angio-CT,但是简化了手术室配置的要求,提高了其可操作性。目前市面上销售的DSA 机均具备旋转平板探测功能,也就是说在所有TACE 操作中都进行CBCT 扫描是切实可行的[26]。由于肿瘤的供血动脉复杂多变,术前的CT 血管成像可以清晰勾画出靶肿瘤的供血动脉的3D 路径,这为TACE 时导管的选择靶血管提供路径,减少了超选择插管的透视时间。术中利用angio-CT 或CBCT 可以辅助判断插管的精准度和肿瘤栓塞的充分性。术后利用这些设备可以精确地判断是否残留肿瘤供血动脉,也为后期评价肿瘤疗效提供了依据[27]。
随着超选择插管技术的提升,对非肿瘤的肝组织的保护在不断提高,同时也给临床带来了另一方面的思考:既然超选择插管尽可能地保证栓塞不累及正常肝组织,那么对肿瘤的栓塞是不是越彻底越好?这就是我们关注的栓塞技术另一个问题-栓塞终点问题。上个世纪90 年代,日本专家[28]提出过水门汀(cement)栓塞的概念,也就是理想的栓塞效果应该事先碘油对肿瘤的小动脉、毛细血管以及经肿瘤引流静脉,包括门静脉和肝静脉都实现填充,达到“混凝土灌注”的效果。但实际操作中,由于肿瘤的异质性和碘油乳剂的物理特性,即使采用球囊辅助插管,这一要求也只能偶尔达到。所以,近年来临床评价栓塞终点的标准多采用肿瘤染色是否消失和顺向肿瘤的血流是否停止两项指标。韩国的研究[29-30]发现,如果按照这两项指标把栓塞程度定为4 级,从最终患者生存获益来看,2 级和3 级的栓塞反而比4 级的栓塞取得临床效果要更好。也就是说我们的栓塞终点应该定位在肿瘤顺向血流减慢而非消失,肿瘤染色力争消失的程度为最佳。随着DEB-TACE 的产生和发展,人们对栓塞终点和栓塞价值的认识也在不断更新,这方面的探索还在继续,本文将在展望中阐述。
2.2 从cTACE 到DEB-TACE
TACE 技术进步的另一方面是栓塞材料的不断改进。血管内栓塞材料至今经历了几次的交替更新,第一代的栓塞材料主要有明胶海绵颗粒,聚乙烯醇(polyvinyl alcohol,PVA)颗粒以及三丙烯酸明胶微球等,主要用于止血以及子宫肌瘤栓塞治疗,也可作为cTACE 治疗中化疗药物碘油乳化剂栓塞后的补充栓塞。第二代栓塞材料为碘油类栓塞材料,目前常用的是超液化碘油(Lipidol®)。Lipidol 是碘化的乙基罂粟籽油,含有37%~39%的碘,从而使其可以在透视下清晰地显影。在TACE中使用的通常是Lipidol 和阿霉素(doxorubicin)的混合乳剂(LIPDOX),这种乳剂进入血管后部分LIPDOX 分解成碘油和游离的阿霉素,其中阿霉素可以进入组织间液,最后被肿瘤细胞摄入。部分LIPDOX 可以溢出肿瘤血管,LIPDOX 在正常组织中可以被巨噬细胞吞噬分解,但是肿瘤内往往缺乏巨噬细胞,所以可以较长期地存留在肿瘤组织间液内,并缓慢释放阿霉素达到治疗肿瘤的目的。此外还有一小部分LIPDOX 在血管内分离出阿霉素后的碘油微粒在血流的冲刷下,会进一步变细,最终通过毛细血管进入静脉系统。所以,超液化碘油是否为严格意义上的栓塞剂仍然存在争议。有学者[31-32]认为LIPDOX 只能算是一种TACE中的化疗药物载体。而完整的TACE 必须在超选择插管的前提下,使用PVA 或明胶海绵颗粒栓塞材料进行补充栓塞。第三代的栓塞材料根据其能否负载化疗药物分为载药微球(drug-eluting Beads,DEB)和PVA 微球。PVA 微球不同于第一代的PVA 颗粒:PVA 颗粒是一种不规则的微粒,在血管里易聚集,从而影响栓塞效率。而微球呈圆球形,微球间摩擦系数低,聚集性低,从而可以保证栓塞到微球直径一致的血管层面[33]。
DEB 是最受关注的第三代栓塞材料,既具备PVA 微球的物理学特征,还具备了负载药物的能力。换句话说,DEB不但具备第一代栓塞材料阻断血流的作用,同时也具备第二代Lipidol运载药物的功能,是两者的结合和升级版本。之所以说它是升级版,在于它除了具备球形光滑,直径分布比较集中,聚集更低的特性,同时还在负载化疗药物剂量和控释方面都优于LIPDOX[34]。因此采用DEB为栓塞和化疗药物载体的TACE 技术又被称为DEB-TACE,用于和常规的TACE技术-conventional TACE(cTACE)相区别[17]。目前已经上市的DEB主要是采用类同于三代微球的材料,并在表面涂覆的一层磺酸盐基团来实现吸附药物的作用,由于磺酸盐基团是负电极性基团,所以它只能吸附带正电的化疗药物,其中最常用的就是阿霉素或表阿霉素,因此,DEB 和阿霉素配制的载药微球也被成为DEBDOX。一项药代动力学的研究[35]对比了cTACE 和DEB-TACE 的外周血药浓度变化趋势。研究显示,DEBDOX 整体载药不但比LIPDOX 更多(平均DEB-TACE:106 mgvs.cTACE:70 mg),而且其外周血液药浓度峰值明显较低(DEB-TACE:78.97 ng/mLvs.cTACE:895.66 ng/mL),7 d 内释放曲线下面积也明显低于cTACE(DEB-TACE:662.6 ng/mL·minvs.cTACE:1 532.98 ng/mL·min)。这说明DEB-TACE 会较慢地将化疗药物释放到外周血液中,而在一定时间内有更多的药物停留在栓塞的肿瘤内,这为DEB-TACE 全身毒副作用更低且治疗持续时间更久提供了理论依据。但是研究表明LIPDOX 可以溢出肿瘤血管,从而更加接近肿瘤细胞发挥作用,而DEBDOX 只能滞留在肿瘤血管内,无法进一步接近肿瘤细胞。阿霉素释放后能否有效弥散到肿瘤区域内达到控制肿瘤的有效浓度成为关键的问题。一项研究采用了移植术前的病例进行DEB-TACE 干预,在DEB-TACE 干预后9~36 d 进行移植手术,然后对切除标本进行分析,结果显示在围绕载药微球600 μm 范围内都可测得远高于最低检测浓度的阿霉素分布,随着时间的推移,虽然肿瘤间阿霉素浓度在下降,但是阿霉素肿瘤坏死的比率逐步递增[36]。除了这些体内的实验研究外,大量的关于载药微球颗粒理化性质的研究也在进行,包括各种材质的压缩性、直径分布的均一性、在造影剂中的悬浮性、通过微导管投放的顺畅以及影像学下的可视性等[37-39]。
虽然DEBDOX 在基础理化数据上比LIPDOX丰富且优越,但临床疗效更加重要。在DEB-TACE的早期临床研究显示:治疗相关并发症发生率为11.4%,无相关的死亡。根据实体瘤反应评估标准(RECIST),TACE 的部分反应率(PR)为50%,完全反应率(CR)为0%。根据综合肿瘤坏死的程度的修正实体瘤反应评估标准(mRECIST),PR为63%,CR 为6.7%[40]。另一项开放标签的研究[41]显示:根据欧洲肝病协会(EASL)标准在3 次治疗后评价客观反应率分别为:59.6%、81.8%及70.8%,在第9个月可以CR达12.2%。2010年,Lammer 等[42]发表至今最为权威的关于DEB-TACEvs.cTACE的随机对照研究(PRECISION V),表明DEB-TACE 组完全缓解、客观缓解和疾病控制率都优于cTACE分别为44%,63%vs.52%vs.27%vs.22%,52%。但基于研究设计的优势假设并不满足(one-side,P=0.11)。与cTACE相比,Child-Pugh B、ECOG=1、病变累及双叶和复发性疾病患者的客观反应显著增加(P=0.038)。DEBDOX 使治疗耐受性明显改善、严重肝毒性显著降低、阿霉素相关的副作用显著降低(P=0.0001)。说明DEB-TACE 治疗HCC安全有效,尤其对特定晚期HCC患者较cTACE有优势。中山大学2014年将包括PRECISION V研究在内的7项研究700例病例纳入meta 分析[43]后显示,与cTACE 相比,DEB-TACE 的客观肿瘤反应明显更好(OR=1.92,95%CI[1.34,2.77];P=0.0004),相对危险度差为0.15[0.07,0.24](P=0.0003)。DEB-TACE 的1 年和2 年生存率明显高于cTACE(peto OR,95% CI:0.64[0.46,0.89],P=0.007 和0.61[0.47,0.80],P=0.0003)。6 个月和3 年生存期Peto OR 分别为0.72[0.46,1.14](P=0.16)和0.77[0.55,1.06](P=0.11),差异无统计学意义,但有一定倾向于DEB-TACE 的趋势。
当然,在新型DEB 材料应用的同时,cTACE 技术也没有停滞不前。尤其在LIPDOX 的制备方面,也进行了相应的研究,为制备更好的LIPDOX和更有效cTACE 提供理论依据。既往LIPDOX 有两种制备方式:水包油(水溶性的药物包含碘油油滴)和油包水(碘化油油滴包含水溶性的药物)。研究表明:油包水比水包油更容易在肿瘤内部致密沉积,从而发挥更佳的栓塞效果[17,44-45]。为了得到良好的油包水乳剂,碘油与水溶液的体积比建议为2~3∶1。混合时,应该使用三通连接器连接注射器,先将化疗药物溶液注入碘油中,再以每秒1~2 次的速度在两个注射器内反复推抽混合10~20 次,从而可以达到很好油包水颗粒以及理想的粘滞度[46]。近期的研究表明,3∶1 的油水比例,20 mg/mL的药物浓度以及持续缓慢的推注方式能更好的实现油包水颗粒的稳定性[47]。使用非离子型造影剂溶解药物制备阿霉素溶液,可增加药物溶解度,从而提高药物/碘化油乳剂的稳定性[48]。
DEB-TACE 和cTACE 都在进步,那么两者间如何选择呢?我们知道,患者的治疗获益其实就来源于尽可能地提高肿瘤的治疗反应的同时尽可能地降低治疗的毒副反应,具体到TACE 治疗HCC,那就是肝功能损害的控制[49]。基于前述的研究,安全性成为放弃cTACE 考虑的最首要考虑的因素。因此,患者术前的肝功能就是预测安全性和DEB-TACE 必要性的依据。目前评价HCC患者肝功能最常用的指标主要有Child-Pugh 评分系统和MELD 评分系统。研究发现虽然Child-Pugh 评分有最大值限制,但是它与cTACE 预后的相关性更明确,并且Child-Pigh 评分大于7 分的患者预后明显较差[50-51],所以Child-Pugh 评分在7 分以上的患者应该考虑放弃cTACE。而鉴于DEBTACE 对肝功能影响更小,DEB-TACE 可放宽到8 分的HCC 患者。除了肝功能以外,是否还有其他因素使我们会更加倾向选择DEB-TACE 呢?PRECISION V的研究也提示多叶病变中DEB-TACE存在优势。根据这些线索,Kudo 又根据BCLC B期的Bolondi′s subclassification 提出了进一步的修改建议,被称为京畿道标准(Kinki Criteria)。这一标准明确限制cTACE 适用于直径3~6cm 内肿瘤且肿瘤结节不超过6 个的病变,对于超过上述范围,未达7 个结节的病例可考虑DEB-TACE,超出7 个结节就应该考虑靶向药物和HAIC 治疗,这一标准也被称为TACE 的up-to-7 标准(图1)[52]。
3 多学科全程管理模式下的肝癌TACE治疗
得益于于严格的肝癌高风险人群医疗监控措施的普及,按照传统分期,极早期和早期病例的比例在不断增加,这些都是传统意义上的可手术根治的病例数。但另一方面,随着新治疗手段的发展和运用,他们又在整体疗效等综合数据上不断挑战手术的地位。因此传统的以手术为核心的肝癌治疗体系被逐步改变。TACE 在挑战外科手术的地位同时又受到来自靶向药物和免疫治疗的挑战。既往,巴塞罗那肝癌临床分期(BCLC)是HCC治疗的基石之一。随着治疗的进步,传统的基于BCLC 阶段的疗法界限已经模糊。由于肝癌存在很大异质性,同一分期的肿瘤采用同一治疗方案未必就能得到同样的获益,因此个性化治疗方案被提出和重视。肝癌的全程管理也要求从治疗开始到结束对治疗方案进行不断优选、淘汰、引入、联合和转换。此外,每个学科在肝癌方面的治疗技术都在不断精进,如外科有术中3D 荧光成像,机器人辅助技术以及ALPPS 技术等,内科的免疫治疗和生物治疗方兴未艾。随着各个学科深度的提升,跨学科认知度会相应降低,这就需要多学科共同组建成一个团队来完成肝癌的全程管理,也就是肿瘤最现代的治疗模式-多学科管理模式(multidisciplinary team,MDT)。在MDT 模式下TACE 技术的作用也发生了相应的一些变化。

图1 中晚期HCC(B1、B2 亚期)的异质性及治疗策略[52]Fig.1 Heterogeneity and treatment strategy of advanced HCC(B1,B2)
3.1 术前的桥接治疗和降级治疗
肝移植是肝癌外科根治治疗的重要手段。研究显示,肝癌患者肝移植只有在符合米兰标准(单个结节<5 cm 或3 个结节<3 cm)才能达到明显的生存获益,其5 年生存率可达60%~70%[53]。但是,供体短缺造成的等待时间延长导致每年30%~40%的肝移植患者在等候移植期因为肿瘤进展而失去移植的指征(脱落)。因此,移植前对肝癌患者进行局部区域治疗以降低肿瘤负荷并延缓肿瘤进展在大多数中心已经成为标准方法[54-56]。2003年至2004年美国器官获取与移植网络的数据显示,原发性肝癌伴有肝硬化的患者3、6 及12个月脱落率分别为8.7%、16.9%和31.8%[54]。而在另一项回顾性分析中,2001 年至2011 年之间因肝癌首次登记等待肝移植的患者,36 名患者在等待期接受RFA+TACE 的桥接治疗,结果显示,患者3、6 及12个月脱落率分别为0%、2.8%和5.5%[55]。也就是说TACE 可以使计划肝移植的早期肝癌患者在1年等候期的脱落率降低超过80%。
3.2 TACE 作为肝癌切除术后的辅助治疗的价值
在部分结肠癌和乳腺癌患者,外科手术后进行辅助治疗被证实有效[57]。而在肝癌切除后是否需要进行类似的辅助治疗目前尚未有明确结论[5]。meta 分析[58]显示术后TACE 安全有效,可以提高整体生存率和无病生存率,对MVI 阳性患者的益处最大。目前的证据支持辅助TACE 用于无PVTT的患者、未累及主干的PVTT 患者、切除缘< 1 cm的患者以及伴卫星结节的患者。
4 TACE治疗技术的展望
随着肿瘤治疗理念的不断更新,人们对疾病和治疗手段的认识也在不断加深,而两者之间又相互促进和相互制约。其中,肝癌和TACE 治疗技术就是最典型的例子。随着人们对肝癌生物学行为的认识加深,肝癌的治疗模式由最开始的外科单一治疗发展到以TACE 为枢纽的整体治疗模式。同时,TACE 的联合治疗(包括消融、靶向药物及免疫治疗)可能使肝癌患者获得更大福音。
