重型β-地中海贫血患者青春发育状况及影响因素
2020-12-04江转南张丽娜侯乐乐刘祖霖黄思琪梁立阳
江转南 ,张丽娜,孟 哲,欧 辉,侯乐乐,刘祖霖,黄思琪,梁立阳
(1.中山大学孙逸仙纪念医院儿科,广东广州 510120;2.东莞市妇幼保健院儿童保健科,广东东莞 523000)
重型β-地中海贫血(β-thalassemia major,β-TM)患者随着年龄的增长会发生各种内分泌并发症,如身材矮小、糖代谢异常及青春发育异常等,严重影响其远期生存质量[1-4]。其中,青春发育异常是β-TM 最常见的内分泌并发症[5],然而我国在这方面的研究甚少。本文通过对中山大学孙逸仙纪念医院长期随访的年龄≥10 岁的β-TM 患者进行青春发育状况的调查研究,总结β-TM 患者青春发育异常的临床特点,分析影响因素并探讨可其能的发病机制。
1 材料与方法
1.1 研究对象
选取2018 年1 月至2019 年4 月在我院地中海贫血专科确诊并长期随访的,年龄≥10 岁且自愿接受本研究的β-TM 患者作为研究对象。排除标准包括:①非输血依赖性地中海贫血;②合并其他性发育异常性疾病;③已接受造血干细胞移植治疗者;④染色体核型异常者;⑤曾经接受或正在接受性激素替代治疗者。本研究经医院医学伦理委员会批准,所有受试患者监护人均知情同意并签署知情同意书。
1.2 研究方法
通过查阅REDCAP系统的随访记录(即地贫随访数据库)、问卷调查(问卷内容包括:一般人口学资料、青春发育史、家族性青春发育异常史、地贫确诊及治疗情况等)、体格检查(身高、体质量及第二性征Tanner分期[6])和实验室检测获取研究数据。
1.2.1 实验室检测指标 所有患者在输血后2 周检测。有月经来潮的女性,在月经周期第3~5天抽血。禁食12 h 后在次日上午8:00~9:00 采集空腹静脉血样送检。检测指标包括:黄体生成素(LH)、卵泡刺激素(FSH)、睾酮(T)、催乳素(PRL)、维生素D3、血清铁蛋白(SF)、糖化血红蛋白(HbA1c)、果糖胺(GSP)、糖化白蛋白(G-AL)、胰岛素(INS)、葡萄糖(GLU)。
1.2.2 青春发育异常的诊断标准 青春发育延迟:女性年龄≥13岁无乳房发育或男性年龄≥14岁睾丸体积<4 mL[7]。青春发育停滞:女孩青春期的最初体征和月经初潮年龄之间>4 年,或男孩生殖器开始发育至完全发育成熟的时间>4年[7]。小阴茎:指具有正常的内部和外部男性生殖器的情况下,阴茎伸展长度低于相同年龄或相同性发育状态人群平均值2.5个标准差以上者[8]。原发性闭经:已达16岁尚无月经来潮,不论其第二性征发育是否正常者[9]。
1.2.3 铁过载诊断标准 常用的铁过载指标分别为血清铁蛋白、肝MRT2*和心MRT2*,按诊断标准科[10-11]可分为轻度、中度和重度。血清铁蛋白铁过载:1 000 ng/mL < SF < 2 000 ng/mL 为轻度,2 000 ng/mL ≤SF ≤4 000 ng/mL 为中度,SF >4 000 ng/mL 为重度[10]。肝铁过载:肝脏MRT2*<6.3 ms即为肝铁过载,2.7 ms<肝脏MRT2*<6.3 ms为轻度,1.4 ms<肝MRT2*<2.7ms为中度,肝MRT2*<1.4 ms 为重度[11]。心铁过载:心脏MRT2*< 20 ms即为心铁过载,14 ms<心MRT2*<20 ms 为轻度,10 ms < 心MRT2* < 14 ms 为中度,心MRT2* <10 ms 为重度[11]。
1.3 统计方法
采用SPSS 25.0软件进行统计分析。服从正态分布的计量资料采用均数±标准差描述,非正态分布的计量资料采用中位数和四分位数间距描述,计数资料采用频率描述。两组计量资料的比较若服从正态分布采用两独立样本t检验,配对设计的计量资料采用配对t检验,若不服从正态分布采用秩和检验。两组计数资料的比较采用卡方检验或Fisher 精确法。相关分析中,服从正态分布的两变量采用Pearson 相关分析法,不服从正态分布者采用Spearman 秩相关分析。多个自变量与因变量之间的关系用Logistic 回归分析。所有统计检验均采用双侧检验,P<0.05 为差异有统计学意义。
2 结果
2.1 β-TM 患者的临床概况
2.1.1 基本情况 共42 例β-TM 患者入选本次研究,年龄范围10.9~30.3 岁,中位数16.4 岁,男性24 例,女性18 例,其中11 例已行脾切除术。36 例β-TM 患者提供了基因报告,其中28 例为β0β0基因型,占77.14%,8 例为非β0β0基因型,占22.86%。起始输血年龄0.2~6.0 岁,中位数为0.6 岁。输血频率以15~21 d/次最常见,占59.52%(25 例),其次是22~28 d/次,占23.81%(10 例),8~14 d/次和> 28 d/次分别占11.90%(5 例)和4.26%(2 例)。输血前Hb 水平长期维持在90 g/L 以上者仅4 例,维持在80~90 g/L 者最常见,共22 例,占52.33%(表1)。42例患者均长期祛铁治疗,起始祛铁年龄均数为(7.4±3.9)岁,范围在1.8~15.0 岁。
2.1.2 铁过载情况 42 例β-TM 患者SF 范围在286.70~8 354.00 ng/mL。其中,轻度铁过载6 例(14.29%),中度铁过载13 例(30.95%),重度铁过载18例(42.86%)。30例β-TM患者进行了肝脏和心脏MR T2*检测。心MRT2*范围在4.00~51.15 ms,其中轻度1例(3.33%),中度3例(10.00%),重度8例(26.67%)。肝MRT2*值范围在0.99~22.14 ms,其中轻度6 例(20.00%),中度13 例(43.33%),重度7 例(23.33%)。
2.2 β-TM 患者青春发育状况
2.2.1 β-TM 患者正常青春发育情况 42例β-TM患者中有正常青春发育进程者18例,占42.86%,其中男性11 例,女性7 例。7 例女性β-TM 患者的年龄范围在11.9~22.9 岁,其乳房开始发育年龄在10.0~13.0岁,乳房发育进程正常。其中,5例年龄>14.0 岁的患者均有月经来潮,初潮年龄为12.0~16.0 岁,月经周期尚规律。另外,11 例男性β-TM患者的年龄范围在11.1~19.7岁,外生殖器开始发育年龄在10.0~13.0岁,睾丸体积≥15 mL者3例,已有变声者2例,但遗精、阴茎勃起情况均未提供。
2.2.2 β-TM 患者青春发育异常情况 42例β-TM患者中有24 例(57.14%)出现青春发育异常,其中男性13 例,女性11 例。13 例男性年龄范围10.9~26.1 岁,所有患者阴茎均短小,年龄> 14.0 岁睾丸体积仍< 4 mL 7 例,青春发育停滞2 例。11 例女性年龄范围14.3~30.3 岁,年龄在14.0~16.0 岁乳房未发育2 例,年龄在16.0 岁以上乳房未发育同时伴有原发性闭经4 例,有乳房发育但有原发性闭经4 例,青春发育停滞1 例。
2.2.3 青春发育正常组与青春发育异常组性激素水平的比较 男性青春发育异常组的睾酮(testo⁃sterone,T)水平显著低于对照组,差异有统计学意义。其黄体生成素(luteinizing hormone,LH)和卵泡刺激素(follicule-stimulating hormone,FSH)水平亦呈降低趋势,但无统计学差异。女性青春发育异常组的LH 和FSH 水平明显低于对照组,差异有统计学意义,提示青春发育异常组呈现低促性腺激素性性腺功能减退状态。由于雌二醇(estradiol,E2)测量具有不稳定性,本研究未对两组的E2 水平进行比较(表2、3)。
表1 β-TM 患者的输血情况Table 1 Blood transfusion records of β-TM patients [n(%),M(P25~P75),]
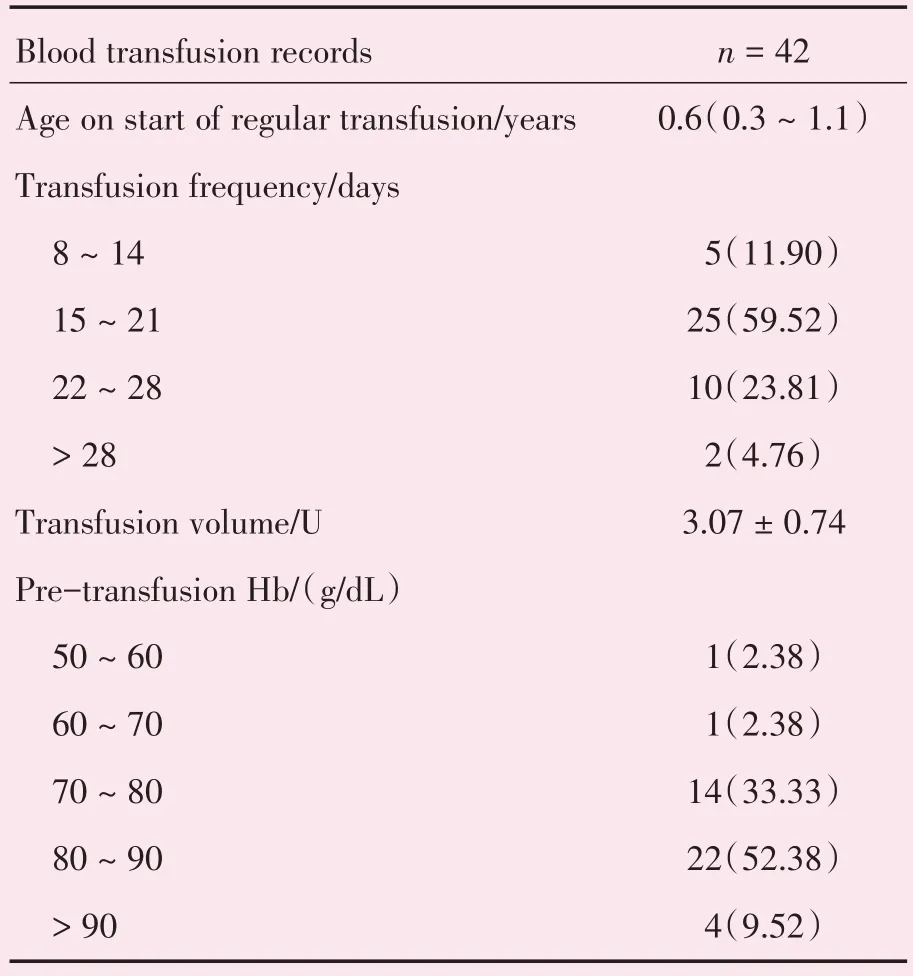
表1 β-TM 患者的输血情况Table 1 Blood transfusion records of β-TM patients [n(%),M(P25~P75),]
2.3 β-TM 患者青春发育的影响因素
2.3.1 人口学特征及治疗情况 对β-TM 患者青春发育的影响与对照组相比,青春发育异常组的年龄相对大,身高相对矮,体质量相对低,但差异未见统计学意义。两组起始输血年龄、输血周期、输血前血红蛋白水平及体质指数(body mass index,BMI)亦无统计学差异。但青春发育异常组起始祛铁年龄更晚,差异有统计学意义(t=-2.354,P=0.024)。脾切除组的青春发育异常患病率较对照组显著升高,差异有统计学意义(χ2=5.196,P=0.023;表4)。
2.3.2 铁过载 对β-TM 患者青春发育的影响青春发育异常组心T2*为(16.84 ± 12.69)ms,显著低于青春发育正常组(31.13 ± 11.73)ms,两组差异有统计学意义(t=3.119,P=0.004)。根据是否存在心铁含量异常分为心脏T2* < 20 ms 组及心T2*≥20 ms 组,心T2*<20 ms 组的青春发育异常患病率显著高于对照组(χ2=9.344,P=0.002),提示心铁含量异常是β-TM 患者青春发育异常的重要影响因素。两组肝T2*和SF 水平的差异无统计学意义(P=0.119,0.075)。
表2 两组男性β-TM 患者性激素水平的比较Table 2 Comparison of sex hormone levels between two groups of male β-TM patients [M(P25~P75),]

表2 两组男性β-TM 患者性激素水平的比较Table 2 Comparison of sex hormone levels between two groups of male β-TM patients [M(P25~P75),]
PRL:prolactin;T:testosterone;FSH:follicule-stimulating hormone;LH:luteinizing hormone
表3 两组女性β-TM 患者性激素水平的比较Table 3 Comparison of sex hormone levels between two groups of female β-TM patients [M(P25~P75),]

表3 两组女性β-TM 患者性激素水平的比较Table 3 Comparison of sex hormone levels between two groups of female β-TM patients [M(P25~P75),]
PRL:prolactin;T:testosterone;FSH:follicule-stimulating hormone;LH:luteinizing hormone
表4 青春发育正常组与青春发育异常组人口学特征及治疗情况的比较Table 4 Comparison of demographic characteristics and treatment between normal puberty development group and abnormal puberty development group [n(%),M(P25~P75),]
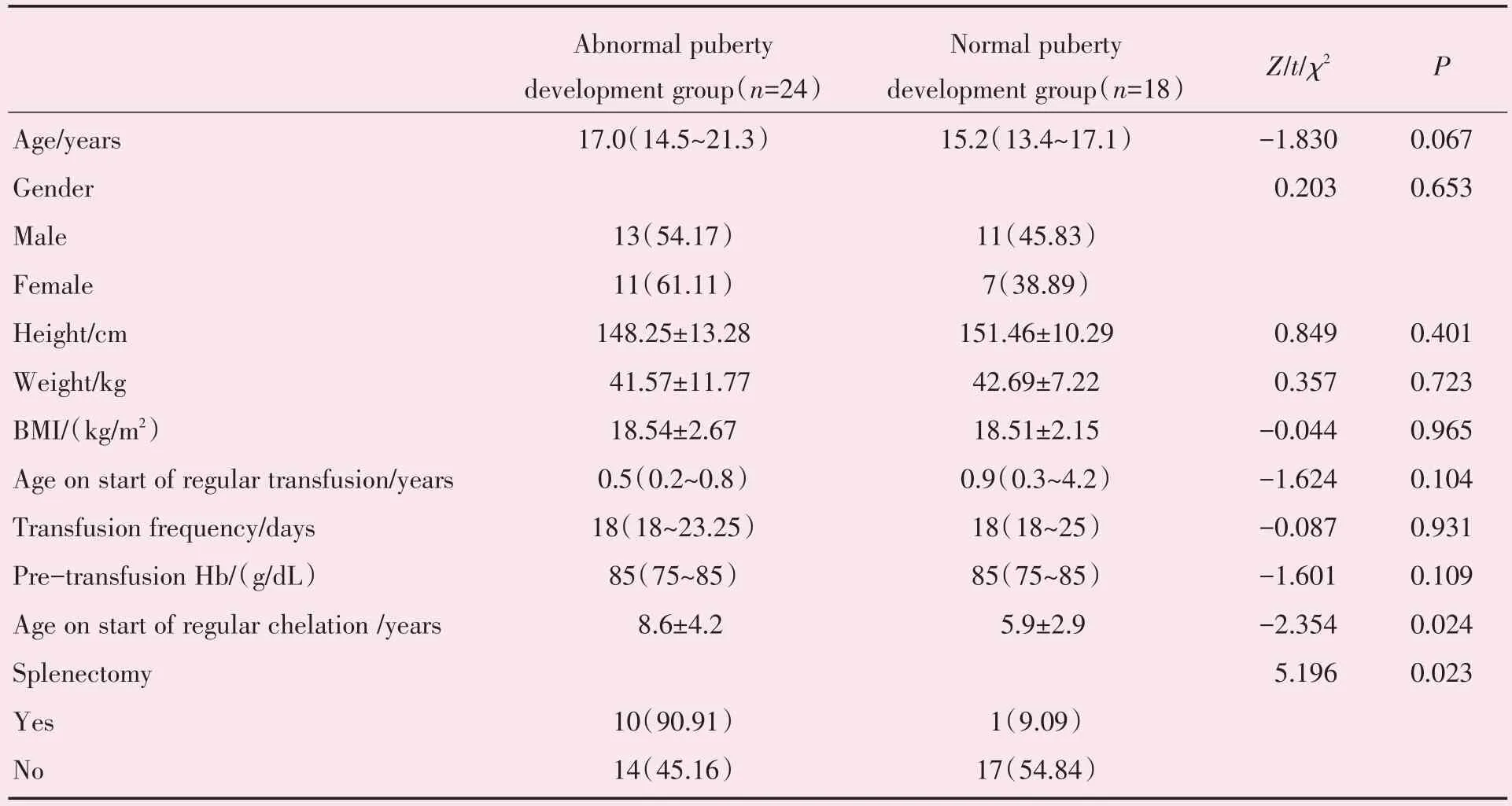
表4 青春发育正常组与青春发育异常组人口学特征及治疗情况的比较Table 4 Comparison of demographic characteristics and treatment between normal puberty development group and abnormal puberty development group [n(%),M(P25~P75),]
2.3.3 其他内分泌并发症 与β-TM 患者青春发育状态的关系合并糖尿病的β-TM 患者青春发育异常的患病率显著高于无糖尿病的β-TM 患者,差异有统计学意义(χ2=4.714,P=0.030)。与对照组相比,青春发育异常组的糖化血红蛋白、糖化白蛋白和果糖胺均显著升高,差异有统计学意义(t=-2.270,-3.580,-2.121,P=0.031,0.002,0.042)。另外,维生素D 缺乏的β-TM 患者青春发育异常患病率比对照组显著升高,有统计学意义(χ2=5.567,P=0.018)。
2.3.4 基因型对β-TM患者青春发育的影响 36例患者按基因型分为β0β0基因组和非β0β0基因组,β0β0基因组青春发育异常患病率显著升高,差异有统计学意义(χ2=3.966,P=0.046)。另外,比较β0β0基因组和非β0β0基因组的治疗情况及铁过载指标可知,相对非β0β0基因组而言,β0β0基因组起始输血年龄更早,输血周期更短,心脏铁沉积更严重,且差异均有统计学意义(P=0.002,0.007,0.025;表5、6)。
2.3.5 铁过载指标与β-TM 患者性激素水平的相关性分析 将各项铁过载指标与各项性激素进行相关性分析,发现SF 与FSH、LH 及PRL 呈负相关,心MRT2*和肝脏MRT2*与FSH、LH 呈正相关,表明体内铁沉积越严重,FSH、LH 水平越低,提示铁过载可能通过损伤垂体导致LH 和FSH 合成或分泌减少,从而影响正常青春发育(表7)。

表5 β0β0 基因组与非β0β0 基因组的青春发育异常患病率情况的比较Table 5 Comparison of the prevalence of abnormal puberty development between β0β0 group and non-β0β0 group [n(%)]
表6 β0β0 基因组与非β0β0 基因组的治疗情况和铁过载情况的比较Table 6 Comparison of treatment and iron overload status between β0β0 group and non-β0β0 group [M(P25~P75),]
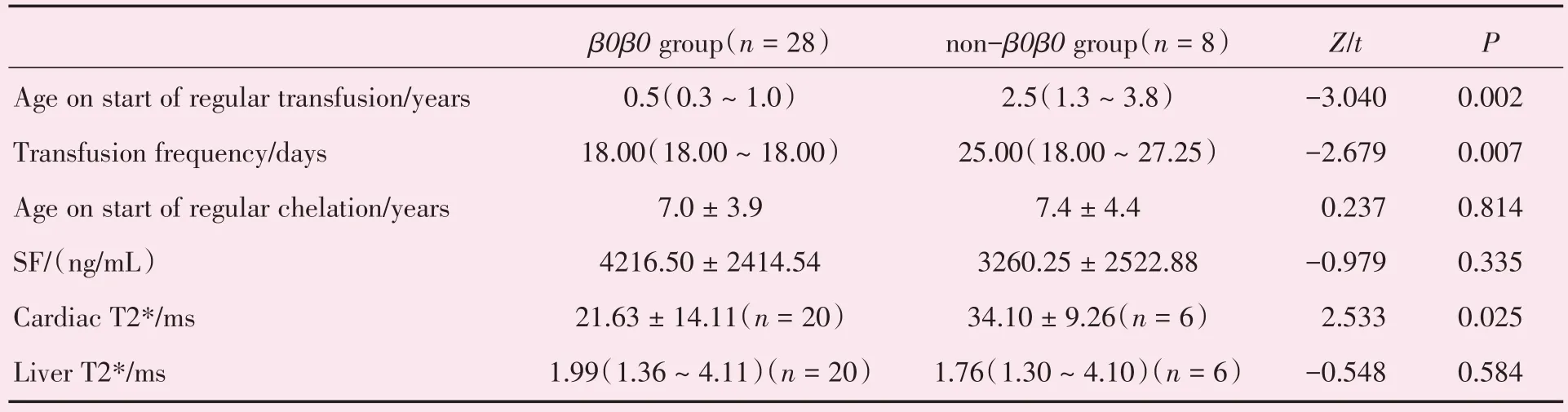
表6 β0β0 基因组与非β0β0 基因组的治疗情况和铁过载情况的比较Table 6 Comparison of treatment and iron overload status between β0β0 group and non-β0β0 group [M(P25~P75),]
SF:serum ferritin

表7 铁过载指标与性激素的相关关系Table 7 Correlation between iron overload index and sex hormones
2.3.6 β-TM 患者青春发育的多因素Logistic 回归分析 以是否发生青春发育异常为应变量,以年龄、起始祛铁年龄、SF、心脏T2*(作为分类变量:0 表示心脏MRT2* ≥20 ms,1 表示心脏MRT2* <20 ms)、基因型、脾切除史等与β-TM 患者青春发育异常密切相关的6 个因素为自变量,进行Logistic回归分析。最后,仅心脏MRT2*纳入方程,得LogitP=-0.875+2.955×X心脏T2*,且心脏MRT2*<20 ms 是独立危险因素(表8)。
3 讨论
3.1 β-TM 患者青春发育异常的特点
青春发育异常是β-TM 患者最常见的内分泌并发症之一,既往国内外文献报道的发生率在38%~63%[12-14]。目前国内缺乏针对β-TM 患者青春发育异常情况的大样本青春期至成年期的研究报道。本研究中42 例β-TM 患者年龄均> 10 岁,涵盖了青春期及成年期β-TM 患者的青春发育状况,其青春发育异常率为57.14%,本研究还发现女性乳房不发育及原发性闭经、男性睾丸不增大及阴茎短小是β-TM 患者青春发育异常的主要临床特点。
3.2 β-TM 患者青春发育异常的影响因素
3.2.1 祛铁治疗年龄及脾切除 一项研究发现10岁前启动祛铁治疗的β-TM 患者青春发育异常明显低于对照组[15]。但也有研究认为两者不存在相关性[16]。本研究中青春发育异常组的起始祛铁年龄显著晚于对照组,提示尽早启动祛铁治疗对β-TM患者青春发育具有保护作用。另外,脾切除术后的β-TM 患者体内过量的非转铁蛋白结合铁清除障碍,导致肝、心、垂体等铁沉积加重[17-18],更易出现内分泌并发症。本研究亦发现脾切除后患者青春发育异常患病率升高。因此,脾切除术后的β-TM 患者应该更注重铁过载指标的监测,加强祛铁治疗,避免影响青春发育。
3.2.2 铁过载 SF 是β-TM 患者青春发育异常的重要影响因素之一[7,13,19-20]。在本研究中,青春发育异常组SF 水平明显高于青春发育正常组,但由于受样本量及近期除铁治疗对SF 的影响等因素干扰,差异未达到统计学意义标准。β-TM患者内分泌并发症的发生与脏器铁沉积,特别是心肌铁沉积密切相关[21-22]。由于铁负荷动力学的差异,心肌发生铁过载的时间晚于垂体及肝,心铁沉积更能反映出全身铁过载的严重程度及持续时间[23]。本研究者所在团队之前研究发现心T2*是β-TM 患者发生糖代谢异常的独立危险因素[5]。本次研究亦发现心T2*也是β-TM 青春发育异常的独立危险因素。
3.2.3 其他内分泌并发症 在本研究中,合并糖尿病的β-TM 患者青春发育异常的患病率明显高于无糖尿病的β-TM 患者,且青春发育异常组的β-TM 患者长期处于高糖状态下。在高血糖状态下,肿瘤坏死因子、白介素-1、C-反应蛋白等炎症因子明显升高且抑制下丘脑促性腺激素释放激素及垂体LH 的分泌[24-25]。另外,维生素D 缺乏与性腺功能减退有一定相关性[26-27]。维生素D3受体及其代谢酶广泛分布于生殖系统内。维生素D 缺乏的β-TM 患者青春发育异常的发生率明显升高。
3.2.4 基因型 β-TM 患者的内分泌并发症与基因型存在显著相关性[28-29]。有研究发现β0β0基因型患者起始输血和祛铁治疗年龄更小,输血周期更短,祛铁药物使用率更高,且铁过载更严重[29],肝炎、生长迟缓等并发症的发生率也升高。本研究中β0β0基因型患者起始输血年龄早,输血周期短,心铁沉积更严重,青春发育异常率亦明显高于非β0β0基因型。因此,临床工作中对β0β0基因型患者应更加重视规范治疗及青春发育监测。

表8 β-TM 患者青春发育异常的多因素Logistic 回归方程Table 8 Multi-factor Logistic regression analysis of β-TM patients with abnormal puberty development
3.2.5 β-TM 患者青春发育异常的可能机制 垂体前叶铁沉积可导致腺垂体脱颗粒化,LH、FSH合成或分泌减少,引起低促性腺激素性性腺功能减退症,是β-TM 患者青春发育异常的重要机制[23]。由于垂体MR T2*的技术尚未广泛开展,有关垂体MR T2*研究数据较少。有学者认为垂体铁沉积先于心脏铁沉积,如Noetzli[23]等曾报道垂体R2*与心R2*呈曲线关系(r=0.49),当心R2* >50 Hz 时提示垂体已经出现严重铁沉积。因此,心肌铁沉积程度可作为垂体铁沉积程度替代指标。本研究中发现SF 与PRL、FSH 及LH 呈负相关,心MRT2*和肝MRT2*均与FSH、LH 呈正相关,提示铁过载可能损伤垂体,从而导致PRL、LH 和FSH 的合成或分泌减少,支持铁过载易导致β-TM患者发生低促性腺激素性性腺功能减退症这一观点。
总之,β-TM 患者青春发育异常发生率高,以女性原发性闭经或男性小阴茎、小睾丸较常见。其中β0β0基因型、脾切除后、维生素D 缺乏或者伴有糖尿病的β-TM 患者更容易发生青春发育异常,心肌铁沉积是β-TM 患者青春发育异常的独立危险因素。初步推测铁过载导致β-TM 患者发生低促性腺激素性腺功能减退症可能是其青春发育异常的主要发病机制,有待进一步探究。
