N-硝基吡唑合成过程中的热安全性
2020-12-04闫宇民陈丽珍王建龙
闫宇民,陈丽珍,王建龙
(中北大学化学工程与技术学院,太原 030051)
硝基吡唑类化合物在医药、农药、光敏材料和精细化工等方面广泛应用,其具有耐氧化、耐热、耐水解等显著的特点[1-2]。近年来,硝基吡唑类化合物因其具有钝感、生成焓高、热稳定性好等特点在含能材料领域受到更多的关注。
N-硝基吡唑是硝基吡唑类化合物中最简单的一种,是合成一系列硝基吡唑及其衍生类化合物的重要中间产物[3]。目前,已报道的合成方法中N-硝基吡唑常用硝酸、乙酸酐硝化体系硝化制得[4-6]。
硝化反应是合成含能材料化合物常用且重要的化学反应,其反应本身放热量大,危险性高。其中危险性主要表现为反应失控,即冷却能力不足导致反应温度升高,最终发展为反应失控,发生冒料甚至爆炸等危险事故[7]。20世纪六七十年代,外国研究者就开始对化工反应过程的危险性进行系统深入的研究[8]。中国对反应过程的热危险性研究开展较晚。王晓峰等[9]研究了甲苯一段硝化的过程安全性,得到最佳工艺;周诚等[10]研究了FOX-7合成过程中硝化反应的热危险性,发现其硝化过程热量释放主要受加料控制,且加料时间对产品纯度、产品收率基本无影响;高宇鹏等[11]研究了硝酸直接硝解乌洛托品的反应过程,确定热危险严重度及最佳工艺。
近年来,中国对化工过程安全越来越重视,人们的安全意识也日益提高[12],目前对N-硝基吡唑的合成工艺报道较多,而合成过程中的热安全性研究还未见报道。因此采用反应量热仪(EaysmaxHFCal)对硝化反应过程反应热进行测定,采用绝热加速量热仪(accelerating rate calorimeter,ARC)对硝化反应液的热稳定性进行测定,并对其整个反应过程进行反应评估,以期为合成工艺安全提供基础数据。
1 实验
1.1 试剂与仪器
试剂:硝酸(质量分数98%)、乙酸酐、吡唑,以上均为分析纯,天津化学试剂公司;去离子水,实验室自制。
仪器:反应量热仪(EaysmaxHFCal),Mettlle-Toledo公司;绝热加速量热仪(ARC),英国THT公司。
1.2 EaysmaxHFCal实验过程
实验采用半间歇等温控温模式,首先将16 g吡唑溶于40 mL乙酸酐后加入反应器作为反应底液。校准后加入13 mL硝酸,升温反应30 min,降温再次校准后实验结束。
1.3 ARC实验过程
对1.2实验后的硝化反应液进行ARC测试,测试所用小球为钛合金小球,其质量为8.570 g,比热为0.523 J/(g·K),ARC测试范围为30~350 ℃,升温台阶3 ℃,灵敏度为0.01 ℃/min。反应液质量为1.225 8 g,比热容为2.26 J/(g·K)。
2 结果与分析
2.1 硝化实验过程的热危险性分析
吡唑硝化生成N-硝基吡唑的合成路线为
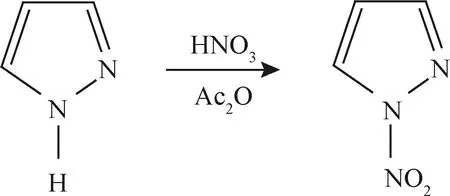
(1)
EaysmaxHFCal测定吡唑硝化反应过程热释放曲线如图1所示,其中加料过程的热释放曲线如图2所示。

图2 加料过程放热速率曲线Fig.2 Heat flow curve of charging process
加料方式采用手动间歇加料,加料间隔时间为30 s,每次加料为0.2 mL。加料阶段的总温升为6.47 ℃,最大温升为9 ℃,平均放热速率为 6.72 W,瞬间最高峰可达到98.95 W。
加料过程反应热释放速率曲线呈锯齿状,其属于典型的加料控制型,硝酸加入后热量迅速释放,形成一个放热峰,随反应的进行热量释放降低,此时再次加入硝酸,又会形成一个新的放热峰,前期的放热速率随着加料进行一直在平均速率附近上下波动。在加料即将结束时,N-硝基吡唑瞬间大量析出,此时热量迅速释放,放热速率在20 s内达到98.95 W的最大值,温度升高到32 ℃。在析出固体后,反应速率逐渐下降到平均放热速率附近,此时继续依次加入剩余物料。在保温阶段,平均放热速率为0.11 W,放热速率趋于零直到反应结束。硝化反应传热数据如表1所示。

表1 硝化反应传热数据Table 1 Calorimetric data of nitration process
失控反应严重度的评估准则如表2所示,根据表2列出的严重度评估准则可以判断其反应过程的严重度[13]。

表2 失控反应严重度的评估准则Table 2 Dangerous severity assessment for runaway reaction
从实验数据可知,吡唑硝化生成N-硝基吡唑反应过程的失控严重度等级为中等的。
利用仪器自带的软件Icontral5.4对反应过程的放热速率曲线进行面积积分,得到反应热ΔH,通过计算得到绝热温升ΔTad及合成反应最高温度(maximum temperature of the synthesis reaction,MTSR)。对半间歇等温模式反应来说,系统冷却发生故障后,未反应物质继续进行反应导致温度升高,此温度取决于未反应物料的量,MTSR即为系统冷却失效后累积热量使反应体系在绝热条件下能达到的最高温度。可用式(2)~式(4)计算反应过程的热量累积[13]。
潜在放热量:
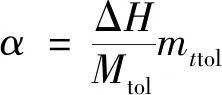
(2)
已释放热量:

(3)
热累积:
σ=α-β
(4)

任意时刻热累积导致的绝热温升为ΔTad,r,其表达式为

(5)
式(5)中:Mt为t时刻反应体系的总质量,kg;Cp为t时刻反应体系的比热容,J/(g·K)。
t时刻反应热累积可使反应体系绝热温升到的最高温度Tcf,计算公式为
Tcf=Tp+ΔTab,r
(6)
式(6)中:Tp为合成反应的反应温度。
MTSR的定义为
MTSR=maxTcf
(7)
硝化过程热量累积曲线如图3所示。由图3可知,在第146分钟时,有最大的热累积,此时刻为固体爆发析出的初始时刻,随着固体析出,热释放速率迅速增加,累积度随之迅速降低。在第148分钟加料结束后,不再有新的物料加入,热量累积降低至零附近,直到反应结束。

图3 硝化过程热量累积Fig.3 The heat accumulation of the reaction process
若反应器在第146分钟冷却失效时停止加料,由热累积导致的绝热温升最高可达15.85 ℃。由式(7)可求得MTSR=45.85 ℃。
2.2 硝化液的热稳定性分析
硝化液在绝热环境下的热分解结果如图4、图5所示,绝热分解特性参数如表3所示。由图4可知,硝化液先加热到初始温度30 ℃,随后进行加热-等待-搜寻(heat-wait-seek,H-W-S)模式。在45.7 ℃探测到放热后仪器将不再加热,反应系统靠分解热加热升温。当一段热分解结束后,仪器将再次进入H-W-S模式,直到探测到下一段放热或到达设定终止温度[14]。
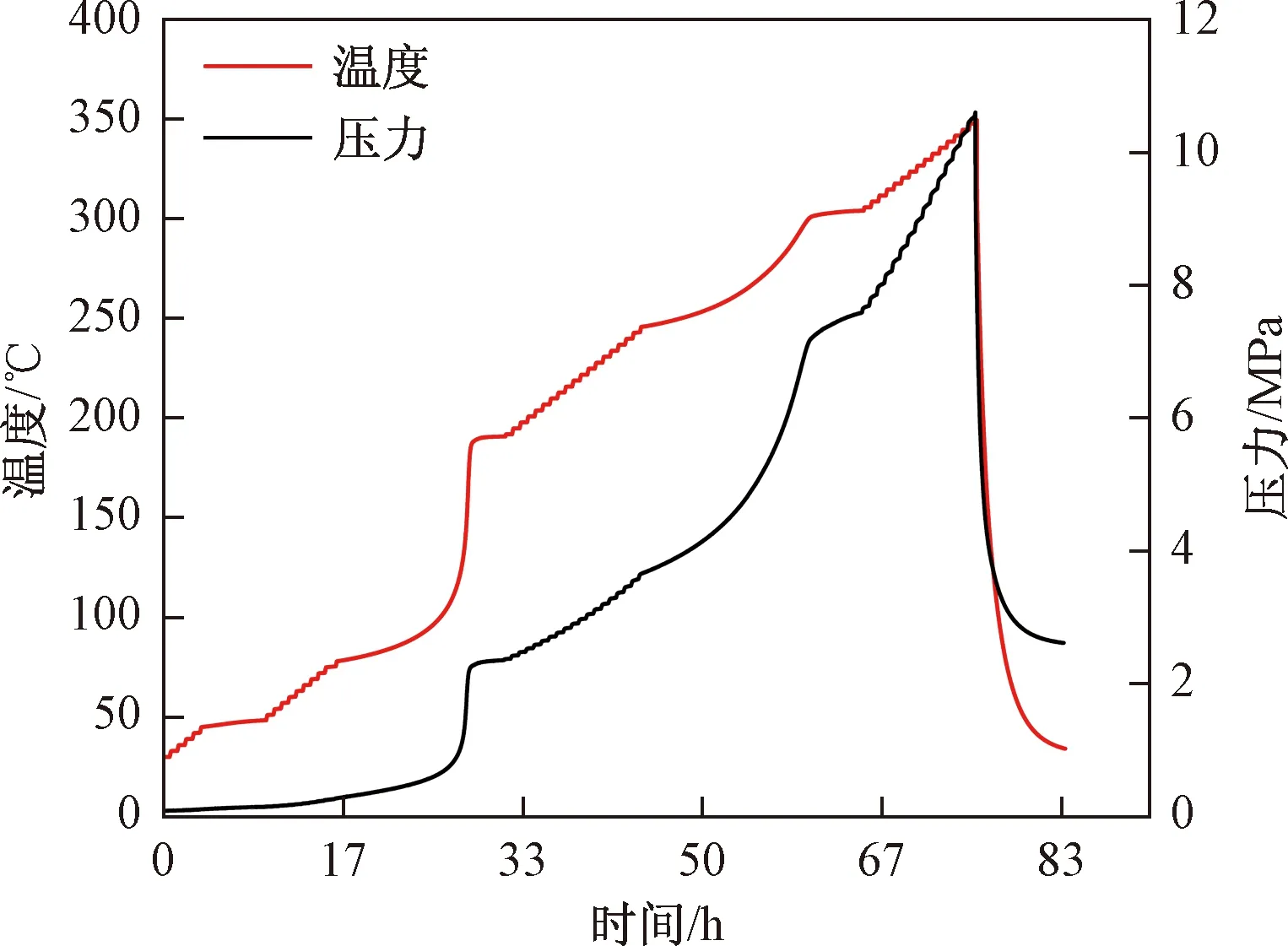
图4 温度和压力随时间的变化曲线Fig.4 Changing curves of temperature and pressure over time
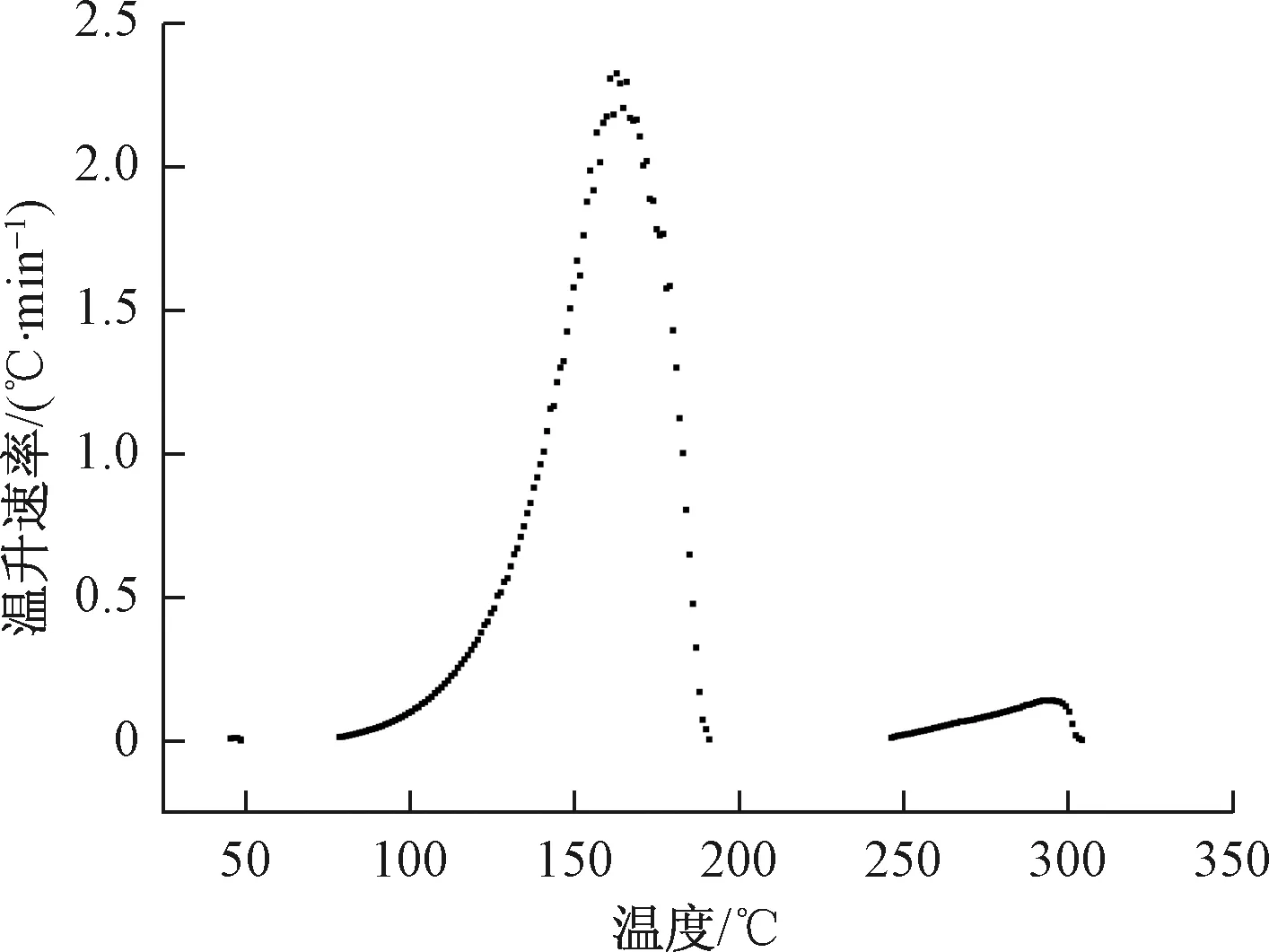
图5 温升速率随温度的变化曲线Fig.5 Changing curve of temperature rise rate over temperature

表3 硝化液的绝热分解特性参数Table 3 Adiabatic decomposition parameters of nitrate solution
由图5、表3可知,硝化液的绝热分解分为3个阶段。比较三段放热可以发现,第一段放热最为缓慢,温升速率基本在灵敏度0.01 ℃/min上下浮动。第二段放热是主要阶段,在78.8 ℃开始放热,此时温升速率为0.016 ℃/min,经过702 min后到达最大温升速率2.349 ℃/min,随后温升速率不断下降,到190.9 ℃时第二段分解结束,绝热温升为 112.1 ℃,分解热为309.4 J/g。因为第一段放热速率一直在灵敏度附近,且绝热温升较小,考虑到误差的影响,这里以第二段放热进行分析。
在ARC测试中,样品放出的热量同时加热样品和小球[15-16],如式(8)、式(9)所示:
MCvΔTAB=(MbCv,b+MCv)ΔTAB,s
(8)
MCvmT=(MbCv,b+MCv)mT,s
(9)
式中:Mb为小球质量;Cv,b为小球比热;M为样品质量;Cv为样品比热;ΔTAB为绝热温升;mT为绝热温升速率;下标s表示样品和小球组成的反应系统。因此,样品的实际温升及温升速率要比测试值要高,利用惰性因子(Φ)对部分温度参数进行修正,以排除反应小球对测试的影响。

(10)
修正后各特性参数为
ΔTAB=ΦΔTAB,S
(11)
Tf=T0+ΦΔTAB,S
(12)
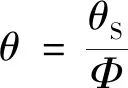
(13)
mT=ΦmT,S
(14)
ΔH=ΦΔHS
(15)
式中:θ为最大反应速率到达的时间;下标S表示测定值。
根据Φ校准后的硝化液绝热分解特性参数如表4所示。根据修正后的数据可知,反应液绝热分解的最大分解速率为8.158 ℃/min,从热分解开始到最大分解速率所需的时间为202.13 min,证明其热分解没有强烈的自催化效应。
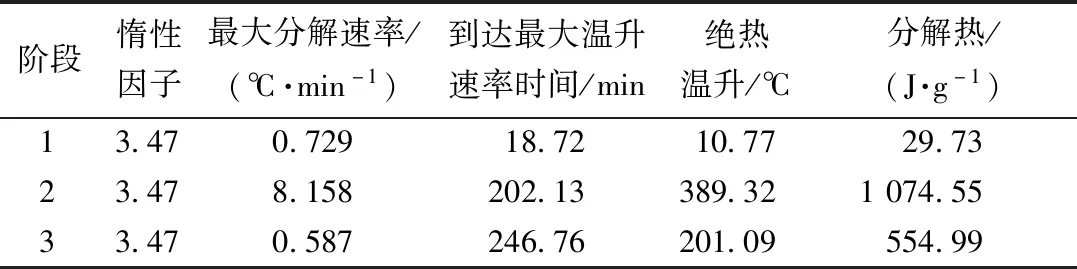
表4 校正后的硝化液绝热分解特性参数Table 4 Modified values of adiabatic decomposition parameters of nitrate solution
有关绝热加速量热仪的数据处理都是依据Townsend等[16]制定的方法进行的。
反应速率与温度满足阿伦尼乌斯公式:
k=Ae-Ea/RT
(16)
式(16)中;k为反应速率;A为指前因子;Ea为表观活化能;R为气体常数;T为温度。
对一个分解反应来说,反应物浓度与时间存在以下关系:

(17)
式(17)中:c为反应物浓度;t为反应时间;n为反应级数。
在反应的任意时刻,反应物浓度c与温度T满足以下关系:
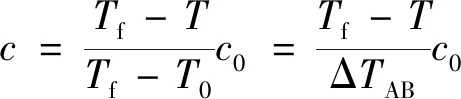
(18)
式(18)中:ΔTAB为绝热温升;下标0表示初始状态;下标f表示最终状态。
由式(17)、式(18)可以得到温升速率与温度的关系为

(19)
式(19)中:mT为绝热温升速率;ΔT为绝热温升;下标0表示初始状态;下标f表示最终状态。
定义一个拟速率常数k*为
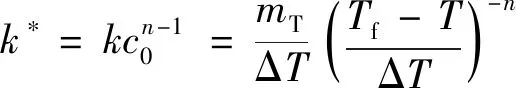
(20)
当取得合适的n时,温度对k*与k有相同的影响,根据Arrhenius公式:
k*=Ae(-Ea/RT)
(21)
两边取对数可得:
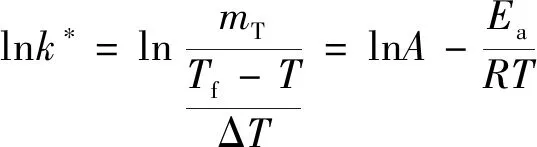
(22)
根据式(21)求得拟速率常数(k*),由式(22)以lnk*对1/T进行线性拟合,根据斜率和截距求得活化能和指前因子。不同反应级数下的线性因子(r)、指前因子(A)和表观活化能(Ea)如表5所示,硝化液分解的lnk*和1/T之间的关系如图6所示。

表5 硝化液分解的动力学参数Table 5 Kinetic parameters of nitrate solution adiabatic decomposition

图6 硝化液的lnk*-1 000/T曲线Fig.6 Curves of lnk*-1 000/T for the decomposition of nitrate solution
当反应级数为2时,发现lnk*对1/T有较好的线性关系,相关系数r=0.998,其活化能和指前因子分别为118.81 kJ/mol、6.94×1013s-1。
2.3 反应风险评估
最大反应速率到达时间满足以下关系[17]:
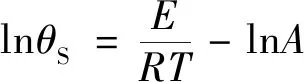
(23)
式(23)中:θS为实则最大反应速率到达时间,因Φ影响,对其进行修正:
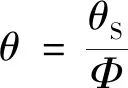
(24)
由式(23)、式(24)得出反应最大速率到达时间为24 h时对应的温度TD24,TD24=321.26 K,即48.11 ℃。
一般,在开放体系中,常把沸点定为技术原因的最高温度(maximum temperature for technical reason,MTT),硝化吡唑的过程需要加料,所以属于开放体系,体系中溶剂的主要成分为乙酸酐,取其沸点为MTT,对应为139 ℃。根据冷却失效危险度分级的方法,对吡唑硝化生成N-硝基吡唑的实验过程进行分级。结果如表6所示。
根据表6可知,4个温度的排序为工艺温度TP

表6 反应过程的危险度分级参数Table 6 Risk classification parameter of reaction process
3 结论
(1)对N-硝基吡唑合成过程中的热危险性进行分析,其绝热温升为98.14 ℃,反应严重度为中等,冷却失效后硝化反应能达到的最高温度为45.85 ℃。
(2)硝化液的绝热分解分为三段,其中第二段为主要的热分解阶段。主要的热分解从78.8 ℃开始,绝热分解时最大温升速率为8.158 ℃/min,到达最大反应速率的时间为202.13 min,热分解较为缓慢。对其热分解进行动力学计算,得到其活化能为118.81 kJ/mol、指前因子为6.94×1013s-1。
(3)依据冷却失效危险度分级的方法对硝化过程进行危险度评级,N-硝基吡唑合成过程中的危险度等级为2级。反应过程的热危险较低,但应该在反应时加入更多的溶剂进一步降低反应危险性。
