不同减胎方式对单绒毛膜双羊膜囊双胎临床结局的影响
2020-12-04梁炎春戴郁菁蔡婉玲曾涵秋程谦益陈杏欢祝彩霞
梁炎春 ,戴郁菁,蔡婉玲,曾涵秋,程谦益,陈杏欢,祝彩霞,牛 刚
(中山大学1.附属第一医院妇产科,广东广州 510058;2.中山医学院,广东广州 510080)
单绒毛膜双羊膜囊双胎(monochorionic diam⁃niotic,MCDA)是双胎妊娠中的一种特殊类型,30%~40%的病例发生复杂性双胎,母儿并发症多。1/3 的MCDA 双胎因胎盘份额不等及胎盘血管吻合而出现复杂性双胎并发症,如双胎输血综合征、选择性宫内生长受限、双胎畸形不一致、双胎贫血-红细胞增多序列(twin anemia polycythe⁃mia sequence,TAPS)和双胎脐动脉反向灌注序列等[1]。这些情况可能导致胎儿宫内死亡或严重的新生儿并发症。近年来,由于辅助生殖技术的广泛应用,MCDA 也逐年增加。因而在复杂性MC⁃DA 妊娠中,选择性终止一个胎儿是必要的。减胎可改善双胎中保留胎儿的生存状况,防止其发生潜在的神经损伤,最终有效地改善妊娠结局和新生儿结局。现今最佳的MCDA 减胎方法尚未明确。单绒毛膜双胎由于存在胎盘交通血管吻合,不适于传统的经心内氯化钾注射减胎法,只能采取机械性脐带结扎术或各种热凝固法闭塞目标胎儿脐带[2],阻断目标胎儿血供,同时又不引起另一胎儿的血流动力学变化。目前针对复杂性单绒毛膜双胎减胎方法主要包括双极脐带电凝减胎术[3]、激光凝固、射频消融减胎术[4-5]、微波消融术、胎儿镜下减胎术等。本研究回顾性分析2009年至2019 年在中山大学附属第一医院行选择性减胎术的复杂性单绒毛膜双胎病例,比较BCC 与RFA 在单绒毛膜双胎减胎的预后及并发症。
1 材料与方法
1.1 研究对象
本研究收集2009 年至2019 年间中山大学附属第一医院行妊娠早期超声检查证实妊娠、诊断为单绒毛膜双羊膜囊双胎并行选择性减胎术的孕妇53 例。所有孕妇孕期均行选择性减胎术,并在我院规律产检及分娩。纳入标准包括:①经B超诊断为单绒毛膜双胎妊娠;②在100/7~236/7周通过射频消融减胎术(radiofrequency ablation,RFA)或双极脐带电凝减胎术(bipolar umbilical cord co⁃agulation,BCC),最终减胎至一胎。主要减胎指标[6]包括(图1):①双胎输血综合征(twin to twin transfusion syndrome,TTTS):指一胎羊水过少,同时另一胎羊水过多;TTTS 分期依据Quintero 分期法;②选择性宫内生长受限(selective intrauterine growth restriction,sIUGR):指一胎估计体质量少于同胎龄胎儿体质量的第10 百分位数,另一胎估计体质量在正常范围内;③双胎脐动脉反向灌注序列(twin reversed arterial perfusion sequence,TRAP):指一胎超声检查未见明显异常,另一胎可见软组织和脊柱、骨结构,无头颅和心脏结构,部分可见下肢结构;④双胎之一畸形:指一胎超声检查未见明显异常,一胎超声检查发现严重畸形;⑤遵从患者意愿行选择性减胎术;⑥其他。
1.2 减胎方法
1.2.1 双极脐带电凝减胎术 穿刺套管针从腹壁切口进入要减胎的胎儿的羊膜腔,应用胎儿镜和超声定位脐带位置,将双极电凝钳放入羊膜腔内,在超声引导下夹住被减胎的脐带的游离段,开始电凝,功率5~60 W,电凝时间30 s~2 min。经彩色多普勒超声确认脐带血流消失,胎心搏动停止,然后在首次电凝部位附近再次夹住脐带进行电凝直到血流信号消失为止。
1.2.2 射频消融减胎术 将电极板置于一侧大腿根部,行彩色多普勒超声检查确定穿刺人路。采用局部麻醉,在超声引导下经皮经胎盘将射频电极插入拟减胎脐带脐轮部,启动消融治疗仪。每次能量释放功率30~200 W,治疗后再应用彩色多普勒超声观察胎儿脐带血流情况。若发现血流信号,则继续延长消融时间或重新穿刺后再行消融,直至脐带血流信号消失。
1.3 数据收集
采集的数据包括基线特征(包括年龄,身高和体质量),妊娠史(孕次,产次,人工流产次数,自然流产次数,早产安胎史),妊娠并发症(妊娠期糖尿病,妊娠期高血压),减胎手术相关信息和指标(减胎孕周,减胎方式,手术时间,术中和术后并发症,手术前和手术后的血红蛋白水平等),妊娠结局(分娩孕周,生产方式,地塞米松促胎肺成熟),胎儿附属物异常(胎膜早破),新生儿结局(低出生体质量儿,极低出生体质量儿,小于胎龄儿,新生儿转到儿科或重症监护进行观察的比例),新生儿活产率等。
1.4 统计学分析
本研究主要是回顾性分析统计孕妇基本情况、减胎方式的选择、分娩孕周等相关因素对最终的妊娠结局及新生儿结局产生的影响。符合正态分布的连续性变量的表述采用平均值±标准差表示;对于定量资料,当数据符合正态分布且方差齐时使用t检验进行组间比较;若数据不符合正态分布,则使用中位数和四分位数,即M(P25~P75)进行统计描述,两组比较采用非参数秩和检验。本研究中,两组患者之间的年龄、身高、体质量、孕次、产次、人工流产次数、自然流产次数、平均分娩孕周均使用t检验进行组间比较。对于定性资料,以例数和频数(%)进行统计描述,采用卡方检验或Fisher 确切概率法进行组间比较。本研究中,妊娠期糖尿病、妊娠期高血压、减胎指征、术中和术后发生的症状(包括头晕、腹痛等)、分娩孕周、生产方式(剖宫产或阴道分娩)、胎膜早破、低出生体质量儿、极低出生体质量儿、小于胎龄儿、新生儿转到儿科或重症监护进行观察的比例、早产安胎史、使用地塞米松促胎肺成熟、新生儿活产率均使用卡方检验进行组间比较。进一步应用多变量Logistic 回归分析与新生儿结局不良有独立相关性的指标,指标包括分娩孕周< 27 周、减胎孕周<236/7周、减胎方式、妊娠期高血压、妊娠期糖尿病。数据采用SPSS 20.0 软件进行统计学分析。P<0.05 为差异有统计学意义。
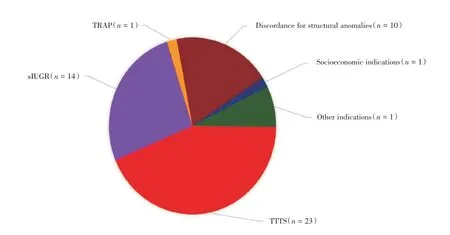
图1 减胎指标分布图Fig.1 Distribution of the indications for selective reduction
2 结果
2.1 一般资料
本研究共收集资料完整的单绒毛膜双羊膜囊双胎妊娠并接受减胎术的患者53 例。所有患者中最大年龄40 岁,最小年龄21 岁。BCC 和RFA 两组患者之间的年龄、身高、体质量、孕次、产次的差异均无统计学意义。两组患者妊娠并发症发生率的差异均无统计学意义。两组患者的减胎指征分布的差异均无统计学意义(表1)。
2.2 BCC 和RFA 两组手术相关指标的比较
BCC 和RFA 两组患者的手术相关资料详见表2。RFA 组有2 例孕妇术中发生头晕,3 例术后发生头晕,2 例发生术后发热,经对症处理及抗感染处理后好转。BCC 组术中无发生头晕或腹痛,术后无发生头晕、腹痛、阴道流血、流液、发热等症状。RFA 组和BCC 组孕妇术后发生下腹紧缩感的比例分别为:65.0%和61.5%,差异无统计学意义。两组患者经对症处理后下腹感均可缓解。此外,两组孕妇的手术时间和住院天数均无统计学差异。
2.3 BCC 和RFA 两组妊娠结局比较
RFA 组的分娩孕周为366/7(264/7~406/7)周,晚于BCC组的324/7(290/7~374/7)周,但两者差异无统计学意义(P>0.05)。BCC 组在妊娠370/7周前分娩的比例高于RFA组(100%vs.62.5%,P=0.024)。BCC组的胎膜早破率(46.15%)大于RFA组(32.5%),但两者差异无统计学意义(P>0.05)。两者的剖宫产率差异亦无统计学意义(P>0.05)。使用地塞米松促胎肺成熟率、早产安胎史的差异则无统计学意义(P>0.05)。新生儿结局中,BCC 组的低出生体质量儿发生率大于RFA 组(92.31%vs.52.5%,P=0.025);极低出生体质量儿发生率的差异则无统计学意义(P>0.05);BCC 组的新生儿转到儿科或重症监护进行观察的比例大于RFA 组(84.62%vs.30%,P=0.001),小于胎龄儿发生率在两者间均无明显差异(P> 0.05)。两组的新生儿均全部存活(表3)。
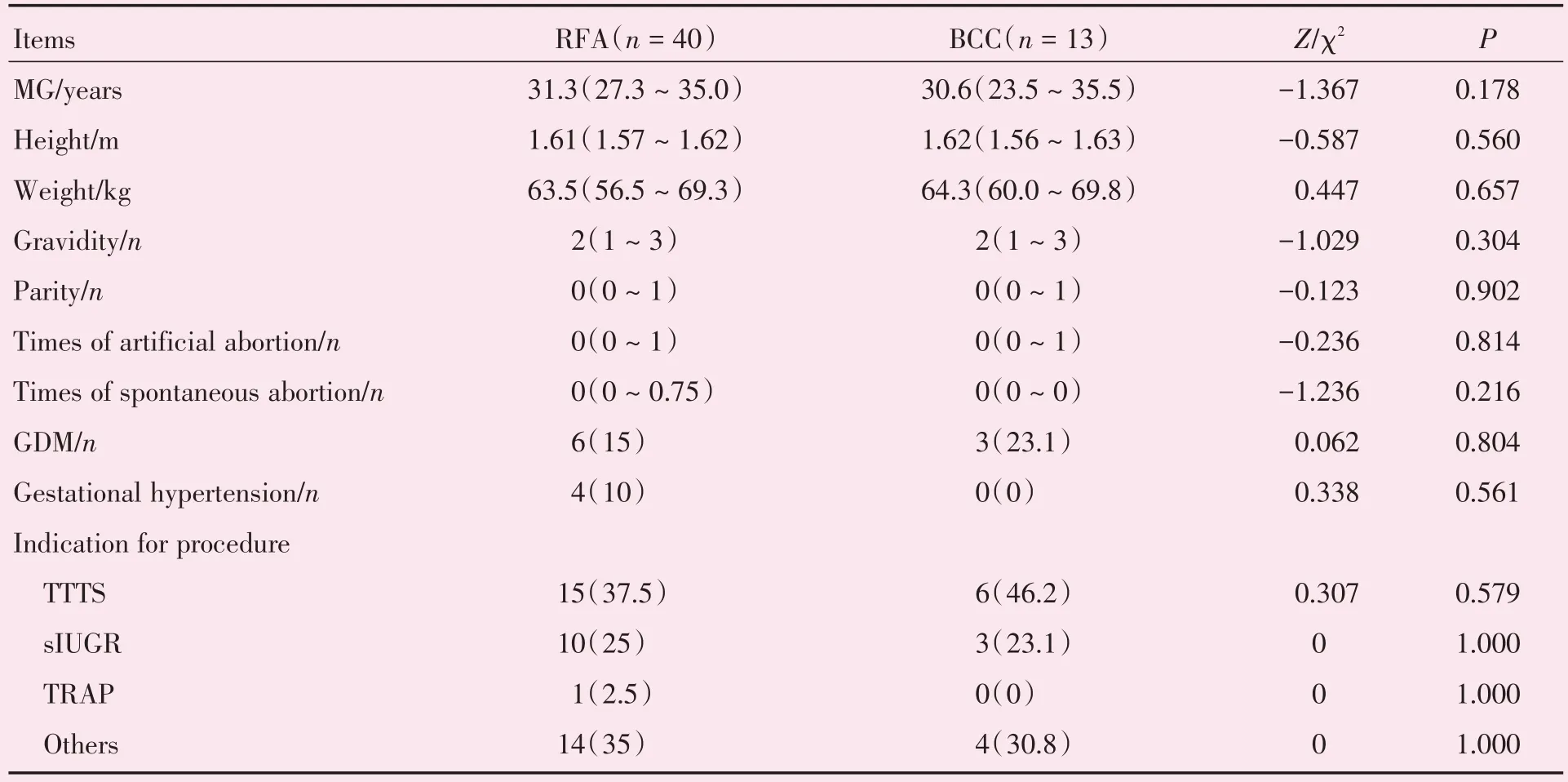
表1 两组孕妇的一般资料Table 1 Demographic and obstetric characteristics of the patients [n(%),M(P25~P75)]

表2 两组患者的手术相关指标Table 2 Surgical data of different groups of patients [n(%),M(P25~P75)]
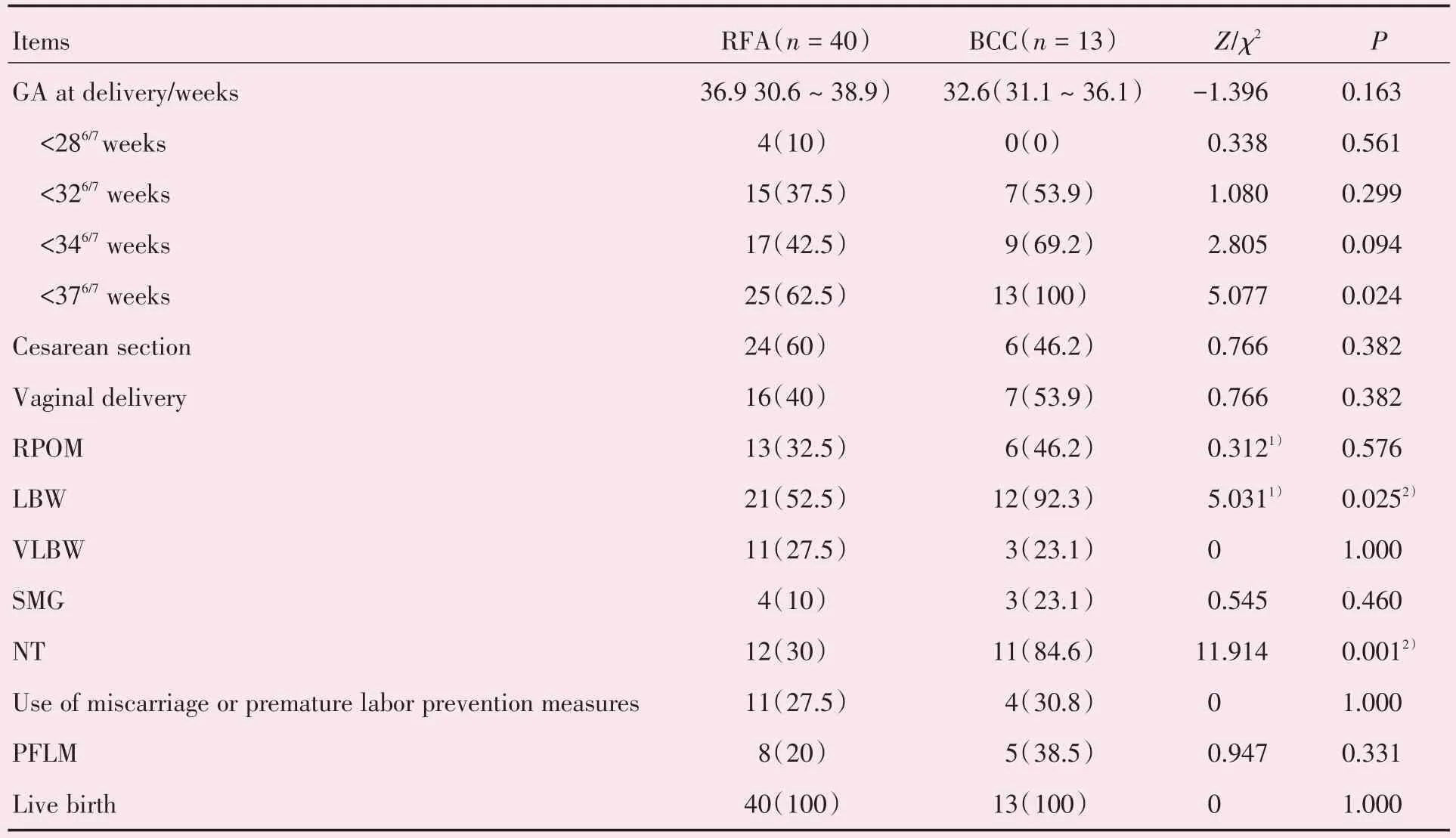
表3 MCDA 妊娠中不同减胎方式妊娠结局的比较Table 3 Pregnancy outcomes in complicated monochorionic twin pregnancies undergoing different selective reductions [n(%),M(P25~P75)]
2.4 影响新生儿结局的多因素分析
RFA组与BCC组的新生儿结局比较中,低出生体质量儿发生率有显著差异。以多变量Logistic回归分析不同指标与低出生体质量儿发生率的相关性,指标包括分娩孕周< 270/7周、减胎孕周< 236/7周、减胎方式、妊娠期高血压、妊娠期糖尿病。结果发现相对于分娩孕周>270/7周,分娩孕周< 270/7周是低出生体质量儿的危险因素(OR=2.091,95%CI,0.312~14.162,P=0.032)。无论是RFA 或是BCC,都与低出生体质量儿发生率没有显著的相关性(RFA 相对于BCC,OR=0.845,95%CI,0.517~1.231,P=0.314;表4)。
3 讨论
本研究回顾性分析行BCC 或RFA 减胎术的复杂性单绒毛膜双胎病例的妊娠结局及新生儿结局。结果发现,与RFA 组相比,BCC 组的早产率、低出生体质量儿发生率和新生儿转到儿科或重症监护进行观察的比例显着高于RFA 组,差异有统计学意义。通过多因素分析发现,分娩孕周<270/7周是低出生体质量儿发生的危险因素,差异有统计学意义。
本研究中BCC 组的早产率显着高于RFA 组(100%vs.62.5%,P=0.024),RFA组的分娩孕周为366/7(264/7~406/7)周,晚于BCC 组的324/7(290/7~374/7)周,表明BCC相较于RFA更容易发生早产,推测孕妇发生胎膜早破(premature rupture of membranes,PROM)是早产的主要原因之一。此论点与Beb⁃bington 等[7]研究相符,该研究发现BCC 治疗后发生胎膜早破的几率(27.3%)高于RFA(13.7%),差异有统计学意义(P=0.05)。BCC 相较于RFA 更容易发生早产的其他研究有不同的结论,Yinon等[8]研究表明,BCC 组有较早的分娩孕周[BCC(31.3 周)vs.RFA(35.0 周),P=0.9],尽管没有统计学差异,但研究认为若然有更大样本(RFA 增加4 人,BCC 增加3 人),有可能会出现统计学差异。因此,本研究中BCC 组胎膜早破率(46.15%)高于RFA 组(32.5%),尽管差异无统计学意义,但是或许扩大样本量能发现两者的差异。
本研究中BCC 组的低出生体质量儿发生率大于RFA 组(92.31%vs.52.5%,P=0.025),推测这结果与BCC 组较高的早产率有很大的关系,孕周与新生儿体质量呈正相关,妊娠晚期胎儿更是发育迅速,故早产常伴随着低体质量儿的出现[9]。Yinon 等[8]研究亦表明,BCC 的新生儿出生体质量比RFA组低(中位数,2 210 gvs.2 405 g),两者的低出生体质量百分比差异有统计学意义(P=0.05)。本研究还统计了可能与早产有关的极低出生体质量儿发生率、小于胎龄儿率、使用地塞米松促胎肺成熟率、新生儿转到儿科或重症监护进行观察的比例的比较,其中有统计学差异的只有BCC 组的新生儿转到儿科或重症监护进行观察的比例大于RFA 组(84.62%vs.30%,P=0.001)。新生儿转入儿科或重症监护室观察的指征主要为早产儿、低出生体质量、新生儿窒息等。另外,对新生儿结局造成影响进行多因素分析,结果发现分娩孕周< 27 周是低出生体质量儿发生的危险因素(OR=2.091,95%CI=0.312~14.162,P=0.032)。有研究亦报道了分娩孕周<28 周是新生儿结局不良的独立危险因素[10]。这进一步说明了未足月分娩孕周与新生儿出现不良结局有密切的关系,而BCC组有着较高的早产率,使其相对于RFA 组更易出现低出生体质量儿等新生儿不良结局。
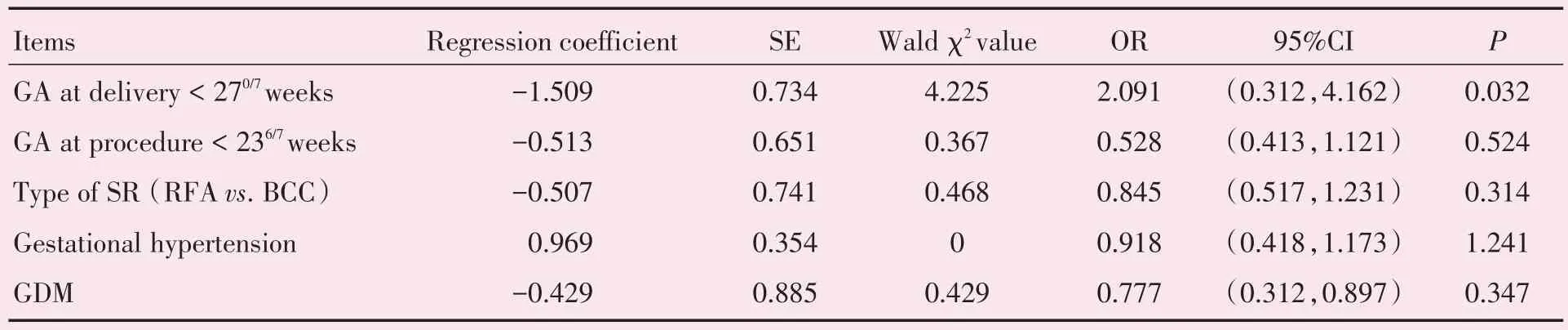
表4 影响新生儿结局的多因素分析Table 4 Multivariable analysis of the risk of adverse perinatal outcomes
目前对于MCDA 的最佳减胎方法仍有争议。一些研究表明,BCC 由于在操作时需放置胎儿镜,操作口径需达到3~5 mm,因此造成胎膜创面较大,同时增加胎膜感染的几率[11];而RFA 无需放置胎儿镜、设备直径小、在羊水过少的情况下不需要进行羊水输注[12],使其手术时间短于BCC,理论上来说,RFA 有较低的胎膜早破和早产发生率。但是有研究指出RFA 手术过程中产生的高温可能导致大量组织坏死而发生孕妇高钾血症以及血栓栓塞[13]。超过2 个周期的RFA 凝血是RFA 用于单绒双胎减胎后发生新生儿死亡的独立风险因素(OR 3.46,95% CI=1.34~8.94;P=0.01)[14]。目前能检索到的近年的文献均不能明确RFA 是否优于BCC[14-16]。
单绒毛膜双羊膜囊双胎是双胎妊娠中一种发生概率较低的特殊类型,故出现复杂性双胎的概率不高。而且针对MCDA 需进行个体化治疗,除减胎术外还包括终止妊娠、脐带结扎术、胎儿镜激光电凝术等方法,故本研究虽然收集了我院10 年期间的接受RFA 或BCC 手术治疗的病例资料,但在我院建档规范产检并且资料齐全、同时符合本研究入选和排除标准的样本量较少,因此能观察的数据范围较小。其中BCC 组样本量远少于RFA组,可能增加了假阴性率。Yinon 等[8]的研究与本研究具有相同的总样本量,其研究亦受限于因样本量过少而导致的实验结果未出现较有意义的统计学差异,两组研究都可通过增加样本量来减少实验结果的偏倚。此外,本研究与Yinon 等[8]的研究所纳入研究的对象存在人种特征、生活习惯、医疗环境等方面的差异,可能导致最终的统计结果出现选择偏倚。
据有关文献报道,虽然早产儿及低出生体质量儿经抢救得以在产后存活,但其后续出现智力低下与发育迟缓的概率高于正常新生儿[17]。对于MCDA,由于双胎间存在血流交通,减胎术后,存活胎儿经胎盘血管吻合向死亡胎儿输血,由此造成的急性血容量降低易导致存活胎儿发生神经系统并发症,多于术后对胎儿进行磁共振检查或出生后新生儿智力发育随访检查时发现。在本次研究中,关于两种减胎术的追踪随访时间均较短,因此,对不同减胎术后保留胎的远期预后尚无明确结论,还需要对保留胎儿长期的发育情况进行随访观察,以研究不同的减胎方式对新生儿远期预后的影响。
