检测多天线AAG的Lectin-ELISA方法建立及初步应用评价
2020-12-03关雯倩高致远冯惠娟何羽童高春芳
关雯倩, 高致远, 冯惠娟, 洪 松, 何羽童, 何 璐, 高春芳
(上海东方肝胆外科医院实验诊断科,上海 200438)
α1-酸性糖蛋白(alpha 1-acid glycoprotein,AAG)是由肝细胞合成、分泌的一种急性时相反应蛋白[1],等电点为2.8~3.8,糖含量高达42%[2]。人血清AAG分子是一条具有183个氨基酸的多肽链,相对分子质量为41 000~43 000,含有5个N-linked糖基化位点(Asn-15、Asn-38、Asn-54、Asn-75、Asn-85),每个糖基化位点均可能表达具有不同分枝数的糖链结构[3],多天线糖链结构主要是指有3条或3条以上分枝的糖链。血清中糖蛋白的含糖量多在20%以下,AAG的含糖量在所有糖蛋白中处于较高水平,且唾液酸含量高达15%,并以α2-3或α2-6的方式与半乳糖连接[4]。唾液酸带负电荷,这也是AAG等电点较低的原因。由于AAG具有抗中性粒细胞和抗补体活性,因此被认为是一种天然的抗炎蛋白和免疫调节剂[5]。AAG还具有维持毛细血管通透性的功能,可提高血管内皮细胞的阴离子选择性[6]。此外,AAG还具有抑制血小板聚集等功能[7]。AAG的多种生物学活性都依赖于其糖基化修饰,如抑制淋巴细胞增殖的功能依赖于其糖链分枝水平[8];AAG经去唾液酸处理后,其抑制血小板聚集的功能加强[9];AAG可通过N-linked糖链结合1型人类免疫缺陷病毒(human immunodeficiency virus 1,HIV-1),抑制病毒包膜蛋白结合CD4+单核细胞[10]。AAG糖基化改变并不仅限于急性炎症条件下,在其他病理生理条件下也会发生相应变化,如妊娠、类风湿性关节炎、酒精性肝硬化、肝炎等[11-14]。在肿瘤的发生、发展过程中,糖基化位点和糖链结构均可能出现异常改变,通过对比正常人和疾病患者的糖基化状况,可能会发现能用于临床的新肿瘤标志物。在卵巢癌、胰腺癌等肿瘤中,AAG的糖基化改变已有相关报道[15]。在原发性肝细胞肝癌(hepatocellular carcinoma,HCC)中,异常岩藻糖基化的AAG增加也有相关报道[16]。糖链分枝数增加也是肿瘤中常见的异常糖基化形式。目前,关于HCC中AAG的多天线糖链改变情况尚缺乏相关的文献报道。为阐明HCC患者血清多天线AAG的变化情况,本研究拟构建一种凝集素-酶联免疫吸附试验(lectin enzyme-linked immunosorbent assay,Lectin-ELISA)检测体系,初步评价多天线AAG对HCC患者的诊断价值。
1 材料和方法
1.1 研究对象
选取2014年—2018年的患者457例,包括HCC 220例[HCC组,其中男193例、女27例,年龄(50.3±8.22)岁]、肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)74例[ICC组,其中男64例、女10例,年龄(55.72±10.18)岁]、肝硬化(liver cirrhosis,LC)120例[LC组,其中男106例、女14例,年龄(51.45±11.07)岁]、慢性乙型肝炎(chronic hepatitis B,CHB)43例[CHB组,其中男40例、女3例,年龄(51.02±10.31)岁],其中220例HCC患者、74例ICC患者和32例LC患者的血清样本收集于上海东方肝胆外科医院,79例LC患者和4例CHB患者的血清样本收集于海军军医大学附属长征医院,8例LC患者的血清样本收集于中国人民解放军联勤保障部队第962医院;8例CHB患者的血清样本收集于沈阳军区总院;27例CHB患者的血清样本收集于济南传染病院;4例CHB的血清样本收集于台州市第一人民医院;1例LC的血清样本收集于福州孟超肝胆医院。根据医院电子病历系统,尽可能全面地收集所有患者的一般资料、 临床实验室指标及病理诊断结果。HCC患者病理诊断结果包括:肿瘤的大小、肿瘤数目、卫星结节、大血管癌栓、肿瘤包膜、分化程度、微血管侵犯(microvascular invasion,MVI)、肝硬化情况等。每例患者临床血常规、肝功能、肿瘤标志物、凝血系统功能检查、乙型肝炎病毒(hepatitis B virus,HBV)标志物等临床检测数据与血清样本同期收集。选取同期上海东方肝胆外科医院体检健康者80名(正常对照组),其中男70名、女10名,年龄(51.46±8.34)岁。各组间性别、年龄均相互匹配。本研究经海军军医大学东方肝胆外科医院伦理委员会批准,所有对象均签署知情同意书。
1.2 入选和排除标准
HCC均为经术后病理检查明确诊断。排除标准:(1)合并甲型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒、人类免疫缺陷病毒等感染;(2)患继发性肝癌、其他器官恶性肿瘤、严重感染及其他器官严重疾病等。HCC分期依据TNM标准[美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版]。T1期:单个肿瘤<2 cm或>2 cm但无血管浸润;T2期:单个肿瘤>2 cm,伴有血管浸润,或多发性肿瘤且均<5 cm;T3期:多发性肿瘤,其中至少1个>5 cm;T4期:任意大小的单个或多个肿瘤侵犯门静脉或肝静脉,或肿瘤直接侵犯胆囊以外的临近器官或腹膜脏层。
ICC均经术后病理明确诊断。LC均经过临床表现和影像学检查确诊的HBV相关LC患者,排除自身免疫性肝病、酒精性肝病,药物性肝病及其他原因引起的慢性肝病、Wilson病、肾功能不全、血液病等。CHB均为乙型肝炎表面抗原阳性持续6个月以上的患者。
1.3 血清样本采集
采用促凝管采集所有对象静脉血3~4 mL,室温静置30 min,1 500×g离心10 min,吸取血清置于专用的Eppendorf管中,300~500 μL/管,-80 ℃保存。
1.4 实验室常规检测指标
肝功能指标均采用Modular P800全自动生化分析仪(瑞士罗氏公司)及配套试剂检测。相关指标参考区间分别为总蛋白(total protein,TP)65~85 g/L,白蛋白(albumin,Alb)40~55 g/L,总胆红素(total bilirubin,TB)3.4~21.0 μmol/L,直接胆红素(direct bilirubin,DBil)<6.84 μmol/L,总胆汁酸(total bile acid,TBA)<12 μmol/L,丙氨酸氨基转移酶(alanine aminotransferase,ALT)9~50 U/L,天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)15~40 U/L,γ-谷氨酰基转移酶(gamma-glutamyltransferase,GGT)10~60 U/L,碱性磷酸酶(alkaline phosphatase,ALP)45~125 U/L,唾液酸(sialic acid,SA)456~754 mg/L,白蛋白/球蛋白(albumin/globulin,A/G)比值1.5~2.5。
血常规指标采用XE-2100D全自动血液分析仪(日本Sysmex公司)及配套试剂检测。相关指标参考区间分别为白细胞(white blood cell,WBC)计数(3.5~9.5)×109/L,血小板(platelet,PLT)计数(125~ 350)×109/L,红细胞(red blood cell,RBC)计数男性(4.0~5.5)×109/L、女性(3.5~5.0)×109/L,血红蛋白(hemoglobin,Hb)男性120~160 g/L、女性110~150 g/L。
肿瘤标志物采用cobas e601电化学发光全自动免疫分析系统(瑞士罗氏公司)及配套试剂检测。相关指标参考区间分别为甲胎蛋白(alpha-fetoprotein,AFP)<20 μg/L,癌胚抗原(carcinoembryonic antigen,CEA)<10 μg/L,糖类抗原(carbohydrate antigen,CA)19-9<39 U/mL。甲胎蛋白异质体(alpha-fetoprotein variant,AFP-L3)检测试剂盒购自北京热景公司,参考区间为<10%。
1.5 主要试剂和仪器
酶标板购自德国Greiner Bio One公司,AAG抗体(ab118809)购自英国Abcom公司,Coating buffer(#421701)购自美国BioLegend公司,Biotinylated DSA(B-1185)、Carbofree coating buffer(SP-5040)购自美国Vector公司,LowCross-buffer购自德国Candor Bioscience公司,Peroxidase-conjugated avidin、Substrate Reagent Pack(DY999)购自美国RD公司,磷酸盐缓冲液(phosphate-buffered saline,PBS)(20×)、Tween-20购自上海博光生物科技有限公司,Stop solution购自上海西塘生物公司。移液器购自美国Gilson公司,恒温培养箱购自上海精宏仪器设备有限公司,Gen5酶标仪购自美国BioTek Instruments公司,BN-Ⅱ特定蛋白分析仪购自德国西门子公司。
1.6 方法
1.6.1 Lectin-ELISA的建立 根据曼陀罗凝集素(Datura stramonium agglutinin,DSA)可特异性识别多天线糖链结构的原理[17]构建检测多天线AAG的Lectin-ELISA方法。采用AAG抗体包被酶标板,捕获血清样本中的目的蛋白AAG,采用DSA特异性识别AAG的多天线糖链结构,检测DSA与多天线AAG结合物(DSA-AAG)的水平。经证实,抗体分子上不含多天线结构,不影响DSA对目的蛋白多天线糖链结构的识别和结合,因此无需对抗体分子上的糖链结构进行封闭[18]。具体步骤:(1)用包被液将AAG抗体按比例稀释后加入酶标板,每孔加入100 μL,4 ℃过夜,每孔加入400 μL洗板液洗涤4次,最后1次洗涤后用吸水纸拍干;(2)每孔加入300 μL封闭液,37 ℃孵育1 h,洗涤4次后用吸水纸拍干;(3)用LowCross-buffer将血清样本1∶100稀释,每份样本加入2个孔中(双复孔),每孔加入100 μL,室温孵育2.5 h,洗涤4次后用吸水纸拍干;(4)用PBS将biotinylated DSA按比例稀释,每孔加入100 μL,室温孵育1 h,洗涤4次后用吸水纸拍干;(5)用酶稀释液将peroxidase-conjugated avidin按比例稀释,每孔加入100 μL,室温孵育45 min,洗涤4次后用吸水纸拍干;(6)每孔加入配制好的辣根过氧化物酶显色底物100 μL,室温避光孵育30 min;(7)每孔加入50 μL终止液,轻晃酶标板混匀,10 min内放入Gen5酶标仪检测吸光度(A)值。
1.6.2 方法学评估 由于目前尚无多天线AAG标准品,因此以5名健康人混合血清替代标准品进行检测。根据前期条件摸索,将混合血清以1∶5、1∶20、1∶80、1∶320、1∶1 280、1∶5 120、1∶20 480稀释,采用建立的Lectin-ELISA进行检测,获得浓度梯度曲线,以此评估该方法的线性。对高、中、低值样本重复检测5个批次,计算该方法的批间变异系数(coefficient of variation,CV)。以此评估该方法的重复性。采用Interference check A PLUS干扰检测试剂盒(日本Sysmex公司)进行干扰试验,干扰物质包括游离胆红素(free bilirubin,FBil)、结合胆红素(conjugated bilirubin,CBil)、溶血(Hb)和乳糜。按说明书要求配制干扰样本。具体步骤:在各干扰物质中分别加入2 mL超纯水,充分溶解,取1 mL与预先制备好的混合血清样本9 mL充分混匀,作为样本A。在空白对照中加入2 mL超纯水,充分溶解,取1 mL与预先制备好的混合血清样本9 mL充分混匀,作为样本B。将样本A与样本B按0∶1、0.2∶0.8、0.4∶0.6、0.6∶0.4、0.8∶0.2、1∶0配制成不同稀释比例的样本,采用建立的Lectin-ELISA检测,判断各干扰物质对该方法的影响。
1.6.3 Lectin-ELISA的初步临床应用 采用建立的Lectin-ELISA检测所有对象的血清样本。
1.6.4 血清AAG检测 采用BN-Ⅱ特定蛋白分析仪及配套试剂检测所有对象的血清AAG水平。
1.7 统计学方法
采用SPSS 22.0软件进行统计分析。呈正态分布的数据以±s表示,2个组之间比较采用t检验,多组间比较采用方差分析。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用非参数秩和检验。采用Spearman相关分析评估各项目之间的相关性。采用Logistic回归方法建立多指标联合检测模型。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估单项指标及联合检测模型诊断HCC的效能。以P<0.05为差异有统计学意义。
2 结果
2.1 HCC组、ICC组、LC组、CHB组及正常对照组一般资料的比较
HCC组、ICC组、LC组、CHB组及正常对照组之间血清ALT、AST、TB、DBil、Alb、TP、AFP水平差异有统计学意义(P<0.05),性别及年龄差异均无统计学意义(P>0.05)。见表1。
2.2 方法学评估
2.2.1 线性范围 以混合血清替代标准品进行检测,以A值为纵坐标,以血清稀释倍数的对数为横坐标,绘制浓度梯度曲线,线性回归系数r2=0.976,见图1。HCC组、ICC组、LC组、CHB组及正常对照组血清以1∶100稀释后DSAAAG水平均在此范围内。

图1 血清DSA-AAG的浓度梯度曲线
表1 HCC组、ICC组、LC组、CHB组及正常对照组一般资料的比较 ±s
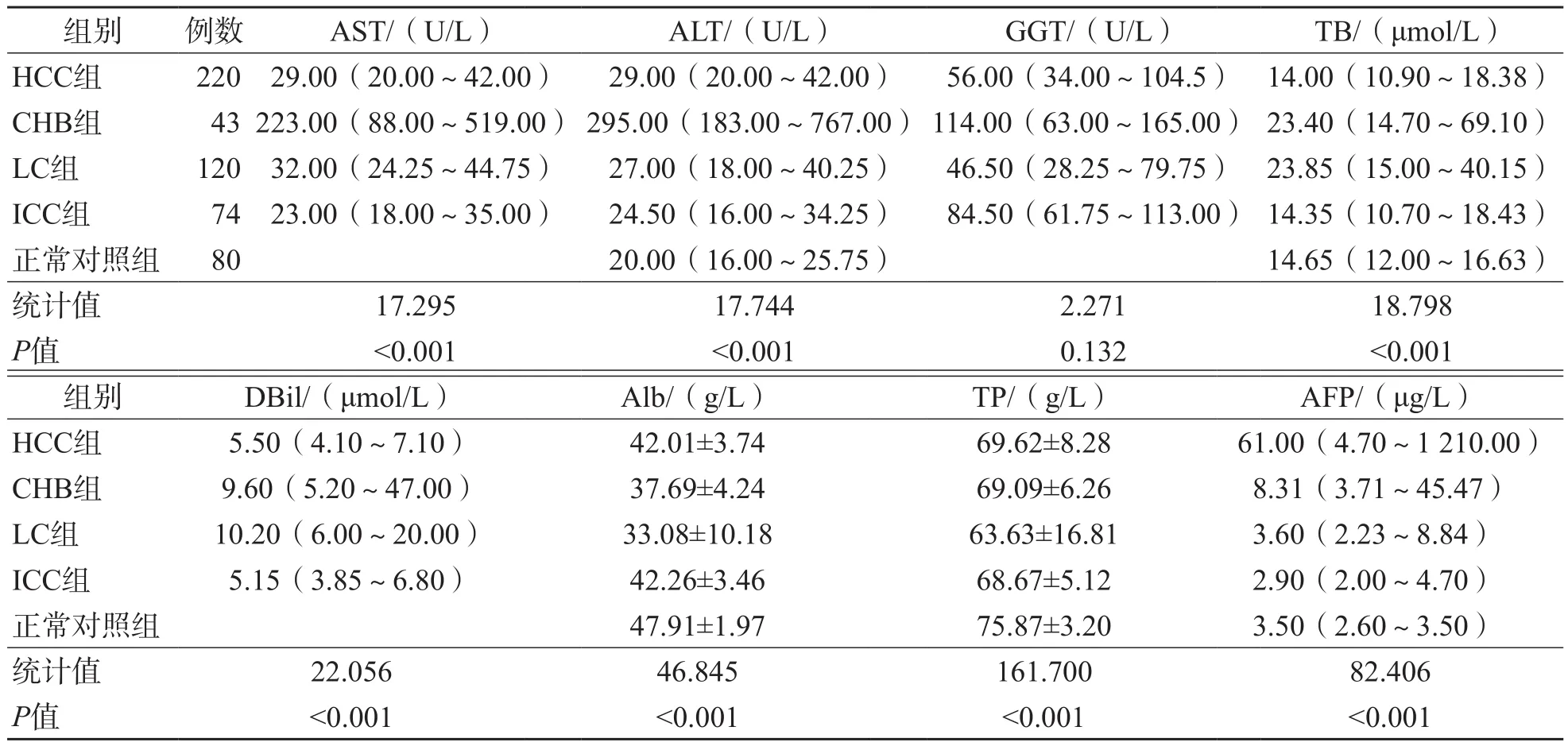
表1 HCC组、ICC组、LC组、CHB组及正常对照组一般资料的比较 ±s
组别 例数 AST/(U/L) ALT/(U/L) GGT/(U/L) TB/(μmol/L)HCC组 220 29.00(20.00~42.00) 29.00(20.00~42.00) 56.00(34.00~104.5) 14.00(10.90~18.38)CHB组 43 223.00(88.00~519.00) 295.00(183.00~767.00) 114.00(63.00~165.00) 23.40(14.70~69.10)LC组 120 32.00(24.25~44.75) 27.00(18.00~40.25) 46.50(28.25~79.75) 23.85(15.00~40.15)ICC组 74 23.00(18.00~35.00) 24.50(16.00~34.25) 84.50(61.75~113.00) 14.35(10.70~18.43)正常对照组 80 20.00(16.00~25.75) 14.65(12.00~16.63)统计值 17.295 17.744 2.271 18.798 P值 <0.001 <0.001 0.132 <0.001组别 DBil/(μmol/L) Alb/(g/L) TP/(g/L) AFP/(μg/L)HCC组 5.50(4.10~7.10) 42.01±3.74 69.62±8.28 61.00(4.70~1 210.00)CHB组 9.60(5.20~47.00) 37.69±4.24 69.09±6.26 8.31(3.71~45.47)LC组 10.20(6.00~20.00) 33.08±10.18 63.63±16.81 3.60(2.23~8.84)ICC组 5.15(3.85~6.80) 42.26±3.46 68.67±5.12 2.90(2.00~4.70)正常对照组 47.91±1.97 75.87±3.20 3.50(2.60~3.50)统计值 22.056 46.845 161.700 82.406 P值 <0.001 <0.001 <0.001 <0.001
2.2.2 批间CVLectin-ELISA检测血清DSAAAG的批间最大CV为10.51%,满足批间CV<15%的要求。见表2。

表2 Lectin-ELISA的批间CV
2.2.3 干扰试验 Lectin-ELISA检测血清DSAAAG的A值随干扰物浓度的变化仅出现轻微变化,符合临床应用要求。见图2。
2.3 血清DSA-AAG和AAG水平
将ICC组、LC组、CHB组合并为疾病对照组,HCC组血清DSA-AAG水平显著高于疾病对照组和正常对照组(P<0.001),且疾病对照组高于正常对照组(P<0.001)。HCC组、疾病对照组血清AAG水平明显高于正常对照组(P<0.001),而HCC组与疾病对照组之间差异无统计学意义(P>0.05)。见表3。
图2 干扰物质对Lectin-ELISA检测DSA-AAG的干扰

表3 HCC组、疾病对照组和正常对照组血清DSA-AAG、AAG水平的比较 x±s
将HCC组和ICC组合并为癌症组,将LC组、CHB组和正常对照组合并为非癌症组。癌症组血清DSA-AAG和AAG水平均高于非癌症组(P<0.001)。见表4。
HCC组血清DSA-AAG水平高于ICC组(P<0.001),血清AAG水平低于ICC组(P<0.001)。见表5。
表4 癌症组与非癌症组血清DSA-AAG、AAG水平的比较 ±s

表4 癌症组与非癌症组血清DSA-AAG、AAG水平的比较 ±s
注:与非癌症组比较,*P<0.001
组别 DSA-AAG(A值) AAG/(g/L)癌症组 0.46±0.08* 0.67±0.32*非癌症组 0.43±0.10 0.52±0.28
表5 HCC组与ICC组血清DSA-AAG、AAG水平的比较 ±s

表5 HCC组与ICC组血清DSA-AAG、AAG水平的比较 ±s
注:与ICC组比较,*P<0.001
组别 DSA-AAG(A值) AAG/(g/L)HCC组 0.47±0.07* 0.63±0.30*ICC组 0.43±0.10 0.79±0.35
2.4 HCC组DSA-AAG与临床各项指标的相关性
HCC组DSA-AAG与AFP呈负相关(r=0.147,P<0.05),与TP、Alb、A/G比值、GGT、TB、DBil、ALT、AST、RBC计数、Hb、糖类抗原(carbohydrate antigen,CA)19-9均无相关性(r值分别为0.040、0.039、-0.017、0.052、-0.012、-0.031、0.061、0.059、-0.094、-0.056、0.001,P>0.05)。
2.5 不同肿瘤大小和TNM分期HCC患者血清DSA-AAG和AAG水平的比较
将HCC按直径分为小肝癌(直径<5 cm,106例)和大肝癌(直径≥5cm,112例),大肝癌血清AAG水平高于小肝癌(P<0.001),而血清DSA-AAG水平二者之间差异无统计学意义(P>0.05)。将HCC患者按TNM分期分为T1期(65例)、T2期(74例)和T3+T4期(79例),T3+T4期患者血清AAG水平显著高于T1、T2期患者(P<0.001),不同分期患者之间血清DSA-AAG水平差异均无统计学意义(P>0.05)。见表6。
2.6 AFP阴性HCC患者与非癌症者血清DSAAAG水平的比较
220例HCC中有90例(40.9%)患者血清AFP为阴性(<20 ng/mL)。将肝硬化患者、CHB患者、正常对照者合并为非癌症组。AFP阴性HCC组血清DSA-AAG和AAG水平均高于非癌症组(P<0.001、P<0.05)。见表7。
表6 不同肿瘤大小和TNM分期HCC患者血清DSA-AAG和AAG水平的比较 ±s

表6 不同肿瘤大小和TNM分期HCC患者血清DSA-AAG和AAG水平的比较 ±s
项目 DSA-AAG(A值) AAG/(g/L)肿瘤大小/cm<5 0.47±0.08 0.53±0.22≥5 0.47±0.07 0.73±0.33 TNM分期T1期 0.47±0.07 0.58±0.27 T2期 0.47±0.09 0.52±0.22 T3+T4期 0.47±0.06 0.78±0.33
表7 AFP阴性HCC组与非癌症者血清DSA-AAG、AAG水平的比较 ±s

表7 AFP阴性HCC组与非癌症者血清DSA-AAG、AAG水平的比较 ±s
注:与非癌症组比较,*P<0.05、**P<0.001
组别 DSA-AAG(A值) AAG/(g/L)AFP阴性HCC组 0.48±0.09** 0.60±0.28*非癌症组 0.43±0.10 0.52±0.29
2.7 DSA-AAG及AAG单项及联合检测诊断HCC的效能
采用Logistic回归分析建立DSA-AAG、A A G和A F P联合检测鉴别诊断H C C与非HCC的模型为LogitAAG1=6.578×DSA-AAG+1.445×AAG+0.013×AFP-3.258。ROC曲线分析结果显示,DSA-AAG、AAG及AFP单项和联合检测模型LogitAAG1鉴别诊断HCC与非HCC的曲线下面积(area under curve,AUC)分别为0.651、0.632、0.803和0.836,LogitAAG1的准确性(74.9%)高于DSA-AAG(63.9%)和AAG(57.0%),与AFP(74.0%)相当,敏感性最高的是DSA-AAG(85.4%),特异性最高的是AFP(84.8%)。见表8和图3。
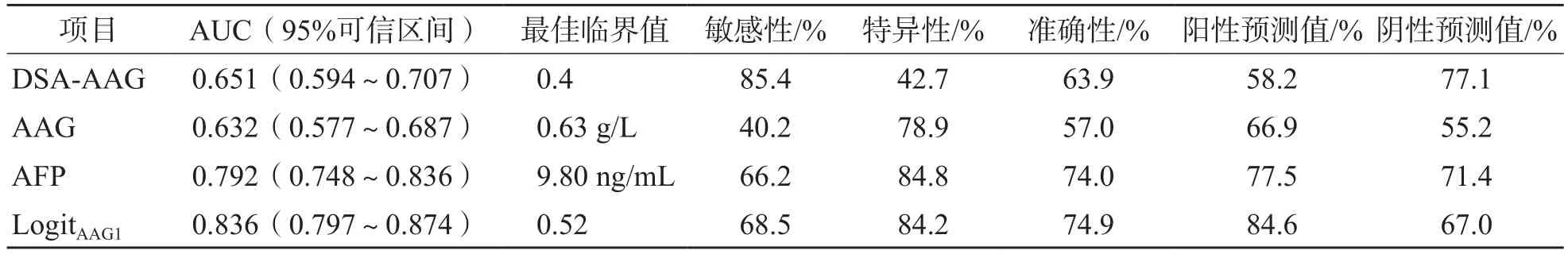
表8 DSA-AAG、AAG及AFP单项和联合检测模型LogitAAG1鉴别诊断HCC与非HCC的效能
采用Logistic回归分析建立DSA-AAG、Alb和TB联合检测鉴别诊断AFP阴性HCC与非HCC的模型为LogitAAG2=6.912×DSA-AAG-0.126×TB-0.193×Alb+6.417。ROC曲线分析结果显示,DSA-AAG、AAG单项和联合检测模型LogitAAG2鉴别诊断AFP阴性HCC与非HCC的AUC分别为0.669、0.607、0.929,LogitAAG2的诊断效能优于DSA-AAG和AAG单项检测。见表9和图3。
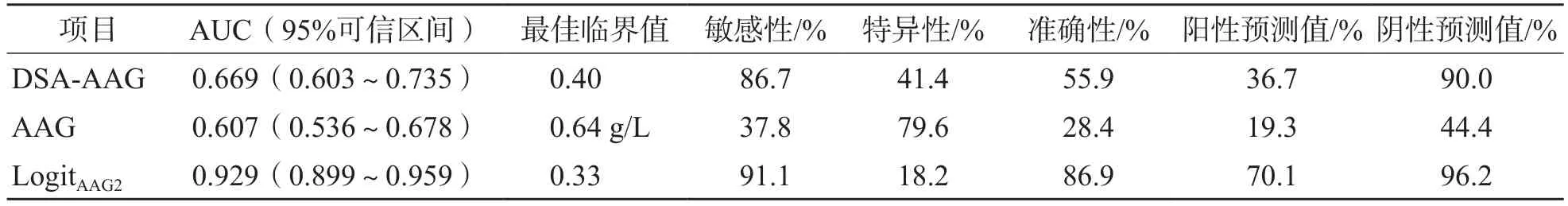
表9 DSA-AAG、AAG单项和联合检测模型LogitAAG2鉴别诊断AFP阴性HCC与非HCC的效能

图3 各项指标单项及联合检测诊断HCC的ROC曲线
3 讨论
糖基化是一种重要的蛋白质翻译后修饰,血清中有50%~70%的蛋白为糖基化修饰蛋白[19]。糖基化修饰在很多关键的生物学过程中起重要作用,如细胞的生长、分化、黏附以及分子运输和清除、受体激活、信号转导、内吞作用等,对维持蛋白质结构稳定及其生物学功能同样起着重要作用,同时还直接参与疾病的病理生理过程[20]。肝脏是体内除B细胞外最重要的糖基化修饰部位[21]。AAG是由肝细胞合成并分泌的急性时相反应蛋白,其糖基化改变与肝脏疾病具有密切关联。DSA-AAG代表的是血清中能与DSA特异性结合的AAG,即含有多天线糖链结构的AAG。
目前,临床上常用的肿瘤标志物大部分为糖蛋白,如AFP、CEA、前列腺特异性抗原(prostate-specific antigen,PSA)、CA19-9、CA125等。在肿瘤发生、发展过程中,糖蛋白会出现异常糖基化修饰[22],因此异常糖基化肿瘤标志物也成为新的研究热点。大多数经异常糖基化修饰的蛋白质位于细胞膜上或直接被分泌到血清中,血清中的聚糖结构通常很稳定,这使得将血清作为样本检测异常糖基化修饰蛋白成为可能。目前已有异常糖基化肿瘤标志物成功地应用于临床:2005年,美国食品与药品监督管理局(U. S. Food and Drug Administration,FDA)批准核心岩藻糖基化的AFP,即甲胎蛋白异质体用于临床。我国原发性肝细胞癌诊疗规范(2017版)也指出:血清AFP及其异质体是诊断肝癌的重要指标和特异性最强的肿瘤标志物,常用于肝癌的普查、早期诊断、术后疗效监测和随访,且有助于鉴别肿瘤的来源[23]。因此,聚焦于异常糖基化改变为发现敏感性和特异性更高的肿瘤标志物提供了一个新的思路。
然而,由于聚糖结构的高度复杂性,给异常糖基化蛋白质的研究和临床应用带来了一定的困难。随着高效液相色谱(high-performance liquid chromatography,HPLC)、毛细管电泳(capillary electrophoresis,CE)、质谱(mass spectrometry、MS)等技术的应用,人们对聚糖结构有了更全面的认识[24]。在寻找异常糖基化肿瘤标志物的过程中,凝集素发挥着重要的作用。凝集素是一类特殊的蛋白质或糖蛋白,能识别特定糖链结构并与之非共价、可逆地结合。许多凝集素,尤其是植物凝集素,成为糖复合物研究中的重要工具[22]。
酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)省去了分离和富集单个蛋白的繁琐步骤,方法简便、敏感、易于标准化,可实现大批量样本的检测。DSA能特异性识别多天线糖链结构。通过基于DNA测序仪的荧光糖电泳技术对IgG的N-糖链结构图谱进行研究,结果显示IgG分子不含多天线糖链结构[25]。因此将DSA与ELISA联用建立的Lectin-ELISA方法可避免抗体分子自身糖链结构对检测的干扰,又具有常规ELISA的特点。
本研究构建了检测血清DSA-AAG的Lectin-ELISA,并对该方法的检测性能进行了初步评价。由于目前尚无关于正常人血清多天线糖链结构AAG水平的相关报道,同时也缺乏相关的标准品,因此本研究以健康人混合血清替代标准品进行检测。为尽量减少检测过程中非特异性结合对结果产生的干扰,在预实验中,本研究尝试了多种血清稀释液,结果显示LowCrossbuffer对降低本底和非特异性干扰的效果比其他稀释液更明显,因此采用LowCross-buffer作为血清样本稀释液。同时设置空白对照,计算时扣除本底,以此来减少非特异性结合的干扰。有研究结果显示,HCC患者血清AAG岩藻糖基化和唾液酸水平升高[16,26]。本研究结果显示,HCC患者血清DSA-AAG水平高于疾病对照组和正常对照组(P<0.001),癌症组血清DSA-AAG水平高于非癌症组(P<0.001)。因此,AAG多天线糖链结构的改变与肝癌的发生可能具有潜在联系。HCC患者血清DSA-AAG水平高于ICC患者(P<0.001),提示DSA-AAG的产生可能与肿瘤细胞的来源也具有一定的关系。MEHTA等[27]的研究结果显示,肝癌组织中DSA结合的三、四天线结构的糖链水平显著高于癌旁组织(P<0.001)。本研究结果还显示,不同肿瘤大小和分期的HCC患者之间血清DSA-AAG水平差异均无统计学意义(P>0.05)。因此,DSAAAG可能与肿瘤的进展、侵袭等生物学行为无关。ROC曲线分析结果显示,DSA-AAG、AAG和AFP的联合检测模型LogitAAG1对鉴别诊断HCC与非HCC具有较高的价值。本研究中AFP阴性的HCC患者占HCC患者的40.9%。目前,AFP阴性的HCC患者尚缺乏可靠的实验室诊断指标。本研究结果显示,AFP阴性HCC组血清DSAAAG水平显著高于非癌症组(P<0.001),DSAAAG、Alb与TB的联合检测模型LogitAAG2鉴别诊断AFP阴性HCC与非HCC的AUC达0.929,这为AFP阴性HCC的鉴别诊断提供了一个较好的血清学诊断指标。
本研究采用Lectin-ELISA检测血清DSAAAG水平,结果显示HCC患者血清DSA-AAG水平显著升高,与本实验室前期基于DNA测序仪的荧光糖电泳得到的HCC患者血清N-糖链结构图谱一致,图谱中代表多天线糖链结构的峰值显著升高[25]。HCC患者血清多天线糖蛋白水平升高可能与肝癌组织中合成多天线结构相关的糖基转移酶升高,导致肝癌细胞分泌的蛋白糖链分枝增加有关[28],其具体机制还有待进一步研究。
综上所述,DSA-AAG及联合检测模型对HCC以及AFP阴性HCC的鉴别诊断可能有一定价值。但现阶段的研究缺乏独立验证及跟踪随访数据,因此尚不能评估以上指标在治疗前、后的变化情况及在预后判断中的价值。此外,由于标准品的缺乏,现阶段暂时难以进行Lectin-ELISA灵敏度及准确性的相关研究,这也是Lectin-ELISA的局限所在,因此该方法还有很大的改善空间。后续将依托上海东方肝胆外科医院多中心分子诊断合作平台进一步收集各期HCC患者术后的血清样本,完善跟踪随访数据,并进行多中心验证,为后续的临床转化和应用奠定基础。
