初诊食管癌患者生物电阻抗相位角与营养状况的关系研究*
2020-12-03周红邓明珍李亚玲缪艳罗稀韩泳涛
周红,邓明珍,李亚玲,缪艳,罗稀,韩泳涛
610041 成都,四川省肿瘤医院·研究所, 四川省癌症防治中心, 电子科技大学医学院 胸外科一病区
中国是全球食管癌发病率和死亡率较高的国家之一,全球新发食管癌病例中超过一半在中国[1-2]。因肿瘤消耗及食管癌病变部位的特殊性,食管癌是营养不良发生风险最高的恶性肿瘤[3],且约20%的食管癌患者死于营养不良和营养不良导致的相关并发症[4]。因此对初诊食管癌患者进行有效的营养状态评估并及时给予科学的营养支持治疗对食管癌患者的预后十分重要。相位角(phase angle,PA)是由生物电阻抗技术测得的营养不良最敏感的指标之一,它反映细胞膜的完整性和细胞外与细胞内空间之间水分分布情况,并以此协助早期评定疾病相关营养不良[5]。目前,在国外已有研究将PA用于评估患者的营养状态及预测临床结局,尚未见PA在食管癌患者中的相关研究报道[6-7]。国内有学者探讨在肝硬化、血液透析及食管癌手术患者中PA与营养状况及临床结局的关系[8-11]。本研究主要探讨PA与初诊食管癌患者营养状况的相关性,为早期识别食管癌患者营养风险提供依据。
1 资料与方法
1.1 一般资料
本研究采用方便抽样法,于2019年2月至2019年8月期间,将在四川省肿瘤医院就诊的食管癌患者纳入为调查对象。纳入标准:1)经病理学诊断为食管癌;2)未进行手术及放化疗的首诊患者;3)意识清晰,能够进行日常言语交流;4)同意加入本研究。排除标准:1)有认知功能障碍;2)合并有其他恶性肿瘤的患者;3)安装心脏起搏器或动脉支架术后的患者;4)四肢不健全的患者。
1.2 方法
1.2.1 患者基本情况指标 包括一般人口学资料(年龄、性别)和疾病相关资料(肿瘤部位、疾病分期、受教育程度)。
1.2.2 体格测量 入院24小时内进行体格测量。测量患者身高、体重,计算体质指数(body mass index,BMI),BMI=体重(kg)/[身高(m)]2。BMI分组:BMI<18.5为偏瘦,18.5≤BMI<24为正常,24≤BMI<28为超重,BMI≥28为肥胖[12]。
1.2.3 人体成分测定 入院48小时内进行人体成分测定。本研究采用韩国InbodyS10多频率生物电阻抗法(direct segmental multi-frequency bioelectrical impendance analysis,DSM-BIA)人体成分分析仪测定人体成分,由接受过统一正规操作流程培训的营养师完成测量。患者在进食2小时后排空大小便,着单衣,赤脚,躺在检查床上,输入患者性别、年龄、身高等信息后通过手和脚上的8个触碰式电极进行测量,保持室温20℃~25℃。测量指标包括:细胞内水分(intracellular water,ICW)、细胞外水分(extracellular water,ECW)、节段肌肉(右上肢、左上肢、右下肢、左下肢)、脂肪组织、去脂组织(fat free mass,FFM)、体脂百分比(percentage body fat,PBF)、身体总水分(total body water,TBW)、身体细胞含量(body cell mass,BCM)、内脏脂肪面积(visceral fat area,VFA)、PA(生物电阻抗50kHz)、浮肿指数(ECW/TBW)。 计算四肢骨骼肌指数(appendicular skeletal muscle mass index,ASMI),ASMI=四肢骨骼肌质量(kg)/[身高(m)]2。依据亚洲肌肉减少症工作组(Asian Working Group for Sarcopenia,AWGS)专家共识中DSM-BIA评测结果:男性<7.0kg/m2,女性<5.7kg/m2为异常[13]。根据Kyle标准[14],男性PA<5°、女性PA<4.6°(生物电阻抗50kHz)定义为低PA,将患者分为正常PA组和低PA组。
1.2.4 患者主观整体营养评估量表(patient-generated subjective global assessment,PG-SGA) 入院6小时内完成PG-SGA评估。 PG-SGA是专门针对肿瘤患者设计的特异性营养评估方法,能主观反映患者营养相关症状与需求[15]。PG-SGA由患者自我评估和医务人员评估两部分组成,第一部分主要内容为体重、饮食、症状、 体征、活动和功能,由患者自己评估;第二部分主要内容包括疾病、年龄、代谢应激状态、体格检查,由医务人员评估。总分0~1分为营养良好,2~3分为可疑营养不良,4~8分为中度营养不良,≥9分为重度营养不良。
1.2.5 预后营养指数(prognostic nutritional index,PNI) 由血清白蛋白和外周血淋巴细胞计数计算得出,能客观反映患者的营养状态和免疫水平[16-18],计算公式为:PNI=血清白蛋白值(g/L)+5×外周血淋巴细胞总数(×109/L)。根据患者入院24小时内抽血检查结果计算患者PNI,参照Onodera等制定的标准将患者分为营养良好组(PNI≥45)和营养不良组(PNI<45)[17]。
1.3 统计学方法
资料采用EpiData v3.1录入和管理,使用SPSS 22.0统计分析软件进行分析。统计描述:计数资料采用频率和百分比,计量资料采用均数±标准差;统计推断:两组间比较采用t检验;相关分析采用Pearson相关分析方法,以食管癌患者的营养状况为因变量,预测营养不良的相关营养指标为自变量,将单因素Logistic回归分析有统计学意义的相关营养指标进行多因素的Logistic回归分析;检验水准α=0.05。
2 结 果
2.1 一般资料
本研究共纳入299例患者,排除6例患者合并其他肿瘤,2例患者安装有心脏起搏器,4例患者拒绝参加,最终纳入患者287例。男性234例(81.5%),女性53例(18.5%),平均年龄(63.91±7.95)岁。其中正常PA组216例,低PA组71例。
2.2 正常PA组及低PA组临床资料比较
正常PA组及低PA组临床资料比较见表1,两组患者的性别构成、平均年龄、肿瘤部位、疾病分期及受教育程度方面差异无统计学意义。

表1 患者一般资料比较(n=287)Table 1. General Information of Patients (N=287)
2.3 两组患者PG-SGA、PNI、人体测量及人体成分指标结果比较
食管癌低PA组患者PG-SGA、ECW/TBW高于正常PA组(P<0.05);食管癌低PA组患者PNI、ASMI、BMI、ICW、ECW、FFM、BCM低于正常PA组(P<0.05),两组患者PBF、VFA比较差异无统计学意义(表2)。

表2 不同PA分组患者营养指标比较Table 2. Nutritional Indicators in Patients with Different PA Groups
2.4 PA与营养相关指标的关系
PA与PNI、ASMI、FFM、BMI、ICW、ECW、BCM成正相关(P<0.05);PA与PG-SGA、ECW/TBW、PBF、VFA呈负相关(P<0.05)(表3)。
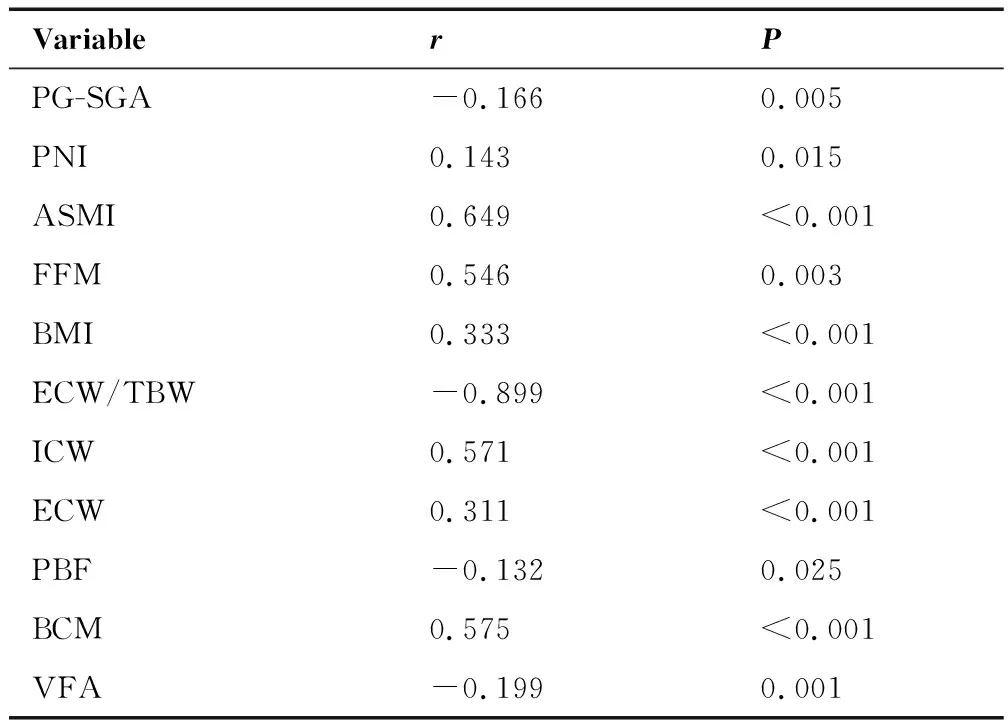
表3 PA与营养相关指标的相关分析Table 3. Correlation between PA and Nutrition-Related Indicators
2.5 食管癌患者发生营养不良的Logistic回归分析
以是否有营养不良(PNI<45)为因变量,各营养指标为自变量进行单因素logistic回归分析,结果显示前白蛋白(prealbumin,PALB)、PG-SGA、PNI、ASMI、BCM、上臂围(arm circumference,AC)、上臂肌肉围度(arm muscle circumference,AMC)、PA可能是初诊食管癌患者营养不良的影响因素(P<0.05)。再将单因素分析中有统计学意义的变量纳入多因素logistic回归模型中进行分析,结果显示PG-SGA(OR=0.920,P=0.001)和PA(OR=5.948,P<0.001)与患者发生营养不良显著相关(表4)。

表4 预测初诊食管癌患者营养不良的Logistic回归分析Table 4. Binary Logistic Regression Analysis of Malnutrition in Patients with Esophageal Cancer
3 讨 论
营养不良是食管癌患者就诊时的主要症状,营养不良影响患者手术预后及放化疗的效果。准确地评估患者营养状况,及时发现营养不良并进行营养干预至关重要。PA是由生物电阻抗分析法测得的容抗和电阻之比的反正切值,是细胞健康的综合指标,可反映细胞的活力及完整性(如细胞形状大小、膜的通透性、细胞间组分)等生物电特性[18]。PA作为营养指标,与人体内的脂肪、总水分和ECW相关,有研究表明, PA能够反映细胞的健康和营养状态,高PA值被认为是细胞增多、细胞膜完整性和更好的细胞功能的良好标志[10,19]。PA值低提示细胞死亡或细胞功能下降,是临床营养不良的标志。
本研究结果显示,低PA组的患者PG-SGA评分高于正常PA组患者,差异有统计学意义(P<0.05),且PA与PG-SGA成负相关,患者PA值越低,PG-SGA评分越高,表明患者的营养状况越差。针对食管癌手术患者及血液透析患者的研究也表明,营养不良患者PA值明显低于营养良好患者,且PA与PG-SGA呈负相关关系[11,20]。Ozorio等[21]的研究结果显示,在胃肠道肿瘤患者中,PG-SGA确定的营养风险与PA有关。PG-SGA作为营养评估的主观指标,能全面反映患者营养状况,在临床研究中已被公认是评估癌症患者营养状况的首选量表,在多个国家和地区被推荐,并且被写入包括澳大利亚、巴西、荷兰[3]、英国[4]和美国等有关肿瘤学的国家营养指南中。PA与PG-SGA密切相关,因此PA也可用于初诊食管癌患者营养状况评估。
本研究对比了低PA组患者与正常PA组患者BMI、ASMI、ICW、ECW、FFM、BCM的差异,结果证实低PA组患者BMI、ASMI、ICW、ECW、FFM、BCM均明显低于正常PA组患者,ECW/TBW高于正常PA组,且差异有统计学意义(P<0.05),相关分析中PA与BMI、 ASMI、ICW、ECW、FFM、BCM均成正相关,与ECW/TBW呈负相关。营养不良的食管癌患者PA倾向于减小,FFM降低是营养不良的明显特征,FFM与PA同时下降,则意味着营养风险增加。有研究显示,身体细胞量反映人体内功能细胞群的数量,是机体进行物质代谢和能量代谢的重要影响因素[22]。本研究中,低PA组患者ICW与ECW明显低于正常PA组患者,ICW的减少反映了机体瘦体组织减少。 PA作为反映细胞外和细胞内空间之间水分布状况的指标,是营养不良最敏感的指标之一[23]。PA是一个反映细胞膜完整性和功能的指标,PA低表明细胞死亡或细胞完整性降低,而PA高则表明大量完整的细胞膜[24]。
PNI由血清白蛋白和外周淋巴细胞总数两项指标计算而来,为客观性营养指标,临床检测方便,是对食管癌患者围手术期营养状态的反映,能预测患者的临床结局[25]。本研究进一步对食管癌营养不良患者(PNI<45)影响因素进行logistic回归分析,发现PG-SGA(OR=0.920,P=0.001)和PA(OR=5.948,P<0.001)与患者发生营养不良显著相关。 低PA的患者营养不良发生率更高。有研究表明PA与患者存活率密切相关,PA低的肿瘤患者其生存期会显著缩短、术后并发症的发生率显著增加[26-27]。且应用PA预测患者的营养状况和监测其疾病进程的能力优于其他血清或营养体检指标,低PA与肿瘤患者、慢性肾功能不全患者、手术患者和艾滋病患者的营养不良、死亡率升高密切相关[28-29]。
综上所述,目前临床上常用的营养评估方法较多,但这些方法的缺点在于其多基于主观因素,例如根据患者的描述食用的食物量,或者可能受混杂变量的影响。而PA省时、可重复性好、测量数据精确不受人体水分变化的影响,本研究中PA截断值是参照kyle标准进行划分,因该标准中不同性别PA截断值不同,方便更加精确地进行分组。本研究结果证实PA与多项营养指标密切相关。低PA可以作为初诊食管癌患者营养不良评估的参考指标,早期识别具有营养风险的患者,从而早期干预,早期改善患者营养状态,继而改善临床结局。但本研究也存在一定的局限性,不同人群的PA截断值会有差异,进一步的研究需通过分析得到本患者群的PA截断值进行分组比较。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
