26S蛋白酶体ATP酶亚基2在非小细胞肺癌患者中的表达及其与预后的关系*
2020-12-03吴伟铭赵天成郭翔杨异
吴伟铭,赵天成,郭翔,杨异
200233上海, 上海交通大学附属第六人民医院 胸外科
肺癌目前仍然是国内外发病率和死亡率最高的恶性肿瘤之一[1],其中约 85%为非小细胞肺癌(non-small cell lung cancer,NSCLC),严重危害国民健康。大多数NSCLC 患者在确诊时已为晚期,失去了最有效的手术治疗机会,而内科治疗中各种化疗方案的客观反应率仅为 25%左右且毒副反应大,因此积极探索肿瘤的发生发展有着重要的临床意义。然而,肿瘤的发生又有着十分复杂的因素。一项针对3 000多例肿瘤的研究表明除驱动癌症增殖的经典基因外,可能还存在着促进癌症发生的56个必要基因,这其中占据首位的就是26S蛋白酶体ATP酶亚基2(proteasome 26S subunit ATPase 2,PSMC2)基因,并且该研究指出PSMC2基因在癌细胞中的一个拷贝频繁丢失,会导致细胞生存危机,同时研究小组在荷瘤(卵巢癌)小鼠中发现 PSMC2表达受到抑制后肿瘤显著缩小[2]。近来更有研究发现其在胰腺癌、肠癌的发生发展中也具有相类似的表现[3-4]。但目前尚无PSMC2蛋白在NSCLC中的表达状况及其临床意义的报道,因此我们进行了相关研究。
1 材料与方法
1.1 临床资料与随访
选取2012年1月至2014年10月在上海交通大学附属第六人民胸外科接受手术治疗的58例NSCLC患者,收集其一般临床资料,并从该院病理科调取这些病例的石蜡标本(癌组织及癌旁组织)。其中男性39例,女性19例。年龄38~78岁,中位年龄64岁。无吸烟史31例,有吸烟史27例,其中吸烟指数(每天吸烟支数×吸烟年数)<400者7例,≥400者20例。肿瘤位于右上叶17例,右下叶6例,右中叶6例,左上叶21例,左下叶8例。中央型22例,周围型36例。肿瘤最大直径0.8~9 cm。术后病理类型:腺癌32例,鳞癌19例,其他类型共7例(大细胞癌3例,低分化癌1例,淋巴上皮瘤样癌1例,肉瘤样癌1例,腺鳞癌1例)。手术后通过电话随访方式了解这58例患者术后生存状况,随访截止日期为2018年7月1日。
1.2 手术情况
该58例NSCLC患者根据术前检查结果和术中探查情况进行了相应的手术治疗。术前检查结果提示患者均能耐受肺部手术,手术方式为右上叶肺叶切除11例、右上叶肺楔形切除2例、右上肺叶支气管袖式切除 2例、右上肺叶+右中肺叶切除1例、右中肺叶切除5例、右中叶肺楔形切除1例,右中肺叶+右下肺叶切除2例、右下肺叶切除4例、右全肺切除1例、左上肺叶切除14例、左上肺叶楔形切除2例、左上肺叶支气管袖式切除1例、左下肺叶切除5例、左下肺叶楔形切除 2例、左下肺叶切除+左上叶肺楔形切除 1例和左全肺切除4例。术后根据2017年12月IASLC(国际肺癌研究协会)发布的第8版TNM分期进行病理分期。其中Ia期10例、Ib期11例、IIa期7例、IIb期6例、IIIa期13例、IIIb期9例、IV期2例。
1.3 实验仪器和材料
倒置荧光显微镜(XDS-100 上海蔡康光学仪器有限公司)、通风橱、微波炉。材料:移液器(P1,P200,P20,P10,GILSONl:4415678,eppendorf):吸头(10 μL ,100 μL ,1 000 μL ,Axygen)。试剂:胎牛血清(10099-141 Invitrogen),1mol/L的TBS缓冲液,0.01M mol/L柠檬酸盐缓冲液(CB,pH6.0,1 000 mL):柠檬酸三钠3 g,柠檬酸0.4 g,3% H2O2溶液。一抗:PSMC2 (ab3322),二抗:goat anti-Rabbit IgG-HRP均来之Abcam。
1.4 方法
取癌组织及癌旁正常组织石蜡标本,常规进行组织切片。脱蜡前,将组织切片在60℃恒温箱中烘烤30 min,置于二甲苯中浸泡30 min,二甲苯∶乙醇=1∶1混液中浸泡10 min,75%~95%乙醇浸泡,蒸馏水浸泡,室温封闭。抗原修复:在微波炉里高火加热以0.01M柠檬酸钠缓冲溶液(pH 6.0)至沸腾后将组织切片放入,低火维持20 min,待自然冷却至室温后,置入蒸馏水浸泡10 min,10%血清(TBS配置)封闭30 min,吸弃血清,加入对应一抗孵育过夜后回收一抗,TBS洗2遍后加入二抗,室温孵育60 min后再以TBS洗涤。加入VULCAN FAST RED CHROMOGEN kit2染色15 min后再加入DAB染色,直至显浅黄色位为止,放入蒸馏水中终止反应,苏木素染色30 s,放入蒸馏水中终止反应,然后依次以乙醇和二甲苯脱水封片,晾干后观察结果。
1.5 免疫组化结果及判定
根据阳性细胞数量和着色强度依次分为 “-、+、++和+++”,其中着色为“-”13例(22.41%),着色为“+”19例(32.76%),着色为“++”16例(27.59%),着色为“+++”10例(17.24%)。以上结果显示PSMC2在多数非小细胞患者的细胞中表达呈阳性(45/58,77.59%),蛋白主要定位于细胞质。以免疫染色作为分组依据,将染色结果为“-~+”定义为PSMC2表达阴性,将染色结果为“++~+++”定义为PSMC2阳性[5],随后进行两组之间的数据统计分析。
1.6 统计学处理
应用SPSS 19.0对实验数据进行统计学处理。计量资料用t检验,计数资料用卡方检验。对数据进行正态性检验,对于非正态分布数据以Mann-Whitney和Kruskal-Wallis方法进行检验,同时对生存状况[(总生存率overall survival,OS)和无疾病进展时间(progression-free survival,PFS)]以Kaplan-Meier方法进行统计分析,以Logisitic回归分析PSMC2的表达与临床病理特征的关系,COX方法进行单因素和多因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者在一般临床资料方面的比较
PSMC2阴性患者与阳性患者的性别构成(P=0.391)和年龄(P=0.743)差异无统计学意义(P>0.05),但PSMC2阳性患者中的吸烟者多于阴性患者,差异有统计学意义(P=0.035),提示吸烟与PSMC2阳性可能存在一定的关联。肿瘤生长部位、胸膜浸润、淋巴结转移和术后病理分期上,两组差异无统计学意义(P>0.05),肿瘤最大直径和肿瘤分化程度上PSMC2阴性组与PSMC2阳性组之间差异有统计学意义(P<0.05)。见表1。
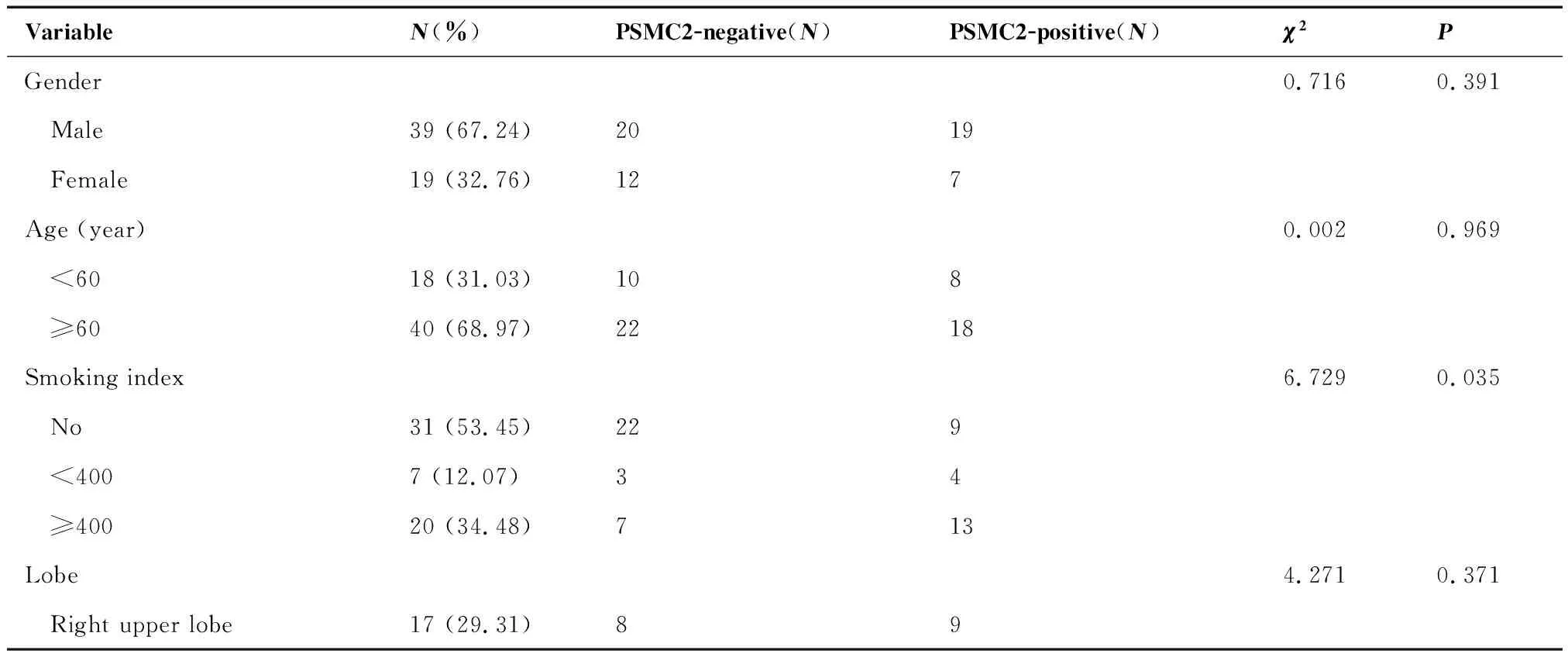
表1 两组患者一般临床资料Table 1. Clinical Data of Patients in Two Groups

(Continued from previous page)
2.2 PSMC2的表达与临床病理参数的关系
根据58例患者的PSMC2标本表达结果与临床病理特点进行Logistic回归分析,发现PSMC2阳性表达仅与肿瘤分化程度有关(P=0.004),余未见明显相关(表2)。

表2 Logistic回归分析PSMC2表达与临床病理特征关系Table 2. Relationship between PSMC2 Expression and Clinicopathological Characteristics by Logistic Regression
2.3 两组患者的生存分析
在OS上,PSMC2阴性组比PSMC2阳性组具有明显的生存优势(P=0.004),见图1。PSMC2阴性组中位OS为62个月,PSMC2阳性组中位生存时间为56个月(HR0.271,95%CI:0.111~0.662)。在PFS上,PSMC2阴性组比PSMC2阳性组具有明显的生存优势(P=0.043),见图2。PSMC2阴性组的中位PFS为48个月,PSMC2阳性组中位PFS为45个月(HR 0.421,95%CI0.182~0.975)。

图1 两组患者的OS曲线Figure 1. Overall Survival in the PSMC2-Negative Group and the PSMC2-Positive Group

图2 两组患者的PFS曲线Figure 2. Progression-Free Survival in the PSMC2-Negative Group and the PSMC2-Positive Group
单因素分析表明PSMC2阳性表达与OS相关(HR:2.952,CI:1.335~6.525;P=0.007),另外肿瘤的分化程度也与OS相关(HR:2.046,CI:1.210~3.461;P=0.008),见表3。进一步多因素分析发现,仅PSMC2与OS相关,或可作为独立的预后因子(HR:3.165,CI:1.439~6.961;P=0.004)。

表3 COX单因素分析Table 3. Univariate Analysis of the Correlation between PSMC2 Expression and Overall Survival of Non-small Cell Lung Cancer Patients
3 讨 论
人体内的正常细胞在各种相关基因的调控下,按照一定的规则和节奏进行生长、分裂和死亡。一旦细胞周期顺序发生异常,就有可能导致肿瘤的发生[6]。细胞周期的正常运行需要通过一系列的蛋白激酶来实现,而这些蛋白激酶又被称之为细胞周期素依赖蛋白(cyclin-dependent kinases,CDK),这是因为只有结合了细胞周期素(cycling)的蛋白激酶才具有真正的生物活性,才能推动细胞周期的进行。一旦细胞周期素本身发生代谢异常,不能被正常的降解,就会长时间地与CDK结合,而所形成的cyclin-CDK复合物,通过CDK活性,将有可能对不同底物磷酸化持续保持相应的生物活性,而导致细胞周期的紊乱[7-8]。
研究发现细胞周期素的降解是通过与泛素结合后再递呈给26S蛋白酶体复合物(26S proteasome)进行识别和降解。26S蛋白酶体复合物是由一个桶形20s核心颗粒和一个或两个19s调节颗粒组成的复合体[9]。而19s调节颗粒是由6个ATP酶(PSMC1、PSMC2、PSMC3、PSMC4、PSMC5、PSMC6)组成的一个亚群,其结构相似,在进化过程中高度保守[10]。从分子组成结构上看PSMC2是构成26S蛋白酶体中的19S调节亚单位的结构之一,它的主要功能是利用ATP水解提供能量,对切掉泛素链的蛋白质底物进行去折叠并转运至20S核心颗粒中进行降解[11],因此PSMC2的变化影响了26S蛋白酶体对cyclin的降解程度从而影响到了细胞周期的正常运行而引发肿瘤的产生[12-16]。由于26S蛋白酶体与肿瘤发生有关的细胞蛋白上起着关键作用,临床上它被作为靶向目标而对癌症进行治疗[17-21]。
既往已有报道PSMC2蛋白在骨肉瘤患者体内表达并且验证了其对骨肉瘤细胞的作用[22]:也有研究报道在40例I~III期胰腺癌患者中有28例患者PSMC2阳性,而同时收集的5例慢性胰腺炎患者均为PSMC2阴性[3]:另外有报道指出在96例结肠癌患者中有51例患者PSMC2高表达,而45例患者为PSMC2低表达,同时73例对照的癌旁组织PSMC2均为低表达[4],以上这些结果均提示PSMC2与肿瘤的发生发展密切相关,然而对于PSMC2在肺癌患者中的表达情况尚未有报道。我们的研究发现NSCLC细胞肺癌患者中PSMC2蛋白也具有不同程度的阳性表达,其阳性表达主要是集中在细胞质中。我们依据PSMC2染色阳性程度强弱不等将这些病例分为了PSMC2表达阴性组和PSMC2表达阳性组,并进一步根据分组的不同比较这两组患者在一般临床资料和肿瘤相关资料上的差异。我们的研究结果显示PSMC2阴性组患者与PSMC2阳性组患者在男女性别构成上、年龄分组上、肿瘤类型、肿瘤生长的位置和部位、胸膜浸润、淋巴结转移、病理类型和病理分期上均无显著差异,提示以上这些方面与PSMC2的表达无相关。但是在吸烟、肿瘤的分化程度和肿瘤最大直径上,两组患者的结果却出现了显著差异,提示PSMC2的表达可能跟这些临床病理参数有关。
本研究发现,PSMC2阳性组中的吸烟者显著多于PSMC2阴性组,且吸烟指数越高,PSMC2阳性者的占比就越大。众所周知,吸烟是肺癌的高危因素。烟草中的多种有害物质可能通过敏感基因激活、DNA损伤修复功能的降低等方面引发肺癌的发生和发展,同时烟草长期对肺组织的破坏会造成慢性炎症和局部组织的缺氧环境,而体内的缺氧会造成高缺氧区和体内低氧分压状态又促进了血管生成因子的分泌增加,形成肿瘤生长和存活[5,23]。但吸烟是怎样造成PSMC2表达的增强,是烟草内成分本身激活还是通过其他因素促进其表达,则需要进一步的实验研究来确定。
肿瘤的最大直径和肿瘤的分化程度体现了肿瘤恶性程度的高低。本研究发现在肿瘤分化的方面,随着肿瘤的分化程度越差,PSMC2阳性患者人数占比也随之增高,提示随着PSMC2的阳性与NSCLC的恶性程度可能有关联。同样的我们发现随着肿瘤直径的不断增大,PSMC2阳性患者所占人数比例也随之提高。该结果提示PSMC2的阳性表达与非小细胞肺癌的恶性程度密切相关,是NSCLC恶性程度的重要标记,同时PSMC2的高表达与癌细胞的增殖有关,可能是癌细胞增殖的重要基因。我们还发现,当肿瘤的最大直径超过7 cm时,PSMC2阳性患者所占比例并没有进一步提高,可能是因为肿瘤过大后出现细胞坏死,从而影响到PSMC2阳性的表达率。而进一步Logistic回归分析结果仅显示出PSMC2的表达与肿瘤的分化程度有关,而与肿瘤的直径大小无关,提示PSMC2可能在肿瘤的分化程度中起作用。
本研究还发现,无论在OS还是在PFS上,PSMC2阴性患者与PSMC2阳性患者的生存曲线均出现明显差异,PSMC2阴性组患者的生存情况显著优于PSM2阳性患者,提示PSMC2的阳性表达是NSCLC患者不良预后的标志。而在其他研究发现对于96例肠癌患者中比较了PSMC2表达阳性与表达阴性的生存差异,发现PSMC2阴性患者要好于PSMC2患者(P=0.009)[4],而在骨肉瘤患者的研究中发现PSMC2阳性与肿瘤的恶性程度密切相关[21],而针对靶向PSMC2的miR-630研究发现,低表达的miR-630导致PSMC2表达增高,并导致患者生存低于因miR-630高表达而PSMC2表达降低患者[24]。COX单因素分析显示PSMC2阳性表达和肿瘤的分化程度与患者的不良预后有关,而进一步的多因素分析显示PSMC2是独立的患者预后相关因素,其阳性表达与NSCLC的不良预后相关,有望成为NSCLC不良预后结局的潜在分子标志物。
总之,我们的初步研究发现PSMC2在NSCLC患者体内也有不同程度的表达,并且这种表达与肿瘤的恶性程度密切相关,同时PSMC2表达阳性的患者具有不良的生存预后,提示我们可以将其作为辅助诊断和判断预后的标志,积极研究其可能参与的信号通路而从中干预,可能会改善这一部分患者的预后。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
