苦参碱减轻阿霉素致心肌细胞凋亡作用的研究①
2020-12-02王倩倩卢均坤王燕琴
王倩倩,卢均坤,王燕琴
(1.佳木斯大学,黑龙江 佳木斯 154007;2.湛江市第一中医院,广东 湛江 524043;3.佳木斯大学校医院,黑龙江 佳木斯 154007)
阿霉素是临床应用广泛的化疗药物,在临床中被广泛应用于恶性肿瘤的治疗,但因其剂量依赖性的心肌损伤而限制了临床应用,阿霉素通过氧化应激、DNA损伤、心肌纤维化、细胞凋亡等导致心肌损伤[1~3]。蒽环类药物引起的心脏毒性可以分成急性、慢性和迟发性心脏毒性,多数患者在蒽环类药物给药后可较快地发生心肌损伤,且随着时间的延长愈加明显[4]。在给予蒽环类药物的数年后,超过50% 的患者可发生左心室组织和功能亚临床心脏超声变化,并且蒽环类药物没有绝对的“安全剂量”[5]。
研究显示线粒体呼吸链复合物I不仅产生ATP,而且在细胞凋亡中起重要作用。丛生蛋白(CLU)的过表达减轻了六价铬[Cr(VI)]诱导的线粒体呼吸链复合物Ⅰ抑制、ROS积累、线粒体通透性转换孔(MPTP)开放和线粒体膜电位(MMP)塌陷,CLU诱导的线粒体呼吸链复合物I活性增加对Cr(VI)诱导的L-02肝细胞细胞毒性具有保护作用[6]。研究表明,DOX诱导MMP耗竭和MPTP开放,从而导致能量稳态紊乱,线粒体肿胀,外膜破裂,并促凋亡介质释放[7]。
苦参碱是中国传统的中药,苦参碱及其衍生物有广泛的药理作用,被广泛应用在抗肝炎、抗肝纤维化[8],治疗癌症[9]、抗病毒[10],治疗心血管疾病等[11],苦参碱能够减轻放射性损伤的器官损伤[12]。苦参碱能够显著减轻心力衰竭患者心室结构重构、降低谷草转氨酶水平、乳酸脱氢酶水平、显著提高心力衰竭大鼠的射血分数,减轻心肌细胞凋亡[13]。既往研究中我们发现150mg/L苦参碱对阿霉素引起的心肌细胞凋亡具有显著的保护作用[14]。因此本实验继续通过制备阿霉素致H9c2心肌细胞损伤的体外模型,给与苦参碱预处理,研究苦参碱在阿霉素致H9c2心肌细胞损伤中的凋亡、线粒体膜电位及线粒体呼吸链复合物I的影响。
1 材料
1.1 细胞
H9c2细胞系是大鼠心肌细胞系(购买自中国科学院上海生命科学研究所),H9c2心肌细胞的正常生长条件是:37℃,5%CO2培养箱,含10%胎牛血清的DMEM培养基,细胞贴壁生长。
1.2 药品和试剂
注射用苦参碱(山东瑞阳药业有限公司,规格0.15g/支),注射用阿霉素(浙江海正药业有限公司,规格10mg/支),Hoechst染色试剂盒,线粒体膜电位检测试剂盒(JC-1)均购自碧云天生物技术公司。线粒体呼吸链复合物Ⅰ购自苏州科铭生物技术有限公司。
2 方法
2.1 细胞培养
H9c2心肌细胞用含10%胎牛血清的DMEM培养液培养,细胞铺满培养瓶80%时,弃培养基,2~5mL PBS液冲洗两遍,加0.25%胰蛋白酶700μL,消化30s后,细胞开始脱离瓶壁时,加入5mL培养基终止消化,按适当比例分到新的培养瓶中,按照细胞培养方法继续培养,培养至2~3代细胞进行分组试验。
2.2 细胞生存率检测
如2.1进行分组加药处理,每组设6个复孔,作用24h后,抽出培养液,PBS洗涤一次,将2mL MTT溶剂加入20mL完全培养液中,充分混匀,每孔加200μL,放入培养箱孵育4h 后抽出,每孔加150μL DMSO。酶标仪测各孔480nm波长处的光密度(OD)。MTT法检测单独阿霉素、单独苦参碱、苦参碱+阿霉素、空白对照组的细胞生存率,绘制生存率曲线,并进一步确定苦参碱的浓度范围,细胞生存率=给药组OD/空白对照组OD×100%。
2.3 分组设置及给药方式
空白对照组:接受生理盐水作为干预因素;阿霉素组:接受浓度1.0mg/L阿霉素作为损伤模型;阿霉素+苦参碱组:给与浓度150mg/L的苦参碱3h后再接受浓度1.0mg/L阿霉素;苦参碱组:接受浓度150mg/L苦参碱作为干预因素,放至37℃,5%CO2培养箱中孵育24h,进行下一步试验。
2.4 细胞凋亡检测
取无菌盖玻片置于六孔板中,将H9c2心肌细胞接种于六孔板中,调细胞浓度为1.1×105个/mL,每孔3mL,培养过夜,如2.3进行分组加药处理,作用24h后,吸去旧培养液,按照细胞凋亡-Hoechst染色试剂盒说明书进行染色。Hoechst 33258染色后,在荧光显微镜下观察,正常细胞的细胞核呈正常的蓝色,而凋亡细胞的细胞核会呈致密浓染,或呈碎块状致密浓染,颜色发白。
2.5 线粒体膜电位检测
按照线粒体膜电位检测试剂盒(JC-1)说明书进行染色。激光共聚焦显微镜下观察。在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,可以产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,可以产生绿色荧光,线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。
2.6 线粒体呼吸链复合物Ⅰ检测
按照线粒体呼吸链复合物Ⅰ说明书进行操作。复合物Ⅰ(EC1.6.5.3)又称NADH-CoQ还原酶或NADH脱氢酶的主要元素,复合物I催化NADH氧化。广泛存在于动物、植物、 微生物和培养细胞的线粒体中,是线粒体内膜中最大的蛋白复合物。该酶催化一对电子从 NADH 传递给CoQ,同时可使O2还原生成O2-,是呼吸电子传递链上产生 O2-的主要部位。测定该酶活性,不仅可以反映呼吸电子传递链(ETC)状态,而且可以反映活性氧(ROS)生成状态。线粒体复合物Ⅰ能够催化NADH 脱氢生成 NAD+,在酶标仪340nm波长下测定NADH 的氧化速率计算出该酶活性的大小。
2.7 统计学方法
3 结果
3.1 细胞生存率
细胞生存率是在96孔板培养24h,观察细胞生长及死亡情况。结果发现,空白对照组H9c2心肌细胞生长良好,贴壁良好,极少有漂浮死亡细胞(定义为100%)。阿霉素组漂浮死亡细胞较多,同空白对照组有显著差异(P<0.05)。H9c2心肌细胞生存率在阿霉素+苦参碱组同单纯阿霉素组比较有显著差异(P< 0.05),单纯苦参碱组的细胞生长情况良好细胞增值略有增加,同空白对照组比较差异无显著性(P>0.05),见表1。
表1 不同组别H9c2心肌细胞生存率
3.2 细胞凋亡
分别比较不同药物作用于H9c2心肌细胞24h后,与空白对照组比较,阿霉素组细胞凋亡率显著增加(P<0.05),与阿霉素组比较苦参碱+阿霉素组,细胞凋亡率降低(P<0.05)。见图1,表2。

空白对照组 阿霉素组(1mg/L) 苦参碱(150mg/L)+阿霉素组(1mg/L)图1 荧光显微镜观察细胞凋亡染色(×20)
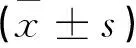
表2 不同组别H9c2心肌细胞凋亡率
3.3 线粒体JC-1膜电位
分别比较不同药物作用于H9c2心肌细胞24h线粒体膜电位,与阿霉素组比较,苦参碱+阿霉素组细胞绿色荧光明显减少(P<0.05)、红色荧光显著增加(P<0.05),与空白对照组比较,阿霉素组心肌细胞绿色荧光显著增多(P<0.05)甚至接近阳性质控指标,说明阿霉素对线粒体膜电位损害严重,各组红色荧光/绿色荧光比率,见图2及表3。
图2 不同组别H9c2心肌细胞线粒体膜电位激光共聚焦JC-1染色(×40)
表3 不同组别H9c2心肌细胞线粒体激光共聚焦JC-1染色情况
3.4 线粒体呼吸链复合物
与空白对照组比较,阿霉素组H9c2细胞线粒体呼吸链复合物I活性下降,差异具有统计学意义(P<0.05)。与阿霉素组比较,苦参碱+阿霉素组心肌细胞线粒体呼吸链复合物I活性显著提高,差异具有统计学意义(P<0.05),见表4。
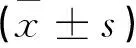
表4 不同组别H9c2心肌线粒体呼吸链复合物Ⅰ活性检测
4 讨论
恶性肿瘤是世界范围内公共健康问题,随着年龄增长,发病率也随之上升,治疗恶性肿瘤常用的化疗药物如蒽环类药物,通常与心脏毒性相关,阿霉素(蒽环类药物)可以引起远期心力衰竭[15]。一项回顾性研究发现,在使用阿霉素累积量达到400、500、和550mg/m2,心力衰竭发生率分别达到5%、16%、26%[16]。尽管阿霉素具有心脏毒性作用,但临床中因为没有更好的替代药物,还是被广泛的应用。因此,发现能够降低阿霉素的心脏毒性作用,并且不影响阿霉素的治疗功能,是我们迫切的任务。阿霉素能特异性与线粒体内膜丰富的心磷脂结合,导致线粒内阿霉素聚集,抑制线粒体呼吸链复合物I和II的活性,破坏电子联传递,进一步促进ROS产生[17]。
在本实验中,我们通过MTT法检测给与阿霉素后H9c2心肌细胞的生存率发现,阿霉素可以导致H9c2心肌细胞生存率大幅度下降。在单纯苦参碱共孵育H9c2心肌细胞时,心肌细胞数量较空白对照组略有增加,这可能是苦参碱促进细胞增殖作用的结果。在苦参碱预处理后再给与阿霉素显著提高H9c2心肌细胞生存率。由此,我们得出结论,苦参碱预处理,能抑制阿霉素对心肌细胞的伤害。
本实验利用细胞凋亡-Hoechst染色法观察H9c2心肌细胞凋亡情况发现,苦参碱能够显著降低阿霉素引起的心肌细胞凋亡,苦参碱的药理作用广泛,临床应用较多,有研究发现苦参碱能显著减轻缺血性脑卒中小鼠的神经细胞凋亡及形态学的损伤,显著降低丙二醛(MDA)的水平,提高超氧化物歧化(SOD)及谷胱甘肽过氧化物酶(GSH-Px)活性[18]。在心力衰竭方面有研究发现[19],苦参碱能够改善心力衰竭大鼠的左室射血分数、减轻心肌细胞凋亡、抑制心肌纤维化。也有研究表明,苦参碱能够减轻左心房心肌纤维化,降低 I、III型胶原蛋白水平,预防心肌梗死后心房纤颤的发生[20]。这些研究,也表明苦参碱在保护阿霉素引起的心肌损伤中,具有重要的理论依据。
氧化磷酸化过程中产生的三羧酸循环在ATP酶作用下产生ATP,储存于线粒体内膜,这些转换不仅形成质子梯度,还形成氢离子的跨膜电势,产生MMP。在正常情况下,维持细胞内的ATP水平和稳定的MMP,对于维持细胞正常生理功能至关重要[21]。阿霉素可以使MMP大幅下降,当线粒体功能障碍时MMP下降,伴随着ROS产生增加、损害ATP的生成,这些在阿霉素引起的中毒性心肌病中尤为重要[22]。在本实验中我们发现,阿霉素可以使线粒体膜电位显著降低,说明线粒体通透性(mitochondria permeability transition,MPT)显著增加,苦参碱显著改善阿霉素引起的MMP下降。
我们的实验进一步发现,H9c2心肌细胞在阿霉素的作用下,线粒体呼吸链复合体物I的活性显著降低,而苦参碱能显著提高因阿霉素损害的心肌细胞线粒体呼吸链复合体物I活性。线粒体呼吸链复合体物I是线粒体呼吸链中第一个也是最大的复合体,线粒体F1F0-ATP合酶利用电子传递链上的线粒体呼吸链复合体物I、线粒体呼吸链复合体物III、线粒体呼吸链复合体物IV所产生的质子梯度,线粒体呼吸链上发生的氧化磷酸化产生ATP,这些复合物活性的改变会导致线粒体电化学梯度和ATP合成的降低[23],有研究在扩张型心肌病以及心肌缺血性疾病中,损害了线粒体呼吸链复合体物的活性,最终引起心力衰竭[24]。阿霉素能够使包括线粒体呼吸链复合体物I和线粒体呼吸链复合体物Ⅱ的活性降低,引起持久的线粒体呼吸链的损害,同时长久阿霉素暴露引起MMP下降[25]。
我们通过实验发现,苦参碱预处理能够显著减轻阿霉素引起的心肌细胞凋亡,其途径可能是苦参碱显著抑制了阿霉素引起的线粒体膜电位下降,提高了线粒体呼吸链复合物I的活性。在今后的实验中我们继续研究苦参碱对大鼠的心肌组织的保护作用。
