紫红曲霉与银杏叶双向发酵研究
2020-12-01解文利方月月吴雨烔周礼红
解文利,方月月,吴雨烔,周礼红
(贵州大学生命科学学院,贵州贵阳550025)
红曲霉作为一种药食两用丝状真菌[1],广泛应用于食品、医药、生物催化等领域。红曲霉能生物合成红曲色素、Monacolin K、黄酮类、类黄酮、γ-氨基丁酸等广泛生理活性物质[2-5],其中Monacolin K是胆固醇合成限速酶羟甲基戊二酸单酰辅酶A还原酶(hydroxymethyl glutarate monoacyl coa reductase,HMG-CoA)的显著抑制剂,用于治疗高胆固醇血症和高脂血症[6],含有的γ-氨基丁酸具有降血压的作用,并且是大脑的一种化学传递物质,可以调节大脑兴奋与抑制等作用[7-9]。
双向发酵是指用真菌为发酵菌株,以中药材作为药性基质,该基质在为真菌提供营养物质的同时,又与真菌在生长过程中产生的各种代谢产物相互作用、相互影响,从而产生新的性味功能,使整个发酵具有双向性[10-12]。双向发酵后的菌质相对于原药材主要有几个方面的优势:提高提取效率、减轻毒性、产生新的有效成分、增强药效[11,13]。银杏叶具有多种活性物质,其中的黄酮和内酯类化合物,具有降血脂、抗氧化、抗衰老等作用[14-16]。银杏叶与微生物进行共发酵,利用微生物的代谢活动,可起到增强银杏叶中活性成分,降低其毒性成分的含量的作用[17]。任金玫[18]利用冠突散囊菌和银杏毛茶进行共发酵,结果发现毒性成分银杏酸下降了44.6%,活性物质黄酮提高了3.14%。Weihua Qiu等[19]利用漆酶与银杏叶共发酵,发现银杏叶中黄酮含量比未发酵基质提高了24.11%。目前,甚少有红曲霉与银杏叶共发酵的报道,故本试验通过前期筛选得出的银杏叶,以红曲霉为发酵菌种,通过单因素试验和正交设计试验,研究红曲霉-银杏叶共发酵对银杏叶药汁中总黄酮含量以及红曲霉生物量的影响。
1 材料与方法
1.1 材料与试剂
紫红曲霉 3.45-1(Monascus 3.45-1):贵州大学微生物实验室选育;银杏叶Ginkgo biloba:贵州同济堂制药有限公司;葡萄糖、麦芽糖、蔗糖:成都金山化学试剂有限公司;蛋白胨、酵母膏:北京奥博星生物技术有限公司;所用试剂均为分析纯。玉米粉、大米粉、甘薯淀粉、麦麸、米糠、马铃薯淀粉、甘油、花生粉、鱼粉、猪血粉、蚕蛹粉、猪肝粉、黄豆粉:市售;芦丁标品(纯度99%):成都曼斯特生物技术有限公司;沙氏琼脂改良培养基:麦芽糖5 g,蛋白胨10 g,酵母膏5 g,琼脂20 g,葡萄糖20 g,1 000 mL,pH值自然,用于红曲霉斜面培养。药汁培养基(空白对照):称取银杏叶,加适量水浸泡1 h,煮沸30 min,倒出药汁,补加适量冷水于药渣中,再煮沸20 min,倒出药汁。8层纱布过滤,121℃灭菌30 min,作为工艺优化的基本培养基。
1.2 仪器与设备
THZ-82A数显气浴恒温振荡器:金坛市晶玻实验仪器厂;LDZX-50 KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;JJ-CJ-1FD洁净工作台:苏州市金净净化设备科技有限公司;DH-360A电热恒温培养箱:北京科伟永兴仪器有限公司;759紫外分光光度计:上海菁华科技仪器有限公司;TD6M低速多管架自动平衡离心机:长沙高新开发区湘仪贝克仪器仪表有限公司;DP73生物显微镜:日本奥林巴斯公司;GZX-GF-101-2烘箱:上海跃进医疗器械厂。
1.3 方法
1.3.1 孢子悬液的制备
紫红曲霉菌株28℃斜面培养7 d~11 d;用无菌吐温生理盐水洗下孢子,转入装有玻璃珠的无菌三角瓶中,振荡,充分打散孢子,用4层无菌镜头纸过滤除去菌丝,制成终浓度为106cfu/mL的均一孢子悬液,备用。
1.3.2 发酵药汁培养基的制备
将紫红曲霉孢子悬液(106cfu/mL),以10%的接种量接入装有85 mL药汁培养基的250 mL三角瓶中,150 r/min,(28±1)℃培养11 d备用。作为未添加碳源、氮源、生长因子、无机盐发酵药汁的对照组。
1.3.3 发酵条件单因素试验优化
1.3.3.1 碳源确定
分别选取葡萄糖、蔗糖、麦芽糖、玉米粉、大米粉、甘薯淀粉、麦麸、米糠、马铃薯淀粉、甘油10种碳源添加到基本培养基中,添加量均为3%,接种红曲霉,30℃,125 r/min振荡培养11 d,考察不同碳源对总黄酮含量、生物量的影响。
1.3.3.2 氮源确定
分别取有机氮源蛋白胨、酵母膏、花生粉、鱼粉、猪血粉、蚕蛹粉、猪肝粉、黄豆粉(添加量1%);无机氮源NaNO3、(NH4)2SO4(添加量0.2%)为氮源添加到基本培养基中,接种红曲霉,培养条件同1.3.3.1,研究不同氮源对总黄酮含量、生物量的影响。
1.3.3.3 生长因子优化
分别将微量维生素B1、维生素B6、维生素B12、维生素C 4种生长因子添加到基本培养基中,接种红曲霉,培养条件同1.3.3.1,考察不同生长因子对总黄酮含量、生物量的影响。
1.3.3.4 无机盐优化
向基本培养基中分别加入 CaCl2、FeSO4、MnSO4、CuSO4、ZnSO4(添加量为 0.1%)5种无机盐,接种红曲霉,培养条件同1.3.3.1,研究不同无机盐对总黄酮含量、生物量的影响。
1.3.3.5 装液量的优化
向 250 mL 锥形瓶中分别装入 25、40、55、70、85、100 mL基本培养基,接种红曲霉,培养条件同1.3.3.1,考察不同装液量对总黄酮含量、生物量的影响,确定最佳装液量。
1.3.3.6 接种量优化
按照5%、10%、15%的接种量将红曲霉孢子悬液接种于装有85 mL培养基的250 mL三角瓶中培养,确定最佳接种量。
1.3.3.7 发酵时间的优化
在确定最佳装液量、接种量的基础上,将红曲霉接到药汁培养基中,在30℃,125 r/min振荡培养条件下分别培养 8、9、10、11、12、13 d。确定最佳培养时间。
1.3.3.8 初始pH值优化
调节药汁培养基的初始pH值分别为 3、4、5、6、7、8后,接种红曲霉,培养条件及方法同1.3.3.1,确定最佳初始pH值。以上试验均设置3个重复。
1.3.4 正交试验
正交试验采用L18(36)正交表,根据单因素试验结果确定正交试验的因素和水平。选取碳源浓度、氮源浓度、KH2PO4浓度、MgSO4浓度、碳源种类、氮源种类这6个因素为考察因素进行优化,以红曲霉-银杏叶双向发酵后红曲霉生物量及发酵液中总黄酮含量的高低确定最优综合发酵组合。双向发酵正交试验设计因素及水平表见表1。
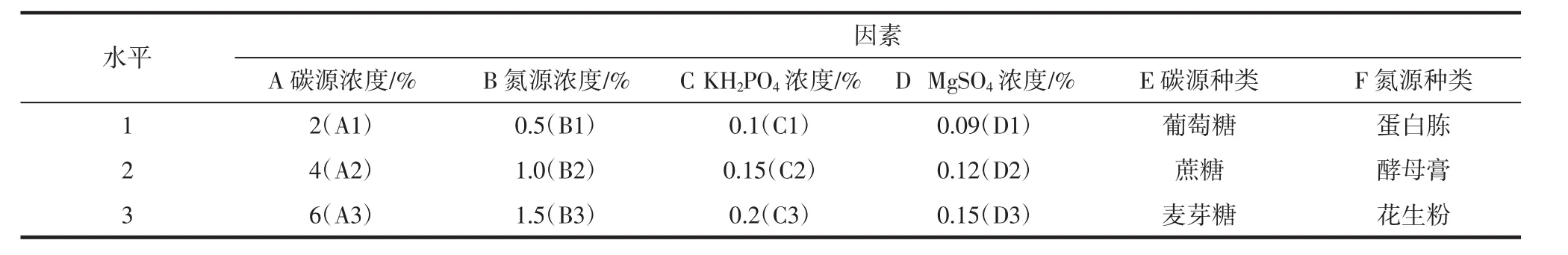
表1 双向发酵正交试验设计因素及水平表Table 1 Factor and level table of orthogonal experiment design of bidirectional fermentation
1.3.5 生物量的测定
将发酵液3 000 r/min离心20 min,弃上清,取沉淀,清水重悬沉淀,再3 000 r/min离心20 min,取沉淀即菌丝体,(60±1)℃烘干至恒重,称重得生物量。
1.3.6 总黄酮的含量测定
1.3.6.1 对照样品的制备
精密称取芦丁对照品10 mg,置25 mL容量瓶中,加80%乙醇溶解,定容即得对照品储备液。
1.3.6.2 芦丁标准曲线的绘制
精密吸取对照品储备液 0、0.5、1.0、1.5、2.0、2.5 mL,分置于25 mL容量瓶中,加1 mL 5%NaNO2溶液,摇匀,放置6 min,再加1 mL 10%Al(NO3)3溶液,摇匀,放置6 min,加4%10 mL氢氧化钠显色[20],以在357 nm处的吸光度A对浓度C(mg/mL)回归,并求得回归方程。
1.3.6.3 样品溶液制备
取银杏叶中药汁16 mL(相当于2.0 g生药),分置于索氏提取器中,用石油醚(60℃~90℃)水浴回流脱脂2次(每次2 h),弃去石油醚提取液。挥干石油醚,置100 mL烧瓶中,用80%乙醇回流提取两次,每次反应时间20 min,提尽黄酮。定量转移入100 mL容量瓶中,加80%乙醇至刻度,摇匀,即得待测样品液。
将对照品储备液1.5 mL和供试品溶液2 mL分置于25 mL容量瓶中,依1.3.6.2的方法进行显色[20],以芦丁为标准溶液,以试剂为空白,用分光光度计在375 nm处测定吸光度,由回归方程求出样品溶液中总黄酮浓度。
1.4 数据处理
采用SPSS Statistics 25软件进行数据分析处理,Origin 2018软件进行绘图。分析结果采用平均值±标准差(x±s,n=3)表示,P<0.05 表示差异显著。
2 结果与分析
2.1 芦丁标准曲线的绘制
在357 nm处以标准溶液浓度(芦丁量)为横坐标,吸光度为纵坐标进行回归分析,得到回归方程:A=29.657X+0.017 5(r=0.999 2)。
2.2 添加不同碳源对红曲霉-银杏叶双向发酵的影响
不同碳源对红曲霉-银杏叶双向发酵的影响见图1。
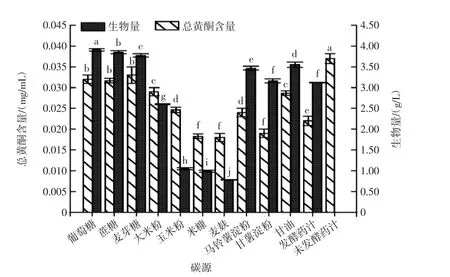
图1 不同碳源对红曲霉-银杏叶双向发酵的影响Fig.1 Effects of different carbon sources on Monascus purpureus-Ginkgo biloba leaves bilevel fermentation
由图1可知,发酵后的银杏叶药汁总黄酮含量均低于未发酵银杏叶药汁,与未添加碳源的发酵药汁相比,当在发酵药汁中添加麦芽糖时,银杏叶药汁中总黄酮含量增加最为显著(P<0.01),总黄酮含量达到(0.033±0.002)mg/mL,其次是添加葡萄糖、蔗糖,总黄酮含量分别提高到(0.032±0.001)、(0.032±0.000 6)mg/mL。在添加米糠、麦麸、甘薯淀粉后,与未添加碳源的发酵药汁相比,发酵液中的总黄酮含量由最初的(0.022±0.001 1)mg/mL 分别降低至(0.018±0.000 6)、(0.018±0.001)、(0.019±0.001)mg/mL。对红曲霉生物量而言,添加葡萄糖、蔗糖、麦芽糖到发酵药汁中,对红曲霉生物量的增加最为显著(P<0.01),而玉米粉、米糠、麦麸的添加不利于红曲霉的生长。总体上,碳源结构越简单,对于红曲霉生物量和发酵液中总黄酮含量的提高效果越明显,这是因为红曲霉可以将多糖转化为可利用的单糖[21-22],但在发酵初期,菌种量少,淀粉酶,纤维素酶的活力低,碳源结构复杂无法满足红曲霉的生长代谢[4],故选择葡萄糖、蔗糖、麦芽糖添加到发酵药汁培养基中。
2.3 添加不同氮源对红曲霉-银杏叶双向发酵的影响
不同氮源对红曲霉-银杏叶双向发酵的影响见图2。
从图2中可以看出,与未发酵银杏叶药汁相比,氮源的添加使发酵银杏叶药汁的总黄酮含量均降低,与发酵银杏叶药汁相比,蛋白胨、(NH4)2SO4、花生粉三者添加到发酵银杏叶药汁时,银杏叶药汁总黄酮含量提高最为显著(P<0.01),分别达到(0.036±0.000 7)、(0.033±0.001 4)、(0.030±0.000 9)mg/mL。与未添加氮源的发酵药汁相比,氮源的添加均能使红曲霉的生物量增加,其中添加蚕蛹粉、NaNO3、花生粉后红曲霉生物量增加最为显著(P<0.01),分别增加(5.26±0.011)、(5.10±0.017)、(4.99±0.007)g/L。有机氮源比无机氮源作氮源添加更有利于红曲霉的生长,可能是因为有机氮源含有红曲霉所需的必需氨基酸[21],由于考虑原料来源、成本、是否适合食用等方面,最终选择蛋白胨、酵母膏、花生粉这3种氮源作为发酵优化的氮源种类。

图2 不同氮源对红曲霉-银杏叶双向发酵的影响Fig.2 Effects of different nitrogen sources on Monascus purpureus-Ginkgo biloba leaves biloba fermentation
2.4 添加不同生长因子对红曲霉-银杏叶双向发酵的影响
不同生长因子对红曲霉-银杏叶双向发酵的影响见图3。
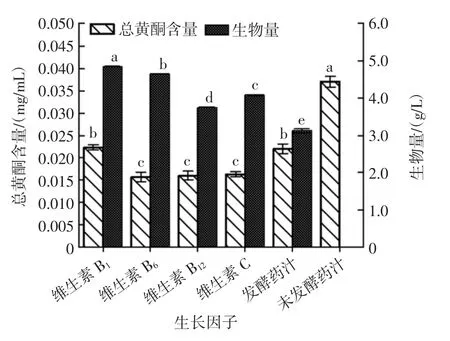
图3 不同生长因子对红曲霉-银杏叶双向发酵的影响Fig.3 Effects of different growth factors on the double fermentation of Monascus purpureus-Ginkgo biloba leaves
由图3可知,添加了维生素B1的银杏叶发酵药汁较未添加生长因子的银杏叶发酵药汁,其总黄酮含量的提高不显著(P>0.05),其它生长因子添加至银杏叶发酵药汁中,总黄酮含量明显低于未添加生长因子的银杏叶发酵药汁。对红曲霉生物量而言,生长因子的添加使生物量均提高,其中维生素B1的添加使生物量提高最为显著(P<0.01)。由最初的(3.12±0.049)g/L 提高到(4.85±0.01)g/L。故选择维生素B1作为发酵药汁培养基的生长因子。
2.5 添加不同无机盐对红曲霉-银杏叶双向发酵的影响
不同无机盐对红曲霉-银杏叶双向发酵的影响见图4。

图4 不同无机盐对红曲霉-银杏叶双向发酵的影响Fig.4 Effects of different inorganic salts on the double fermentation of Monascus purpureus-Ginkgo biloba leaves
由图4可知,与未发酵药汁相比,发酵药汁和添加无机盐的发酵药汁中的总黄酮含量均低于未发酵药汁的总黄酮含量,添加FeSO4时,发酵药汁总黄酮含量提高最为显著(P<0.01),从最初的(0.022±0.001 1)mg/mL提高到(0.031±0.000 8)mg/mL,添加 FeSO4、MnSO4、CuSO4后,红曲霉的生物量较未添加无机盐时显著提高,分别提高到(4.31±0.005 8)、(3.59±0.012)、(4.69±0.006 6)g/L。CaCl2、ZnSO4的添加使银杏叶药汁中红曲霉的生物量减小。鉴于总黄酮含量、生物量的双重考量,最终选择FeSO4作为发酵药汁培养基的无机盐。
2.6 装液量对红曲霉-银杏叶双向发酵的影响
装液量对红曲霉-银杏叶双向发酵的影响见图5。
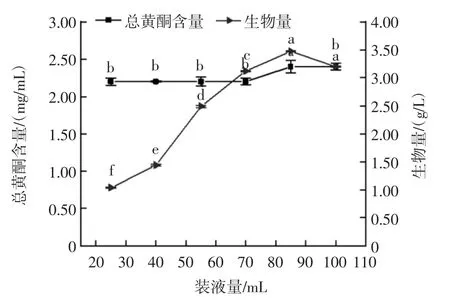
图5 装液量对红曲霉-银杏叶双向发酵的影响Fig.5 Effect of loading amount on double direction fermentation of Monascus purpureus-Ginkgo biloba leaves
如图5所示,当装液量从25 mL逐渐增加到100 mL时,红曲霉生物量一直呈增长趋势,总黄酮含量开始没有明显变化,从70 mL增加到85 mL时,总黄酮含量明显增加,且在装液量为85 mL时生物量的值也达到最大,生物量从最初的(1.04±0.007)g/L升高到(3.47±0.008 1)g/L。从85 mL增加到100 mL时,总黄酮含量不变,生物量减小,原因可能是由于装液量的增加在使摇瓶中养分增加的同时也降低了发酵液中的溶氧,氧气减少成为了发酵的主要限制因素,故生物量减小。综合两者的装液量曲线,在装液量为85 mL时两者产量均最高,故确定85 mL为红曲霉-银杏叶双向发酵的最佳装液量。
2.7 接种量对红曲霉-银杏叶双向发酵的影响
接种量对红曲霉-银杏叶双向发酵的影响见图6。
如图6所示,银杏叶发酵药汁中总黄酮含量随接种量的增大无多大变化。紫红曲霉生物量呈先增大后减小,当接种量为 10%时,生物量(3.12±0.017 1)g/L含量达到最大。随着接种量增大,菌体代谢旺盛,分泌大量胞外酶类,能较好的利用发酵基质,故有利于菌体生长,可以缩短菌体繁殖达到高峰的时间,并且可减少杂菌的生长机会,但是接种量过大,也会导致单位体积内养料和溶氧不足以及消耗的营养物质过多,导致菌的生长受到影响,最终影响产物的合成[23-25]。综合该因素对银杏叶药汁总黄酮含量和红曲霉的生物量的影响,选择10%为最佳接种量。
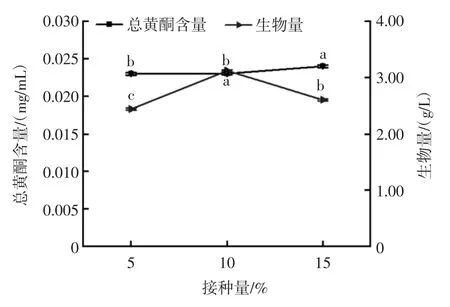
图6 接种量对红曲霉-银杏叶双向发酵的影响Fig.6 Effect of inoculation amount on double direction fermentation of Monascus purpureus-Ginkgo biloba leaves
2.8 培养时间对红曲霉-银杏叶双向发酵的影响
培养时间对红曲霉-银杏叶双向发酵的影响见图7。
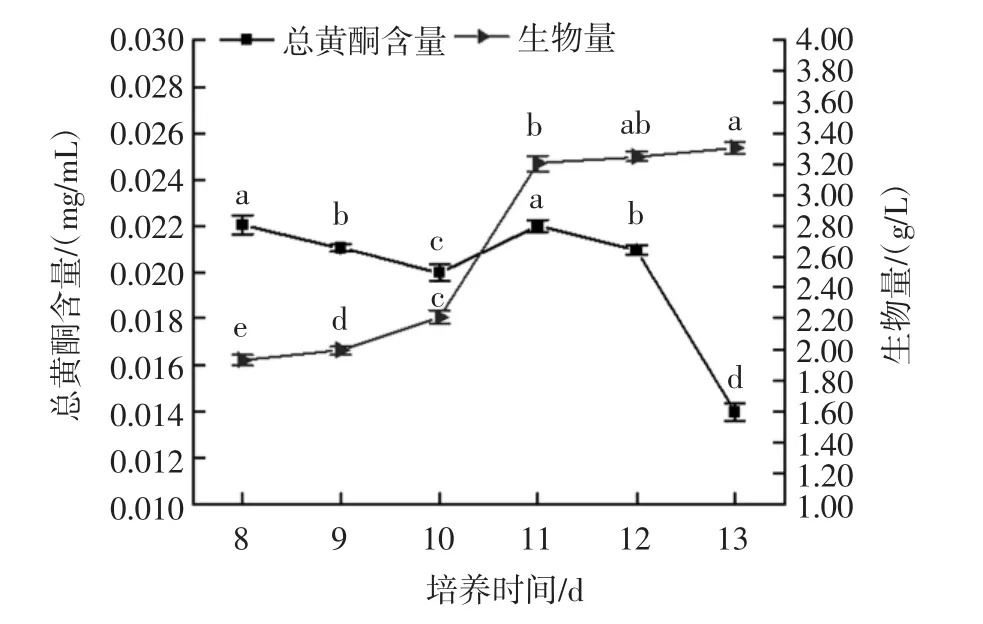
图7 培养时间对红曲霉-银杏叶双向发酵的影响Fig.7 Effects of culture time on the double direction fermentation of Monascus purpureus-Ginkgo biloba leaves
由图7可以看出,从第8天到第12天,总黄酮含量呈先减后增再减的趋势,在11 d时,总黄酮含量又升高到最大值(0.022±0.000 3)mg/mL。然后从12 d到13 d时总黄酮的含量又呈减少趋势。在发酵初期,发酵时间过短,不利于目标产物的积累,发酵时间过长,由于营养物质的消耗及多种代谢产物的积累导致环境不利于菌体生长[26]。红曲霉生物量随培养时间的延长而一直呈上升趋势,在10 d到11 d之间增速是最快的,11 d到13 d增长速度是趋于平缓的。综上分析,将红曲霉-银杏叶双向发酵的最佳发酵时间定为11 d。
2.9 初始pH值对红曲霉-银杏叶双向发酵的影响
初始pH值对红曲霉-银杏叶双向发酵的影响见图8。

图8 初始pH值对红曲霉-银杏叶双向发酵的影响Fig.8 Effect of initial pH on double fermentation of Monascus purpureus-Ginkgo biloba leaves
如图8所示,初始pH值为3时,发酵药汁总黄酮含量和红曲霉生物量都不高,可能是银杏叶药汁中过酸的环境不利于红曲霉生长的原因。在初始pH值调至4~5时,有利于总黄酮含量的提高,且在pH 5时达到最大值(0.022±0.000 8)mg/mL。当 pH>5时,红曲霉的生物量先增后减,而发酵药汁总黄酮含量呈下降后增趋势。经分析,选择初始pH值为5时是红曲霉-银杏叶双向发酵时的最适pH值。
2.10 红曲霉-银杏叶双向发酵培养基的正交试验优化
银杏叶发酵正交试验结果见表2,方差分析结果见表3。
由表2可看出,对总黄酮含量的影响最大的是碳源种类,其次是碳源和氮源浓度,影响最小的是氮源种类,总黄酮含量最高的最优组合是A2B3C1D2E1F3。对生物量影响最大的是氮源浓度,其次MgSO4浓度,影响最小的是氮源种类,生物量最大的最优组合为A2B3C1D2E1F3。由表3可知,碳源浓度、氮源浓度、MgSO4浓度以及碳源种类对总黄酮含量和生物量这两者的影响极显著(F>F0.01),KH2PO4浓度对总黄酮含量的影响显著(F>F0.05),对生物量的影响极显著(F>F0.01),氮源种类对总黄酮含量和生物量的影响都不显著(F<F0.05)。
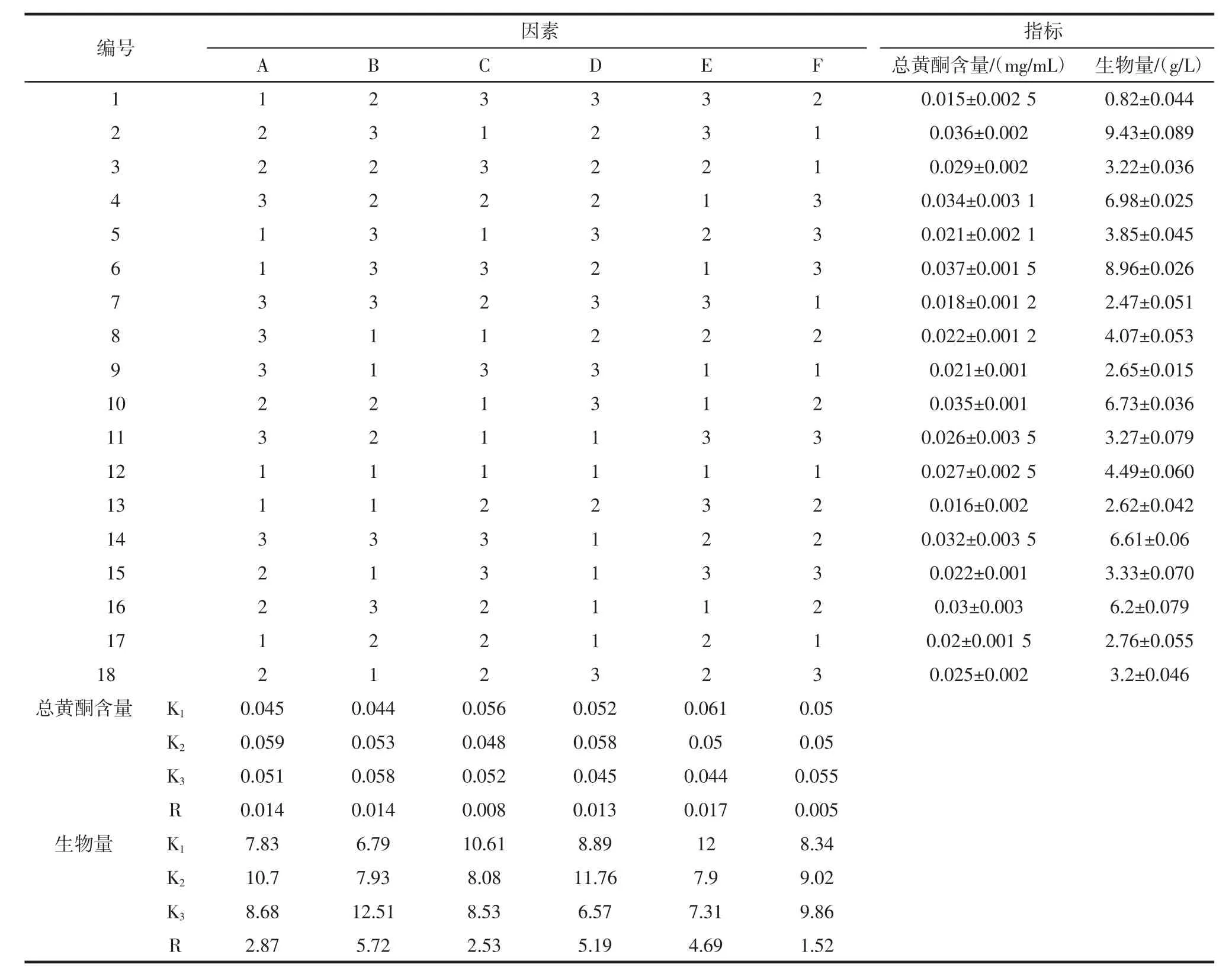
表2 发酵正交试验结果Table 2 The results of orthogonal experimental
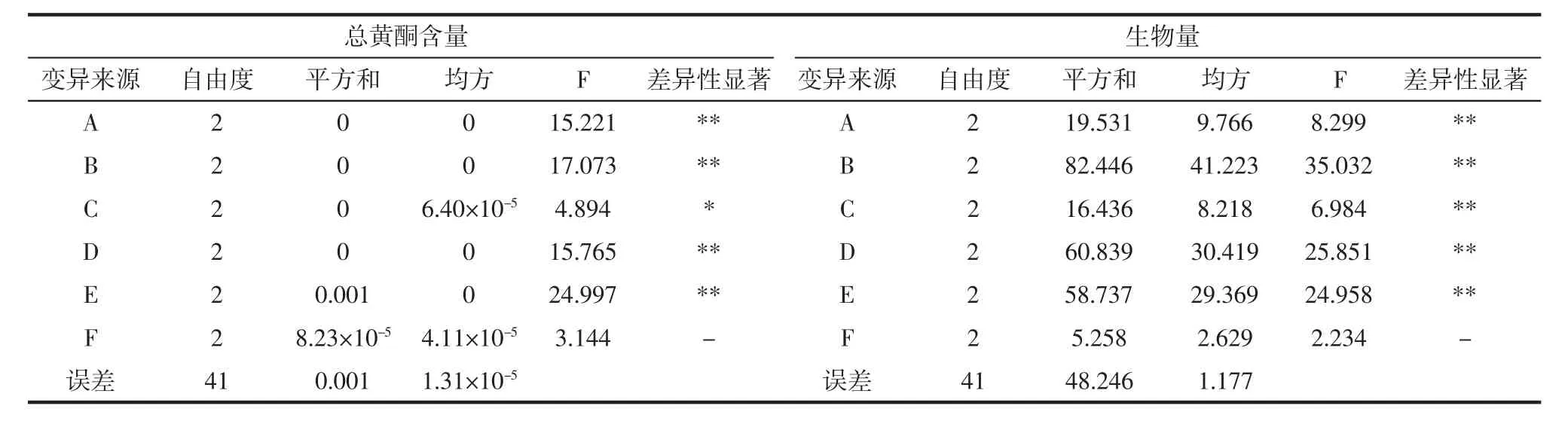
表3 方差分析结果Table 3 Variance analysis results
从表2可以看出,正交试验最佳发酵条件(A2B3C1D2E3F1)和在极差结果中得出的最优组合(A2B3C1D2E1F3)不一致,通过试验进一步验证。即在葡萄糖浓度4%、花生粉浓度1.5%、KH2PO4浓度0.1%、MgSO4浓度0.12%的条件下进行红曲霉和银杏叶双向发酵,对所得发酵液中的总黄酮含量、生物量进行测定,试验重复3次,测定总黄酮含量为0.074 mg/mL、生物量为13.26 g/L,均高于在正交组合中的最大值。因此选取组合A2B3C1D2E1F3为发酵的最优组合。即葡萄糖浓度4%、花生粉浓度1.5%、KH2PO4浓度0.1%、MgSO4浓度0.12%。在此组合下,双向发酵体系中的总黄酮含量比未利用红曲霉发酵的对照组提高了100%;红曲霉生物量比未优化前的对照组提高了76.47%。发酵体系中总黄酮含量的升高,可能是红曲霉能利用银杏叶药汁中的某些物质,经过代谢转换成黄酮或萜内酯类[27-28]。辛燕花等[29]利用灵芝与银杏叶进行双向液体发酵,发现与未发酵的银杏叶相比黄酮类物质明显增加,赵林果等[30]将银杏叶与黑曲霉进行双向固体发酵,发现银杏叶通过微生物代谢转化后总黄酮含量提高5.77%。
3 结论
以银杏叶药汁中的总黄酮含量和红曲霉生物量为指标,通过单因素试验和正交试验,获得的最佳发酵组合为葡萄糖浓度4%、花生粉浓度1.5%、KH2PO4浓度0.1%、MgSO4浓度0.12%,在此优化组合下,银杏叶发酵药汁的总黄酮含量为0.074 mg/mL,红曲霉生物量为13.26 g/L。银杏叶药汁中总黄酮含量的增加,可能是红曲霉产生的庞大酶系可以搭建起药性基质里更多活性物质合成的途径,另外,在发酵过程中,微生物的代谢作用可能将其他成分转化为黄酮类物质。
