不同处理对采后油茶果油体形态及含油率的影响
2020-12-01吴建文黎贵卿关继华汤星月杨素华邱米李秋庭陆顺忠黄湘颖
吴建文,黎贵卿,关继华,汤星月,杨素华,邱米,李秋庭,陆顺忠,黄湘颖,*
(1.广西壮族自治区林业科学研究院,广西南宁530002;2.广西大学轻工与食品工程学院,广西南宁530004)
在植物中,脂类物质以三酰甘油酯的形式存储在被称为油体或油质体的球形细胞器中,外围由单层磷脂分子和独特的油体蛋白构成[1]。内质网负责三酰甘油酯的合成并最终形成油体[2]。化学和超微结构分析表明油体外层磷脂分子的疏水酰基与油体内侧的三酰甘油相互作用,而亲水头部基团则与油体外的细胞液进行接触[3]。油体蛋白由N端两性区、中间高度疏水区和C端构成,其中中间疏水区可形成极为保守的发卡结构[4]。油体蛋白对维持油体的稳定性和油体的大小具有重要作用[5]。不同植物的油体大小不一,变化可从纳米级至微米级[6]。在种子的发育过程中,油体主要聚集在子叶、胚乳等组织中[7]。植物种子中油体与含油率的相关性备受人们的广泛关注,研究发现花生[8]、油茶[9]、油棕[10-11]、甘蓝型油菜种子[12]的油体数量、大小与含油率呈正相关。
油茶作为我国特有的木本油料作物,被誉为“东方橄榄油”,其丰富的营养成分受到广大消费者的青睐。诸多学者[13-14]对其生长发育过程中糖类、蛋白质及油脂等代谢情况开展了大量研究,以期对油茶良种的选育提供理论支撑。然而,采后的油茶果仍然是一个生命活体,其糖类、蛋白质及油脂的相互转化并未停止,在生理后熟过程中内含物会发生一系列的变化,尤其是油脂含量会进一步积累[15]。因此,本课题组从应用研究的角度对采摘后的油茶果进行了有光处理、无光处理、室内阴干(避光)和自然晒干处理,采用尼罗红染色和共聚焦激光扫描显微镜技术相结合,分析4种不同方式处理后油茶果油体的大小、形状、数量及分布等情况与含油率的关系,以期通过采后油茶鲜果的前处理实现含油率的提升,为油茶加工企业提供数据参考,促进油茶产业的发展。
1 材料与方法
1.1 材料与试剂
广西普通油茶果:广西凤山春天有机农业有限公司提供,2018年11月1日采摘于广西壮族自治区河池市凤山县。
石油醚、冰乙酸、乙醇,甲醛:均为分析纯,南宁蓝天实验设备有限公司;尼罗红染料:上海麦克林生化科技有限公司;0.1 μmol/L的磷酸盐缓冲液(phosphate buffered saline,PBS):北京索莱宝科技有限公司。
1.2 仪器与设备
KD-Ⅲ冰冻切片机:浙江金华科迪仪器设备有限公司;FV3000共聚焦激光扫描显微镜:Olympus Corporation;DFY-1000C粉碎机:温岭市林大机械有限公司。
1.3 方法
1.3.1 样品处理
将采后的100 kg油茶果随机、均匀分成4份,分别进行有光处理、无光处理、室内阴干(避光)和自然晒干处理。有光处理方式为:将油茶果平铺放置在35℃培养箱中光照培养48 h后在60℃烘箱内干至水分含量约10%;无光处理为:将油茶果平铺放置在35℃培养箱中无光培养48 h后在60℃烘箱内干至水分含量约10%;室内阴干处理方式为:在避光条件下,将油茶果平铺放置,阴干至水分含量约为10%;自然晒干处理为:将油茶果平铺放置室外,自然晾晒至水分含量约10%。
1.3.2 含油率的测定
用粉碎机将油茶仁(去除种皮)快速地磨碎成均匀的细颗粒,弃去最先粉碎的约二十分之一的样品后,用6 mm条形筛处理,混匀后在30 min内测定。称取粉碎后的试样10 g,精确至0.001 g。采用索式抽提法测定油脂含量,试剂为石油醚,每个处理均重复测定3次。
1.3.3 油体的观察
随机选取不同处理后的油茶籽,从子叶部分切取规格为1.0 cm×0.5 cm×0.5 cm的样品。在4℃条件下,将样品放入福尔马林—冰乙酸—50%酒精混合液(体积比5∶6∶89)中固定24 h。将固定好的样品用冰冻切片机进行切片,冰冻切片机冷台和刀片的温度均设为-20℃。随后,将切好的样品置于尼罗红染液中避光孵育。染色好的样品用0.1 mol/LPBS缓冲液漂洗3次,清除未结合的染料。接着用浸镜油进行封片,减少染色剂淬灭。在激光共聚焦激光显微镜20倍和40倍物镜进行观察,吸收波长为553 nm。
制片过程中切片厚度和染色时间的优化设计:(1)切片厚度:采用冰冻切片的方式,切片厚度分别为:20、40、60 μm。(2)染色时间:4、8、12 h。
1.4 数据处理
油体直径的计算:每个处理随机选取30个油体,利用Image J软件测定其截面积,计算出直径。含油体率/%=单个细胞内油体截面积总和/整个细胞截面积×100。每个处理随机选取30个细胞,利用Image J软件分别算出每个细胞内油体截面积总和及单个细胞截面积[16]。模型拟合及残差分析采用SPSS 19.0进行分析。
2 结果与分析
2.1 切片厚度对染色效果的影响
切片厚度取决于细胞大小,切片过薄对细胞损伤严重,细胞液在后期染色、洗脱过程中容易流失,油体也容易随之流失,切片过厚影响共聚焦激光扫描显微镜的观察效果。因此,试验前随机选取了30个细胞,采用共聚焦激光扫描显微镜调出细胞界面清晰的图片,利用Image J软件计算每个不规则细胞的截面长度,最终算出平均长度为(69.61±14.23)μm。由于试验所用KD-Ⅲ型冰冻切片机最大切片厚度为60 μm,综合共聚焦激光扫描显微镜的观察效果,对切片厚度试验设置了20、40、60 μm3个梯度,结果依次对应图1中a、b、c。切片厚度对油体的影响见图1。

图1 切片厚度对油体的影响Fig.1 Effect of slice thickness on oil body
从图1可以看出,随着切片厚度的增加,油体数量呈现明显增多的趋势。图1a切片厚度为20 μm,只保留了极个别油体,这是由于切片过薄,大部分细胞被破坏,油体在制片过程中被洗脱导致,试验过程中也发现洗脱液表层有明显的油层出现。图1b的切片厚度为40 μm,油体数量有所增加,但大部分细胞仍然只保存有少量甚至没有油体,这与罗丽萍等[16]确定的25 μm为最佳切片厚度结论差距较大,可能是由于不同油茶品种细胞大小引起的差异。从图1c中可以看出,切片厚度为60 μm时油体数量明显增多,为了便于观察更多细胞的油体保存情况,图1c(标尺20 μm)的放大的倍数较a、b小(标尺10 μm),因此最终选择切片厚度为60 μm。
2.2 染色时间对染色效果的影响
尼罗红是一种疏水性染料,在固定后的组织中具有很强的信号。根据前期试验得知,一定浓度范围内的尼罗红染液浓度对油体的着色效果差异不显著,因此试验没有对染色液浓度进行探讨,并选定其浓度为15 μg/mL。试验组探讨了4、8、12 h 3个染色时间对油体染色效果的影响,结果见图2。
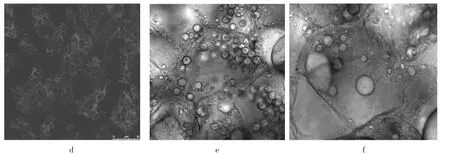
图2 染色时间对油体染色效果的影响Fig.2 The effect of dyeing time on oil body dyeing
从图2d中可以清晰的看出,染色4 h后的油体着色效果不理想,染色剂全部包裹在油体外围,说明染色时间不足。随着染色时间的增加,着色效果出现明显的差异,图2e染色时间为8 h,染色效果已经明显优于图2d,但还有一部分油体没有完全着色。从图2f中可以看出,随着染色时间进一步延长至12 h后,细胞内的油体基本都能着上色,观察界面清晰,油体之间能够完好的区分。因此,最终选择的染色时间为12 h。
2.3 不同处理对油体形态的影响
不同处理油茶果油体的直径见表1。

表1 不同处理油茶果油体的直径Table 1 Diameter of oil body of Camellia oleifera seeds after different treatments
不同采后处理油茶果的油体见图3。
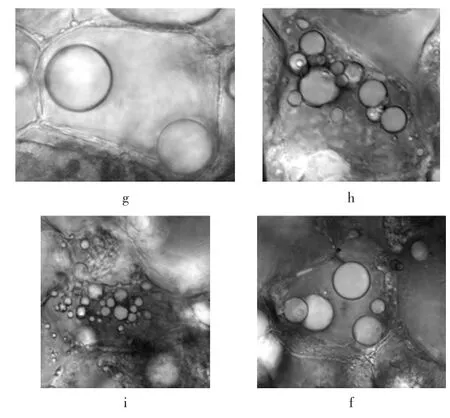
图3 不同采后处理油茶果的油体Fig.3 Oil bodies of Camellia oleifera seeds after different post-harvest treatments
4种不同方式处理后的油茶果油体均呈规则的圆形球体,无光处理和室内阴干后的油茶果油体大小不一,均匀分散在细胞内,有光处理和自然晒干的油体明显较大,数量较少。从表1可知,有光处理和自然晒干后油茶果油体的直径均明显大于无光处理和室内阴干,无光处理和室内阴干(避光)油茶果的油体直径相当,有光处理与自然晒干虽都有光照参与,但有光处理是持续光照,而自然晒干属间歇光照,所以可能是光照因素导致油体直径的差异,后续还需进一步深入探讨。合成后的油体可通过相互融合使体积增大,这种融合可自发进行,需要消耗能量,通过微管运输到植物需要的部位[17-19]。通过采后的处理使油茶果油体的体积增大,或许对油茶籽油的提取有一定帮助,还需进一步验证。不同植物品种的油体直径差异较大,罗丽萍等[16]报道的7个品系油茶油体平均直径为(2.52±1.99)μm,明显小于广西普通油茶品种。齐玉红等[20]测定的水稻、亚麻芥、黄豆、黑豆和红花5种植物油油体粒径分别为 0.5 μm~12.0 μm、0.3 μm~11.0 μm、0.4 μm~13.0 μm、0.4 μm~13.0 μm、0.4 μm~11.0 μm。Tzen等[21]报道的油菜、玉米、花生、芝麻的油体直径分别为 0.65、1.45、1.95、2.00 μm。
2.4 含油体率与含油率的相关性
表2为不同处理后油茶果种仁含油率与含油体率的比较。

表2 不同处理油茶果含油率及含油体率的比较Table 2 Comparison of oil content and oil body content of Camellia oleifera seeds treated with different treatments
从表2中可知,含油体率越高,油茶籽种仁含油率也越高,为探讨含油率与含油体率的线性关系,对其进行了回归线性分析,结果见表3、表4、表5。

表3 模型汇总Table 3 Summary of models
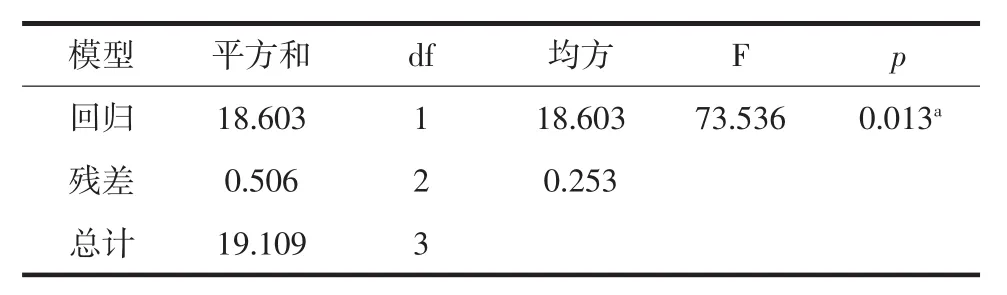
表4 方差分析Table 4 Anova

表5 系数Table 5 Coefficient
从表3中可知,R2为0.974,可以初步判断含油率与含油体率线性模型拟合效果良好。从表4方差分析结果可知,p值为0.013<0.05,说明含油率与含油体率建立的线性关系回归模型具有显著的统计学意义。由表5可得出含油体率与含油率的线性方程为:Y含油率=0.686X含油体率+35.777。标准化残差直方图见图4。标准化残差P-P图见图5。

图4 标准化残差直方图Fig.4 Standardized residual histogram

图5 标准化残差P-P图Fig.5 Standardized residual P-P chart
从图4中可知,含油率与含油体率的线性方程的标准化残差直方图对称性较好,而且图5中标准化残差P-P图中散点较为靠近斜线,所以线性方程残差正态性结果较好。模型方程DW为2.074,经查询Durbin Watson table可知,DW值在无自相关性的范围内,接受检验,残差独立。
3 结论与讨论
切片厚度是影响油体观察最重要的因素,取决于细胞大小,最大限度的保留细胞完整,能够减少细胞破损;其次是尼罗红的染色时间,时间不足,染色不够充分,这可能与细胞壁有关系。切片厚度60 μm,染色12 h后,广西普通油茶果在共聚焦激光扫描显微镜下的观察效果良好。采用有光处理、无光处理、自然晒干和室内阴干4种方式处理油茶果,其油体均呈圆形球体状,有光处理的油茶果油体直径最大,其次是自然晒干处理,无光处理和室内阴干处理后油茶果的油体直径大小相当且均小于晒干处理,说明油体的直径大小可能跟光的参与有一定关系。有光处理后油茶果仁的含油率最高(53.08%),且油体直径最大,这可能有利于油茶加工企业对油茶籽油的提取。4种不同处理油茶果的含油率跟含油体率具有较好的线性相关性,拟合系数为0.974,拟合度较好,线性方程为:Y含油率=0.686X含油体率+35.777。因此,光照和温度是采后油茶果前处理的重要因素,合理的利用可以使油茶果进一步积累油脂,增加油茶加工企业的经济效益,今后还需对其中的机理进一步深入的探讨。
