醛糖还原酶抑制剂对糖尿病周围神经病变患者NLRP3炎性体表达的影响
2020-11-30蒋凤朱静和刘青员于建秀
蒋凤,朱静和,刘青员,于建秀
滨海县人民医院内分泌科1、检验科2,江苏 盐城 224500
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病的一种微血管并发症,患病率约为30%,而高达50%的患者在患病期间肯定会发展成神经病变[1]。高血糖在糖尿病神经病变的发病机制中起着重要作用,它通过激活醛糖还原酶导致山梨醇水平升高,导致周围神经细胞损伤和肌醇降低,从而导致神经传导所必需的Na+/K+-ATP酶活性降低[2]。最近的研究表明,NLRP3 炎性体介导的免疫反应激活与各种继发性糖尿病并发症以及糖尿病引起的炎症性并发症(如心血管疾病)的病理生理有关[3-4]。但高血糖诱导的先天免疫反应在糖尿病周围神经病变中的作用尚不清楚。本研究通过调查醛糖还原酶抑制剂对高糖诱导的单核细胞NLRP3 炎性体的调控,探讨其在糖尿病周围神经病变发生发展过程中的潜在治疗作用。
1 资料与方法
1.1 一般资料 回顾性分析2019 年7 月至2020年1月滨海县人民医院内分泌科收治的90例2型糖尿病(T2DM)患者的临床资料,其中DPN组患者45例,非DPN (NDPN)组患者45 例,同时选取同期在本院体检的健康人群45例作为对照组。DPN诊断标准符合《中国糖尿病防治指南》[5]中的诊断标准,对照组下肢神经传导检查显示无多神经病变。排除标准:中毒性周围神经病变、重症肌无力等神经系统疾病;系统性红斑狼疮、类风湿关节炎等血管炎性疾病;急性传染病者;近期服用营养神经、抗氧化药物等;整体状态差无法配合检查者。三组受检者在年龄、性别、体质量指数(BMI)方面比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究获得医院伦理委员会批准(批准号2019-03),所有受检者均签署知情同意书。
表1 三组受检者的临床资料比较(±s)
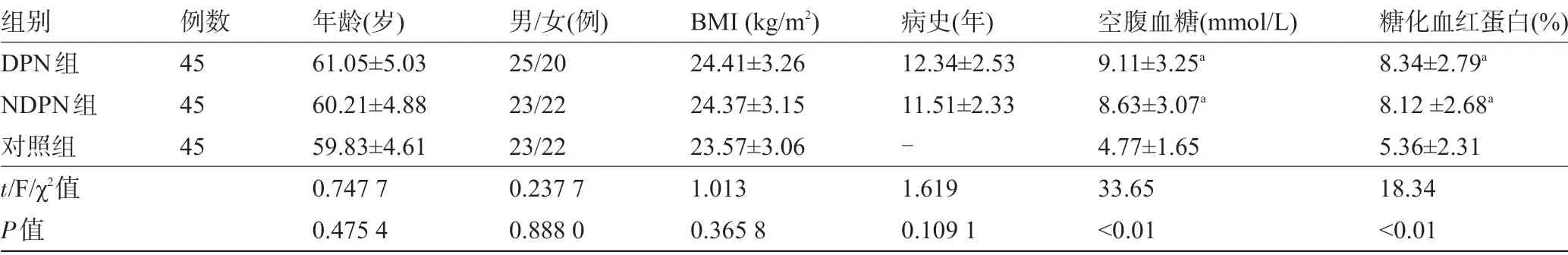
表1 三组受检者的临床资料比较(±s)
注:分别与对照组比较,aP<0.05。
组别DPN组NDPN组对照组t/F/χ2值P值例数45 45 45年龄(岁)61.05±5.03 60.21±4.88 59.83±4.61 0.747 7 0.475 4男/女(例)25/20 23/22 23/22 0.237 7 0.888 0 BMI (kg/m2)24.41±3.26 24.37±3.15 23.57±3.06 1.013 0.365 8病史(年)12.34±2.53 11.51±2.33-1.619 0.109 1空腹血糖(mmol/L)9.11±3.25a 8.63±3.07a 4.77±1.65 33.65<0.01糖化血红蛋白(%)8.34±2.79a 8.12 ±2.68a 5.36±2.31 18.34<0.01
1.2 仪器和试剂 实时定量PCR仪7500、cDNA反转录试剂盒及QuantiTect SYBR Green PCR 试剂盒均 购 自Applied Biosystems;Trizol 购 自Invitrogen 公司;采用上海恒信公司提供的Ficoll-HyPaque 分离液分离外周血单个核细胞(PBMCs);D-葡萄糖粉购自Sigma 公司;RPMI 1640 购自美国Gibco;细胞因子IL-1β及IL-18检测试剂盒购自美国密理博公司。
1.3 方法
1.3.1 外周血采集 抽取三组受检者静脉血8 mL,4 mL 离心分离血清,用于空腹血糖及胰岛素检测;剩余2 mL 全血用于糖化血红蛋白检测,2 mL 离心分离血清,存于-80℃,用于批量检测IL-1β、IL-18浓度。
1.3.2 Liminex200 检测三组受检者血清IL-1β、IL-18 浓度 取出上述-80℃保存的血清,室温融化,根据试剂说明书提供的操作步骤检测组患者血清IL-1β、IL-18浓度,每个标本检测两次,取均值。
1.3.3 RT-PCR法检测三组受检者PBMCs中NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA 水平 采用Ficoll-HyPaque分离液制备PBMCs,Trizol试剂提取PBMC中总RNA,然后通过cDNA 反转录试剂盒将及QuantiTect SYBR Green PCR 试剂盒扩增NLRP3、ASC、Caspase-1。引物设计如下:NLRP3,正义链:GCTGCGATCAACAGGAGAGA,反 义 链:GCTCACACTCTCACCCAGA;ASC,正义链:AAGCCAGGCCTGCACTTTAT,反义链:AGAGCTTCCGCATCTTGCTT;Caspase-1,正义链:CATCCCACAATGGGCTCTGT,反义链:TTCACTCTTTCAGTGGTGGGC;β-actin :正义链:GGGAAATCGTGCGTGACATT 反义链:GGAAG GAAGGCTGGAAGAGT。PCR 反应条件如下:50℃2 min,95℃预变性2 min,95℃预变性15 s,60℃预变性1 min,共40个循环。采用2-ΔΔCT方法评估归RNA水平(19)。95℃15 min,95℃15 s,60℃15 s,72℃35 s 40 个循环。mRNA 相对表达水平通过比较Ct 方法计算,即相对量=2-ΔΔCt。
1.4 高糖刺激培养PBMCs 抽取5 例DPN 患者空腹静脉血20 mL,采用Ficoll-HyPaque 分离液制备PBMCs,磷酸盐缓冲液(PBS)洗涤,置37℃,5%CO2培养箱2 h,去除未贴壁细胞,PBS 洗涤。细胞经特异性单抗CD14 孵育后,采用流式细胞仪鉴定单核细胞纯度,阳性率达90%。用含有10%胎牛血清的RPMI 1640 培养基重悬细胞,再将细胞以1×105个/mL的浓度接种至12 孔板中培养48 h,分为三组:空白组(5 mmol/L 葡萄糖)、高糖处理组(HG,25 mmol/L 葡萄糖)、非达司他+HG 组(Fid 10 μmol/L+25 mmol/L 葡萄糖)。培养48 h 后收集细胞,通过RT-PCR 法检测各组NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA,IL-1β mRNA (正义链:CTCCGACCACCACTACAGCAA,反义链:CAACACGCAGGACAGGTACAG)、IL-18 mRNA( 正义链:TGCATCAACTTTGTGGCAAT,反义链:ATAGAGGCCGATTTCCTTGG)表达。
1.5 统计学方法 应用GraphPad Prism6 软件对各种数据进行分析,性别采用χ2检验;正态分布数据以均数±标准差(±s),两组比较采用t检验,三组比较采用单因素方差分析;偏态资料采用中位数[M (P25~P75)]表示,两组数据比较采用Mann-Whitney U 检验,三组数据比较采用Kruskai-wallis 检验;采用Pearson 进行相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 三组受检者的血清IL-1β、IL-18水平比较 与对照组相比,DPN 及NDPN 组血清IL-1β、IL-18 浓度均升高,且NDPN 组升高更为明显,差异均有统计学意义(P<0.05),见表2。
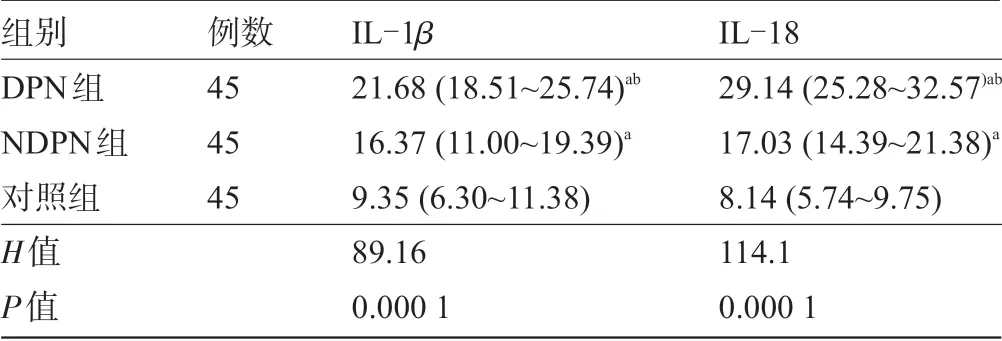
表2 三组受检者的血清IL-1β、IL-18水平比较[M (P25~P75),pg/mL]
2.2 三组受检者PBMCs 中NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA表达水平比较 与对照组相比,NDPN组及DPN组患者PBMCs中NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA 表达升高,且NLRP3 mRNA表达在DPN组升高更为明显,差异均有统计学意义(P<0.05),见表3。

表3 三组受检者PBMCs中NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA表达[M (P25~P75)]
2.3 DPN患者NLRP3炎性体与相关细胞因子相关性 DPN 患者PBMCs 中NLRP3 与IL-1β、IL-18 呈正相关(P<0.05);ASC 与IL-1β 、IL-18 呈正相关(P<0.05);Caspase-1 与IL-1β、IL-18 呈正相关(P<0.05),见表4。
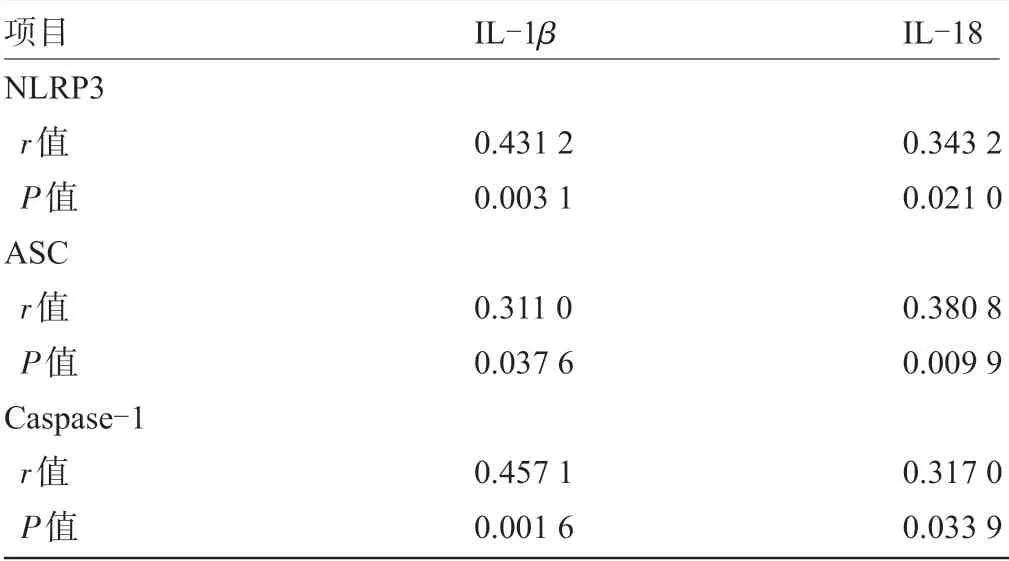
表4 DPN患者NLRP3炎性体与相关细胞因子的相关性
2.4 醛糖还原酶抑制剂非达司他抑制高糖诱导的PBMCs 中炎性体表达 体外通过醛糖还原酶抑制剂非达司他刺激培养PBMCs,与空白组相比,HG 组PBMCs 中NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA、IL-1 mRNA及IL-18 mRNA表达升高,差异有统 计 学 意 义(P<0.05);与HG 组 相 比,Fid + HG 组PBMCs 中NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA、IL-1 mRNA及IL-18 mRNA表达降低,差异均有统计学意义(P<0.05),见表5。
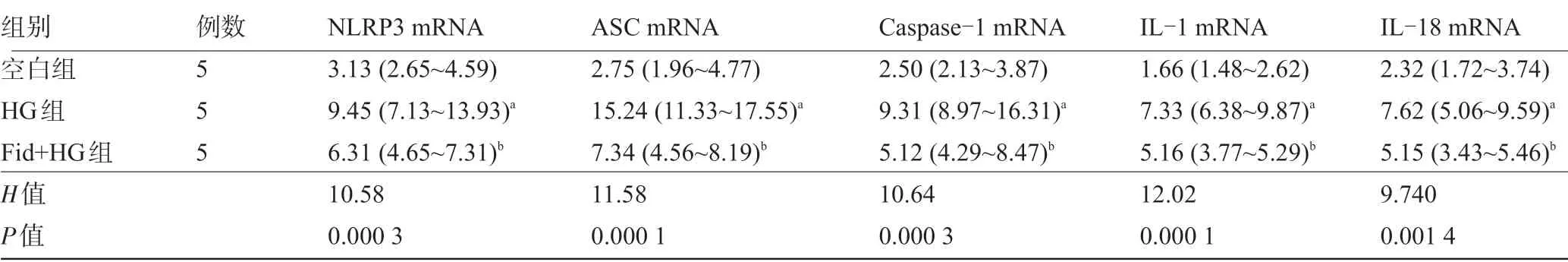
表5 醛糖还原酶抑制高糖诱导的DPN患者PBMCs中炎性体表达[M (P25~P75)]
3 讨论
糖尿病是一种全球性的慢性疾病,良好的血糖控制可以延迟糖尿病患者神经病性症状的出现,但不足以预防或治愈该疾病[6]。多元醇途径在糖尿病并发症的发病机制中起重要作用,包括糖尿病白内障、视网膜病变、神经病变和肾病。醛糖还原酶是醛固酮还原酶超家族的一种酶,在葡萄糖代谢的多元醇途径中催化葡萄糖转化为山梨醇。在此背景下,醛糖还原酶抑制剂在世界范围内备受关注[7]。本次研究通过调查醛糖还原酶抑制剂对高糖诱导的单核细胞NLRP3 炎性体的调控,探讨其在糖尿病周围神经病变发生发展过程中潜在的治疗作用。
NLRP3 炎性体是迄今为止研究最为充分的炎症小体,包括NLRP3、ASC和Caspase-1[8]。NLRP3作为炎性体激活的传感器,可以通过胆固醇晶体、尿酸、微生物和各种其他配体触发。NLRP3 是炎症体家族的重要成员,由p10 和p20 亚基组装而成的活性Caspase-1 异 四 聚 体 可 以 将 无 活 性 的pro-IL-1 β 和pro-IL-18转化为其生物学活性的分泌形式,从而参与先天免疫应答[9]。本次研究发现与对照组相比,NDPN组 及DPN 组 患 者PBMCs 中NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA表达升高,且NLRP3 mRNA表达在DPN 组升高更为明显。DPN 患者PBMCs中NLRP3、ASC 及Caspase-1 与IL-1β、IL-18 均呈正相关。
IL-1β是先天免疫反应最突出和早期的介质之一,它介导许多炎症性疾病的发病机制,包括糖尿病和动脉粥样硬化等[10]。但其在葡萄糖代谢中的生理作用仍然未知,IL-1β的长期上调导致胰岛素水平升高,这可能对代谢有害。这可能是因为胰岛素通过促进葡萄糖摄取和代谢来增强巨噬细胞的炎症状态。IL-18属于IL-1细胞因子家族,具有主要的促炎作用。研究表明IL-18与肥胖[11]、胰岛素抵抗[12]和血脂异常[13]等疾病有关。研究表明血糖调节受损或2型糖尿病患者血清中IL-18水平显著升高[14]。2型糖尿病患者血清IL-18水平升高与迷走神经活动降低相关[15]。 本次研究也有类似的发现,DPN 及NDPN 组血清IL-1β、IL-18 浓度高于对照组,且NDPN组升高更为明显。
单核细胞可释放多种促炎细胞因子,通过自分泌/旁分泌方式引起免疫应答。高血糖是糖尿病患者发生炎症、细胞凋亡、严重的血管舒张、组织损伤和功能障碍的主要因素[16]。醛糖还原酶既是多元醇途径的关键酶,其在高血糖条件下的激活又会导致炎症反应的发生。本次研究通过体外醛糖还原酶抑制剂及高糖刺激PBMCs,发现与空白组相比,HG组PBMCs中NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA、IL-1mRNA 及IL-18 mRNA 表达升高;与HG 组相比,Fid + HG 组PBMCs 中NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA、IL-1mRNA 及IL-18 mRNA 表达降低。对糖尿病大鼠的研究表明,非达司他可以预防糖尿病大鼠的视网膜氧化应激和VEGF 的过度表达[17]。非达司坦治疗糖尿病神经病变大鼠10 周后,背根神经节神经元中山梨醇和果糖水平的增加趋于正常[18]。
综上所述,DPN 患者血清血清IL-1β、IL-18 浓度升高,PBMCs 中NLRP3 mRNA、ASC mRNA、Caspase-1 mRNA表达升高;体外高糖刺激培养DPN患者的PBMCs,发现醛糖还原酶抑制剂可抑制NALP3 炎症体通路的激活,可能有助于延缓糖尿病周围神经病变的发生发展。
