生物质水热液化产物特性与利用研究进展
2020-11-30申瑞霞赵立欣于佳动
申瑞霞,赵立欣,冯 晶,荆 勇,于佳动
·农业资源循环利用工程·
生物质水热液化产物特性与利用研究进展
申瑞霞,赵立欣※,冯 晶,荆 勇,于佳动
(农业农村部规划设计研究院农村能源与环保研究所,农业部农业废弃物能源化利用重点实验室,北京 100125)
近年来,由于水热液化技术可以将高含水率的生物质直接转化为生物原油而极具潜力,引起了人们的广泛关注。该文综述了生物质水热液化研究的最新进展,简述了生物质水热液化的产物分离流程,着重分析了水热液化4种产物(生物原油、水相产物、固体残渣和气体)的产物特性及其利用方式。在4项产物中,生物原油可作为燃料或者从中提炼高附加值产品,水热液化水相可以进行微藻养殖、经厌氧发酵产甲烷或者利用微生物电解池产生氢气等,固体残渣通过进一步处理后可作为生物炭使用,气相产物可作为温室的气体肥料。另外,该文总结了生物质中关键元素在水热液化产物中的分布规律,展望了水热液化技术未来研究方向,以期能为生物质水热液化研究提供参考与借鉴。
生物质;水热液化;发酵;生物原油;元素迁移
0 引 言
近年来,随着化石能源危机的加剧,寻找和开发可再生能源已经迫在眉睫。生物质作为一种可再生能源,可以通过各种技术转化为新的能源载体,在诸多的生物质转化技术中,水热液化技术作为环境友好型的热化学技术,可将高含水率的生物质直接转化为生物原油而极具潜力,因此引起了人们的广泛关注。水热液化技术是在高温高压(200~350 ℃、5~25 MPa),以水为溶剂的条件下进行的,在水热液化过程中生物质中的大分子物质通过水解、脱羧、脱氨基、再聚合等一系列反应最终生成生物原油、水相产物、气体和固体残渣[1-2]。与其他生物质转化技术相比,水热液化技术优势明显,如原料来源广泛,可实现生物质有机组分的全转化,除了脂肪,碳水化合物和蛋白质也可以转化为生物原油。另外,水热液化不需要对原料进行干燥处理,可以实现高含水率(70%以上)生物质的水热液化处理[3-4]。
21世纪以来,特别是2010年以后,生物质水热液化技术研究越来越多,水热液化研究团队遍布全球。根据Web of science数据库统计,2017年之后每年有超过350篇水热液化相关的文章发表,因此生物质水热技术已成为当今的研究热点之一。当前,关于水热液化技术的研究主要集中在美国、中国、英国、丹麦、加拿大等国家,水热液化研究团队不断涌现,这些团队对于水热液化的研究各有侧重,在生物质水热液化研究的最新研究进展如下详述:
宾夕法尼亚州立大学的Phillip E. Savage团队对微藻或模型化合物的快速水热液化及其动力学进行了探究,发现在350℃时,微拟球藻生物原油的产率最高为43%,热值达到39 MJ/kg,在加入非均相催化剂后,生物原油的产率得到了提高,但元素组成和热值变化不大,负载型镍催化剂降低了生物原油中的硫含量[5-6]。此外,微拟球藻的快速水热液化反应(600℃,1min)最高产油率可达到66%,证明了微藻快速液化产油的可行性,缩短反应时间可以减小反应器体积,从而降低生物原油的制造成本[7]。Savage团队对于水热液化反应机理方面也做了一些研究,通过一些模型化合物,模拟生物质水热液化过程。此外,该团队建立的动力学模型可以预测不同生物质组分在不同水热液化条件下的生物原油产率[8]。
丹麦奥尔堡大学Lasse A. Rosendahl团队主要研究了温度对亚临界状态下微拟球藻和螺旋藻的液化影响,发现在350 ℃时,微拟球藻生物原油产率最高(46%),螺旋藻最佳产油温度为310 ℃[9]。对秸秆水热液化的研究发现低温有利于生物原油的形成,而高温下生物原油的油品品质更好,如氧含量低、热值高[10]。此外,该团队还采用响应面的方法优化了反应温度、时间、催化剂和含固量对秸秆水热液化产油的条件,发现反应时间对产油率影响较小,秸秆最高产油率为38.72%[11]。以杨木和甘油作为原料进行了连续式水热液化反应,产生的水相循环利用,得到生物原油的热值为34.3 MJ/kg[12]。为了提高柳木在连续式水热液化过程中的流动性,在柳木中添加了藻类与其混合,增加了原料的粘度,提高了其泵的输送性。与单独柳木水热液化相比,加入微藻可提高原料的有机组分,同时生物原油的产率也得到有效提高[13]。
复旦大学Zhang Shicheng团队研究了不同反应条件对浒苔水热液化产物的影响,发现浒苔最高生物原油产率为20.4%[14],而浒苔在甲醇中液化时,最高生物原油产率为31.1%,在乙醇中时产率为35.3%。说明以甲醇和乙醇作为溶剂时,可以提高浒苔液化的产油率[15]。除了水热液化产生物原油之外,还进行了稻杆水热处理产乙酸的研究,在260 ℃,NaOH和NiO纳米片做催化剂时,乳酸最高产率为58.81%[16]。他们对木质纤维素水解液中的单糖、有机酸和酚类物质进行了分离和回收,通过阴离子交换树脂分离,葡萄糖和乙酸的纯度可达到97%和81%,通过阳离子交换树脂,乙酸和酚类的纯度可达97%和81%,酚类在高温水解液中的回收率达到了70%[17]。
清华大学Wu Yulong团队主要进行了杜氏盐藻的水热液化研究,发现在360 ℃,Na2CO3作为催化剂时,生物原油最高产率为25.8%,生物原油的热值为30.74 MJ/kg,主要成分为酸、酯、酮类和醛类[18],而以乙醇和水作为反应媒介时,生物原油最高产率达到64.68%,热值为34.96 MJ/kg[19]。此外,还研究了不同酸碱催化剂对杜氏盐藻液化产油的影响,KtB作为催化剂时生物原油产率最高达到49.09%,当HZSM-5和MgO/MCM-41作为催化剂时,生物原油酸含量比较低,催化剂的使用减少了生物原油中的固定碳含量,对生物原油组成和沸点分布影响很大[20]。此外,还探究了杜氏盐藻与聚丙烯的混合液化情况,当杜氏盐藻与聚丙烯的质量比为8:2时,两者协同产油的效果最好,聚丙烯的添加显著减少了生物原油中的酸含量[21]。
美国西北太平洋国家实验室Elliott团队主要进行了生物质的连续式水热液化研究。以藻作为原料,含固量为35%,在高温高压下进行连续式水热液化反应,所得生物原油中主要成分是烷烃和杂环化合物,并通过催化加氢的方式对生物原油进行提质,去除其中的一些杂原子。另外,对水相进行了催化水热气化处理,反应后产生的气体中含有较多甲烷[22]。大藻(灰分含量11%~41%)的连续式水热液化试验表明350 ℃,20 MPa时,58.8%的碳转移到了生物原油中,生物原油回收时并未使用有机溶剂,藻类中的矿物质在反应过程中通过一个带过滤器的固体分离装置进行了去除,催化水热气化实现了水相中99.2%的碳转化[23]。对葡萄渣在350 ℃,20 MPa下的连续水热液化试验表明超过56%的碳转化到了生物原油中(未用有机溶剂萃取),其水相在Ru和C作为催化剂的条件下通过水热气化处理实现了99.8%的COD转化,处理后水相COD质量浓度小于150 mg/kg[24]。
伊利诺伊大学-香槟分校、中国农业大学Zhang Yuanhui团队对低脂小球藻水热液化研究发现,生物原油产率最高达到39.4%[25],此时生物原油能量回收率是65.4%,生物原油和水相产物中的C和N含量随温度和滞留时间的增加而增加,而固体残渣产率趋势与此相反,当温度大于220 ℃,滞留时间大于10 min时,原料中65%~70%的N和35%~40%的C转移到了水相产物中[26]。对小球藻和螺旋藻水热液化中的反应路径进行分析发现固含量是影响小球藻水相中营养回收的重要因素[1,27]。当小球藻与米壳的比例为1:1时,在300 ℃获得最高产油率,2种原料的共液化降低了生物原油的酸度与氮含量[28]。此外,该团队还以餐厨垃圾、浒苔、滇池蓝藻、秸秆和畜禽粪便等为原料做了一些水热液化方面的研究,发现高灰分的大藻浒苔产油率比较低(<15%),但是,添加粗甘油与浒苔共液化后,生物原油产率最高超过40%,并且粗甘油的添加显著降低了生物原油中的氮含量[29-30]。对畜禽粪便水热液化的研究发现畜禽粪便生物原油中主要含有酸酯类和酚醇类化合物而水相产物中主要为含氮化合物。并且畜禽粪便中的重金属经过水热液化后,大部分转移到了固体残渣中(>70%)。畜禽粪便中具有直接生物毒性的重金属形态在固体残渣中含量明显减少而具有稳定形态的重金属增多[31-32]。
此外,本文重点综述了近年来生物质水热液化反应后产物的分离方式以及4种产物的产物特性及其目前的利用方式,展望了现阶段水热液化技术面临的主要挑战以及未来的研究方向,以期能为生物质水热液化的机理研究以及放大化生产应用提供参考与借鉴。
1 水热液化产物分离流程
生物质水热液化过程主要在反应釜中进行,包括批式反应釜[18, 33]和连续式反应釜[34-35],其中批式反应釜大多由不锈钢(型号:SS316)材料制成,体积为10~1000 mL[36]。典型的水热液化反应器示意图如图1所示。水热液化的底物包括各类生物质原料,如畜禽粪便、餐厨垃圾、微藻、秸秆、浒苔等。在特定温度下反应一段时间后,降到室温进行产物分离与收集。水热液化产物的分离流程如图2所示。反应结束后,首先通过气袋将气体收集,固液混合物通过过滤将水相收集,剩余产物用有机溶剂清洗萃取,其中溶于有机溶剂的产物通过蒸馏干燥后得到生物原油,不溶于有机溶剂的部分通过过滤得到固体残渣。萃取生物原油的有机溶剂包括非极性的有机溶剂和极性的有机溶剂,主要是:丙酮、异丙醇、二氯甲烷、三氯甲烷、乙醚、己烷等[18,37]。不同的萃取剂影响着生物原油的产油率和热值,一般来讲,溶剂的极性度越高,产油率越高(如异丙醇26%>己烷3%),但产油率与有机溶剂的极性不是呈线性相关关系,还与溶剂的结构特性有关[38]。尽管用极性有机溶剂萃取时产油率高,但油品质量差一些,生物原油的主要组分C与H的含量略低于用非极性溶剂萃取时的含量,同时N与O含量高于用非极性溶剂萃取时的含量(N、O含量影响生物原油的品质和热值)[37]。萃取后的有机溶剂可以通过减压蒸馏法回收利用,如丙酮65 ℃下可蒸馏回用,乙醚35℃下可蒸馏回用。
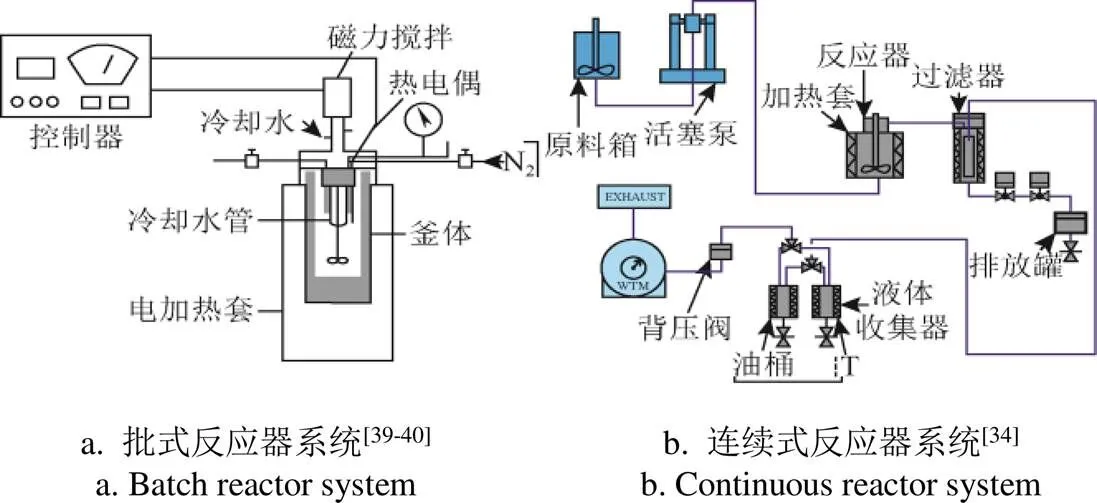
图1 水热液化反应器示意图

2 生物原油
生物原油是水热液化的主产物,当前,大多数关于水热液化的研究都集中在生物原油的特性分析及如何提高生物原油的产率和品质上,生物原油的产率和品质受诸多因素的影响,比如原料的生化组成、反应温度、升温速率、保留时间、底物含固量、催化剂类型、萃取溶剂类型等。
2.1 生物原油特性
生物质水热液化所得生物原油一般呈黑色、比较粘稠、流动性较差。不同生物质在不同的反应条件下生物原油产率差异较大(表1),其中温度是影响产油率最重要的因素。就生物质几大组分而言,脂肪的产油率最高,在80%以上,蛋白质其次,生物原油产率在20%~30%,碳水化合物产率最低,纤维素、木质素其单独水热液化的生物原油产率都在10%以下[42]。
利用藻类生产生物原油是近年来的研究热点之一[4],特别是利用滇池藻(水体富营养化的产物)生产生物原油,不仅可以处理湖泊污染还可以变废为宝,产生生物原油。但由于滇池藻高灰分低脂的特性(灰分41.6%、脂肪1.9%、蛋白24.8%),因此其最高产油率仅为18.4%[41]。反之,高脂高蛋白的藻产油率较高,如高蛋白的藻()产油率为55%,高脂的藻()产油率超过80%,为82.9%,是目前藻类水热液化的最高产油率[40]。除此之外,猪粪与秸秆的产油率分别为25%和13%[43-44],这些生物原油的热值一般在27 MJ/kg以上,餐厨垃圾、螺旋藻和猪粪的生物原油热值超过35 MJ/kg,与原油热值类似。生物原油的组分主要包括酚类、酮醛类、酸酯类、含氮类和烃类化合物等,生物原油的组分差异主要与原料的生化组成密切相关[45]。高脂肪含量的大豆油水热液化所得生物原油中的主要成分为脂肪酸,这些脂肪酸由大豆油脂的水解而来。而高蛋白生物质水热液化产生的生物原油主要成分为含氮化合物,如吲哚、吡咯烷酮和酰胺类物质等,这些物质由蛋白质的水解、脱羧和环化等反应生成[42]。而木质纤维素生物质(稻秆、灌木等)水热液化产生的生物原油中含有的酚类和酮醛类物质较多,纤维素水解产生的一些葡萄糖可以降解为糠醛,另外,单糖的脱水、异构化和环化反应可以产生环状酮,而木质素水解成分多为酚类化合物[46]。

表1 不同原料水热液化生物原油特性
2.2 生物原油应用
生物原油的主要用途是用作交通燃料,但目前仍有很多问题需要克服。与石油相比,生物原油中的含氮量较高,且氮元素的存在不利于后续油品提质的精炼,同时其燃烧产生的氮氧化合物会污染环境[50]。仅有一些特定的生物质水热液化产生的生物原油中含氮量较低,作为燃料使用会相对容易,如秸秆、粗甘油、食品废弃物等含氮量较低的生物质原料。另外,生物原油的含氧量也比较高,氧的存在严重影响着生物原油的热值。生物原油中高含氮和含氧量的特性使得油品的提质显得尤为重要,如对生物原油组分进行分离、提纯、提质等。生物原油中含有数百甚至上千种复杂的有机化合物,对于生物原油组分的分离与提纯目前主要由两种方式,即根据化合物极性差异进行分离或者根据化合物沸点差异进行分离。依据相似相溶原理,极性溶剂易溶解极性物质而非极性溶剂易溶解非极性物质。Yang等发现沙柳水热液化过程中,使用四氢呋喃作为萃取剂得到的生物原油产率较高,而使用正己烷作为萃取剂得到的生物原油产率较低,这主要是由于不同溶剂的极性差异造成的。丙酮、甲醇和四氢呋喃等极性溶剂更容易萃取生物原油中的酮类和酚类化合物,而非极性的溶剂如石油醚等更易于萃取生物原油中的烷烃类物质[51]。另外,生物原油中化合物的沸点也有很大差异,如Jazrawi等通过蒸馏的方式将藻类生物原油分成了不同馏分段,即重石脑油(<193 ℃)、煤油(193~271 ℃)、柴油(271~343 ℃)、减压柴油(343~538 ℃)和渣油(>538 ℃)5个组分[52]。Chen等通过蒸馏与酯化相结合的方式将食品废弃物的生物原油提质后作为柴油的添加剂使用,通过发动机测试试验发现添加了10%~20%生物原油的柴油,在发动机动力输出及污染物排放方面与常规柴油相比没有明显差异[53],这为生物原油作为燃料使用提供了新的思路与方向。另外,除了作为燃料使用外,从生物原油中提炼高附加值产品也是一个研究热点,例如,微拟球藻水热液化产生的生物原油可以用来制备碳量子点的绿色前体,这种碳量子点具有良好的生物相容性,对于植物细胞成像表现出优异特性[54]。
3 水热液化水相
3.1 水热液化水相特性
水相产物是生物质水热液化的主要副产物,经水热液化过程后底物中的有机物20%~50%转移到水相中[55]。水相产物中含有大量的碳、氮、磷和微量元素。生物质组分不同(糖类、脂类、蛋白质含量),以及水热液化过程的条件不同(底物TS、反应温度、停留时间、催化剂类型、升温速率等)[36],所得水相产物的特性也不尽相同。其共同点是水质呈酸性,成分复杂,含有有毒有害物质,水相中的COD质量浓度较高,甚至高达100 g/L(表2)。另外,水相中含氮量也较高,以污泥、猪粪和藻类作为水热液化原料时,水相中氨氮含量为1.9~12.7 g/L[55]。猪粪水热液化后超过40%的氮和30%以上的碳转移到了水相中[43]。通过对水热液化水相产物进行分析发现藻类和粪便为原料时水相中主要含有氮氧杂环类化合物,还有部分有机酸、酰胺类、酯类、酮类和醇类化合物,而玉米秸秆为原料时水相中主要含有挥发性有机酸(≤20 g/L)。
3.2 水热液化水相利用
水热液化水相中含有大量有毒有害的物质,如不经有效处理直接进行排放会对环境造成严重污染。目前已有多种方式对水相进行处理,同时可产生一些高附加值的产品,如微藻、甲烷、氢气等。微藻养殖可以利用水相中的一些物质作为藻类生长的营养源,经过微藻养殖后,水相中的总溶解性氮和总溶解性磷的去除率分别达到了86%和95%,SCOD去除率为63%。用水相养殖的微藻又可以作为水热液化产生物原油的原料,经过营养物的多次循环实现能源的增值。但微藻养殖需对水相进行稀释预处理,水相中物质浓度过高会抑制微藻的生长[59]。其次,先用沸石吸附水相产物中的一些对于发酵微生物有毒的抑制物质,如糠醛、酮类、5-羟甲基糠醛、酚类等,之后再进行厌氧发酵产甲烷[60]。沸石吸附后的水相作为厌氧发酵的底物时甲烷产率为6170.2mol/g COD,甲烷含量为54.69%[61]。此外,利用微生物电化学技术处理该水相也有一些研究,如以猪粪的水相作为微生物电解池底物时,最大产氢速率和氢含量分别为75.36 mL/(L•d)和61.77%[62],而以玉米秸秆水相作为微生物电解池底物时,最大产氢速率和氢含量分别为25.49 mL/(L•d)和55.45%[63]。以上的生化处理方式可实现水相COD去除率为40%~60%。除此之外,Watson等采用催化气化的方式对水相进行处理,发现NaOH做催化剂时,氢气含量最高为46.9%,Ru/AC做催化剂时,COD去除率最高为97.7%。Ni和Ru/AC混合作为催化剂时,氢气产量为9.5 mg /g[64]。此外,水相也可循环作为秸秆(固含量较高)水热液化的溶剂,随着循环次数的增加生物原油产率有所提高,生物原油热值与用蒸馏水做反应介质时略有提高[10]。

表2 生物质水热液化水相特性
4 固体残渣
除水相产物外,固体残渣是生物质水热液化的另一副产物,其产率与原料组成、反应温度等密切相关,一般来说,高的灰分含量会导致高的固体残渣产率。
4.1 固体残渣特性
与生物原油和水相产物不同,固体残渣中的有机组分比较少,主要是无机成分。人粪便的水热液化过程中,原料中超过70%的Ca、Mg、Al、Fe和Zn都转移到了固体残渣中[33]。另外,畜禽粪便固体残渣中碳氢氮元素含量之和小于50%,而其中的灰分质量分数高达50%以上[50],畜禽粪便中大部分(>70%)的重金属(Zn、Cu、Pb和Cd)经过水热液化后转移到了固体残渣中。并且畜禽粪便中具有直接生物毒性的重金属形态在固体残渣中比重明显减少[65],因此,水热液化技术可以将原料中的重金属富集到固体残渣中并能降低其环境风险。
4.2 固体残渣利用
目前,由于固体残渣中灰分较多,对于固体残渣的利用研究较少。通过扫描电镜发现猪粪水热液化后的固体残渣有较大的比表面积和孔隙度,推测固体残渣对于重金属的富集可能来源于本身的吸附作用。实际上,温度较低(220 ℃以下)的水热液化也可称为水热炭化反应,一些木质纤维素原料在水热炭化后会生成生物炭,这些生物炭对于废水中的重金属离子、氨氮及磷等具有良好的吸附能力[66-70]。但是固体残渣与生物炭的区别及其作为吸附剂的使用还有待进一步深入研究。
5 气体产物
气体在生物质水热液化产物中所占的比重较小,气体产率随着反应温度的升高而增加,一般在15%以下。气相产物中的主要组分是CO2,占到80%以上,此外还有少量的CH4和H2等[43]。关于这部分气体的利用,主要是通过适当处理后可以作为温室的气体肥料使用。目前,并未吸引众多的研究者对其应用进行深入探究。
6 生物质水热液化元素迁移分布
基于文献研究,本文对生物质水热液化过程中的主要元素迁移(C元素、N元素、金属元素)进行了总结,如图3所示。生物质类型组分不同(畜禽粪便、玉米秸秆、微藻等),水热液化过程条件不同(温度、时间、含固量等),各项产物的元素分布也不同。如340 ℃时,猪粪中45%的C转移到生物原油中,约30%的C转移到水相中,20%左右的C转移到固体残渣中[50]。290 ℃条件下,玉米秸秆C在水热液化产物中的分布与猪粪类似[56]。260 ℃时,微藻水热液化后C元素43%转移到生物原油中,40%转移到水相中,12%转移到固体残渣中[26]。另外,对于N元素而言,畜禽粪便中N元素超过40%转移到了水相,还有部分N元素分布到固体残渣(15%)和生物原油(25%)中。而玉米秸秆水热液化后70%以上转移到水相中,固体残渣和生物原油中的N各占约10%[56]。微藻水热液化后N元素分布与玉米秸秆相似[26]。除C、N元素分布外,研究者对金属元素的分布也作了深入探究,粪便中超过60%的金属转移到了固体残渣中,水相中的金属很少,占原料总金属的5%以下[65]。总体来说,水热液化技术可以实现原料中元素在产物中的定向分配。

图3 生物质水热液化关键元素迁移
7 结论与展望
在水热液化的4项产物中,生物原油可作为燃料或高附加值产品生产原料使用,水热液化水相可以进行微藻养殖、或者作为厌氧发酵产甲烷或产氢气的底物,固体残渣通过进一步处理后可作为生物炭使用,气相产物可作为温室的气体肥料。生物质中关键元素在水热液化4项产物中的分布规律不同。目前关于生物质水热液化已有大量研究,但仍有一些科学问题需要解决,主要表现在以下几个方面:1)水热液化中水作用的不够明朗。可作为溶剂、反应物或是作为催化剂。可通过同位素示踪的方式标记水和反应物来探究水热液化反应中水与生物质的反应机制;2)水热液化生物原油如何有效利用。生物质水热液化可以通过先催化加氢的方式提高其生物原油的品质,再通过蒸馏的方法对生物原油进行分段利用;3)生物质水热液化转化机理有待研究。目前只是对产物进行一些表征后推测其反应路径,对一些反应中间体没有监测,可通过过程取样或者一些原位在线监测手段进行深入分析;4)生物质水热液化技术如何实现工业化生产。水热液化技术放大遇到的挑战主要包括高温高压下反应器稳定进出料以及大规模原料的收集等问题。尽管以上的诸多瓶颈需要研究者们的不断探索与研究,但是水热液化生产生物原油由于其具有的显著优势,特别是作为液体燃料使用指日可待,有望解决我国能源不足的问题,因此水热液化技术在未来的实际生产中具有巨大潜力。
[1] Gai Chao, Zhang Yuanhui, Chen Wanting, et al. An investigation of reaction pathways of hydrothermal liquefaction usingand[J]. Energy Conversion and Management, 2015, 96: 330-339.
[2] Valdez Peter J, Nelson Michael C, Wang Henry Y, et al. Hydrothermal liquefaction ofSystematic study of process variables and analysis of the product fractions[J]. Biomass and Bioenergy, 2012, 46: 317-331.
[3] López Barreiro Diego, Prins Wolter, Ronsse Frederik, et al. Hydrothermal liquefaction (HTL) of microalgae for biofuel production: State of the art review and future prospects[J]. Biomass and Bioenergy, 2013, 53: 113-127.
[4] Tian Chunyan, Li Baoming, Liu Zhidan, et al. Hydrothermal liquefaction for algal biorefinery: A critical review[J]. Renewable and Sustainable Energy Reviews, 2014, 38: 933-950.
[5] Duan Peigao, Savage Phillip E. Hydrothermal liquefaction of a microalga with heterogeneous catalysts[J]. Industrial & Engineering Chemistry Research, 2011, 50(1): 52-61.
[6] Brown Tylisha M, Duan Peigao, Savage Phillip E. Hydrothermal liquefaction and gasification of[J]. Energy & Fuels, 2010, 24(6): 3639-3646.
[7] Faeth Julia L, Valdez Peter J, Savage Phillip E. Fast Hydrothermal liquefaction ofto produce biocrude[J]. Energy & Fuels, 2013, 27(3): 1391-1398.
[8] Sheehan James D, Savage Phillip E. Modeling the effects of microalga biochemical content on the kinetics and biocrude yields from hydrothermal liquefaction[J]. Bioresource Technology, 2017, 239: 144-150.
[9] Toor Saqib S, Reddy Harvind, Deng Shuguang, et al. Hydrothermal liquefaction ofandunder subcritical and supercritical water conditions[J]. Bioresource Technology, 2013, 131: 413-419.
[10] Zhu Zhe, Rosendahl Lasse, Toor Saqib Sohail, et al. Hydrothermal liquefaction of barley straw to bio-crude oil: Effects of reaction temperature and aqueous phase recirculation[J]. Applied Energy, 2015, 137: 183-192.
[11] Zhu Zhe, Rosendahl Lasse, Toor Saqib Sohail, et al. Optimizing the conditions for hydrothermal liquefaction of barley straw for bio-crude oil production using response surface methodology[J]. Science of The Total Environ-ment, 2018, 630: 560-569.
[12] Pedersen T H, Grigoras I F, Hoffmann J, et al. Continuous hydrothermal co-liquefaction of aspen wood and glycerol with water phase recirculation[J]. Applied Energy, 2016, 162: 1034-1041.
[13] Sintamarean Iulia M, Pedersen Thomas H, Zhao Xueli, et al. Application of algae as cosubstrate to enhance the processability of willow wood for continuous hydrothermal liquefaction[J]. Industrial & Engineering Chemistry Research, 2017, 56(15): 4562-4571.
[14] Zhou Dong, Zhang Liang, Zhang Shicheng, et al. Hydrothermal liquefaction of macroalgae enteromorpha prolifera to bio-oil[J]. Energy & Fuels, 2010, 24(7): 4054-4061.
[15] Zhou Dong, Zhang Shicheng, Fu Hongbo, et al. Liquefaction of macroalgae enteromorpha prolifera in sub-/supercritical alcohols: Direct production of ester compounds[J]. Energy & Fuels, 2012, 26(4): 2342-2351.
[16] Younas Rafia, Zhang Shicheng, Zhang Liwu, et al. Lactic acid production from rice straw in alkaline hydrothermal conditions in presence of NiO nanoplates[J]. Catalysis Today, 2016, 274: 40-48.
[17] Chen Kaifei, Hao Shilai, Lyu Hang, et al. Ion exchange separation for recovery of monosaccharides, organic acids and phenolic compounds from hydrolysates of lignocellulosic biomass[J]. Separation and Purification Technology, 2017, 172: 100-106.
[18] Zou Shuping, Wu Yulong, Yang Mingde, et al. Production and characterization of bio-oil from hydrothermal liquefaction of microalgae Dunaliella tertiolecta cake[J]. Energy, 2010, 35(12): 5406-5411.
[19] Chen Yu, Wu Yulong, Zhang Peiling, et al. Direct liquefaction of Dunaliella tertiolecta for bio-oil in sub/supercritical ethanol–water[J]. Bioresource Technology, 2012, 124: 190-198.
[20] Chen Yu, Wu Yulong, Ding Ranran, et al. Catalytic hydrothermal liquefaction of D. tertiolecta for the production of bio-oil over different acid/base catalysts[J]. Aiche Jounal, 2015, 61(4): 1118-1128.
[21] Wu Xiuyun, Liang Junmei, Wu Yulong, et al. Co-liquefaction of microalgae and polypropylene in sub-/super-critical water[J]. RSC Advances, 2017, 7(23): 13768-13776.
[22] Elliott Douglas C, Hart Todd R, Schmidt Andrew J, et al. Process development for hydrothermal liquefaction of algae feedstocks in a continuous-flow reactor[J]. Algal Research, 2013, 2(4): 445-454.
[23] Elliott Douglas C, Hart Todd R, Neuenschwander Gary G., et al. Hydrothermal processing of macroalgal feedstocks in continuous-flow reactors[J]. ACS Sustainable Chemistry & Engineering, 2014, 2(2): 207-215.
[24] Elliott Douglas C, Schmidt Andrew J, Hart Todd R, et al. Conversion of a wet waste feedstock to biocrude by hydrothermal processing in a continuous-flow reactor: Grape pomace[J]. Biomass Conversion and Biorefinery, 2017, 7: 455-465.
[25] Yu Guo, Zhang Yuanhui, Schideman Lance, et al. Hydrothermal liquefaction of low lipid content microalgae into bio-crude oil[J]. Transactions of the ASABE, 2011, 54: 239-246.
[26] Yu Guo, Zhang Yuanhui, Schideman Lance, et al. Distributions of carbon and nitrogen in the products from hydrothermal liquefaction of low-lipid microalgae[J]. Energy & Environmental Science, 2011, 4(11): 4587-4595.
[27] Gai Chao, Zhang Yuanhui, Chen Wanting, et al. Characterization of aqueous phase from the hydrothermal liquefaction of Chlorella pyrenoidosa[J]. Bioresource Technology, 2015, 184: 328-335.
[28] Gai Chao, Li Yi, Peng Nana, et al. Co-liquefaction of microalgae and lignocellulosic biomass in subcritical water[J]. Bioresource Technology, 2015, 185: 240-245.
[29] Lu Jianwen, Liu Zhidan, Zhang Yuanhui, et al. Improved production and quality of biocrude oil from low-lipid high-ash macroalgae Enteromorpha prolifera via addition of crude glycerol[J]. Journal of Cleaner Production, 2017, 142: 749-757.
[30] Lu J W, Liu Z D, Zhang Y H, et al. Effects of operational parameters on the hydrothermal liquefaction of enteromorpha prolifera and products distribution[J]. Journal of Biobased Materials and Bioenergy, 2015, 9(1): 16-21.
[31] Lu Jianwen, Li Hugang, Zhang Yuanhui, et al. Nitrogen migration and transformation during hydrothermal liquefaction of livestock manures[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(10): 13570-13578.
[32] Li Hugang, Lu Jianwen, Zhang Yuanhui, et al. Hydrothermal liquefaction of typical livestock manures in China: Biocrude oil production and migration of heavy metals[J]. Journal of Analytical and Applied Pyrolysis, 2018, 135: 133-140.
[33] Lu Jianwen, Zhang Jiaren, Zhu Zhangbing, et al. Simultaneous production of biocrude oil and recovery of nutrients and metals from human feces via hydrothermal liquefaction[J]. Energy Conversion and Management, 2017, 134: 340-346.
[34] Elliott Douglas C, Hart Todd R, Neuenschwander Gary G, et al. Hydrothermal processing of macroalgal feedstocks in continuous-flow reactors[J]. ACS Sustain-able Chemistry & Engineering, 2013, 2(2): 207-215.
[35] Lababpour Abdolmajid. Continuous hydrothermal liquefac- tion for biofuel and biocrude production from microalgal feedstock[J]. ChemBioEng Reviews, 2018, 5(2): 90-103.
[36] Dimitriadis Athanasios, Bezergianni Stella. Hydrothermal liquefaction of various biomass and waste feedstocks for biocrude production: A state of the art review[J]. Renewable & Sustainable Energy Reviews, 2017, 68(1): 113-125.
[37] Yan Weihong, Duan Peigao, Wang Feng, et al. Composition of the bio-oil from the hydrothermal liquefaction of duckweed and the influence of the extraction solvents[J]. Fuel, 2016, 185: 229-235.
[38] Lu Jianwen, Liu Zhidan, Zhang Yuanhui, et al. 110th anniversary: influence of solvents on biocrude from hydrothermal liquefaction of soybean oil, soy protein, cellulose, xylose, and lignin, and their quinary mixture[J]. Industrial & Engineering Chemistry Research, 2019.
[39] Zhou Dong, Zhang Liang, Zhang Shicheng, et al. Hydrothermal liquefaction of macroalgae enteromorpha prolifera to bio-oil[J]. Energy & Fuels, 2010, 24(7): 4054-4061.
[40] Li Hao, Liu Zhidan, Zhang Yuanhui, et al. Conversion efficiency and oil quality of low-lipid high-protein and high-lipid low-protein microalgae via hydrothermal liquefaction[J]. Bioresource Technology, 2014, 154: 322-329.
[41] Tian Chunyan, Liu Zhidan, Zhang Yuanhui, et al. Hydrothermal liquefaction of harvested high-ash low-lipid algal biomass from Dianchi Lake: Effects of operational parameters and relations of products[J]. Bioresource Technology, 2015, 184: 336-343.
[42] Lu Jianwen, Liu Zhidan, Zhang Yuanhui, et al. Synergistic and antagonistic interactions during hydrothermal liquefaction of soybean oil, soy protein, cellulose, xylose, and lignin[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(11): 14501-14509.
[43] Lu Jianwen, Watson Jamison, Zeng Jianli, et al. Biocrude production and heavy metal migration during hydrothermal liquefaction of swine manure[J]. Process Safety and Environmental Protection, 2018, 115: 108-115.
[44] Singh Rawel, Chaudhary Kajal, Biswas Bijoy, et al. Hydrothermal liquefaction of rice straw: Effect of reaction environment[J]. The Journal of Supercritical Fluids, 2015 104: 70-75.
[45] 朱张兵,王猛,张源辉,等. 鸡粪发酵液培养的小球藻水热液化制备生物原油及其特性[J]. 农业工程学报,2017,33(8):191-196.
Zhu Zhangbing, Wang Meng, Zhang Yuanhui, et al. Biocrude oil preparation by hydrothermal liquefaction ofcultivated in biogas digestate from chicken manure and its characteristic[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(8):191-196. (in Chinese with English abstract)
[46] Yang Wenchao, Li Xianguo, Li Zihui, et al. Understanding low-lipid algae hydrothermal liquefaction characteristics and pathways through hydrothermal liquefaction of algal major components: Crude polysaccharides, crude proteins and their binary mixtures[J]. Bioresource Technology, 2015, 196: 99-108.
[47] Jena Umakanta, Das K C, Kastner J R. Effect of operating conditions of thermochemical liquefaction on biocrude production from[J]. Bioresource Technology, 2011, 102(10): 6221-6229.
[48] 屈埴,刘志丹,朱张兵,等. 厨余垃圾水热液化成油特性研究[J]. 太阳能学报,2016,37(5):1327-1333. Qu Zhi, Liu Zhidan, Zhu Zhangbing, et al. Bio-crude production from kitchen waste through hydrothermal liquefaction[J]. Acta Energiae Solaris Sinica, 2016, 37(5): 1327-1333. (in Chinese with English abstract)
[49] Li Changjun, Yang Xiao, Zhang Zhe, et al. Hydrothermal liquefaction of desert shrub salix psammophila to high value-added chemicals and hydrochar with recycled processing water[J]. BioResources, 2013, 8(2): 2981-2997.
[50] Lu Jianwen, Li Hugang, Zhang Yuanhui, et al. Nitrogen migration and transformation during hydrothermal liquefaction of livestock manures[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(10): 13570-13578.
[51] Yang Xiao, Lyu Hang, Chen Kaifei, et al. Selective extraction of bio-oil from hydrothermal liquefaction of salix psammophila by organic solvents with different polarities through multistep extraction separation[J]. Bio-Resources, 2014, 9(3): 5219-5233.
[52] Jazrawi Christopher, Biller Patrick, Ross Andrew B, et al. Pilot plant testing of continuous hydrothermal liquefaction of microalgae[J]. Algal Research, 2013, 2(3): 268-277.
[53] Chen Wanting, Zhang Yuanhui, Lee Timothy H, et al. Renewable diesel blendstocks produced by hydrothermal liquefaction of wet biowaste[J]. Nature Sustainability, 2018, 1(11): 702-710.
[54] Zhang Che, Xiao Yumei, Ma Yongqiang, et al. Algae biomass as a precursor for synthesis of nitrogen-and sulfurco-doped carbon dots: A better probe in Arabidopsis guard cells and root tissues[J]. Journal of Photochemistry & Photobiology B-Biology, 2017, 174: 315-322.
[55] Usman Muhammad, Chen Huihui, Chen Kaifei, et al. Characterization and utilization of aqueous products from hydrothermal conversion of biomass for bio-oil and hydro-char production: A review[J]. Green Chemistry, 2019, 21(7): 1553-1572.
[56] Zhu Zhangbing, Si Buchun, Lu Jianwen, et al. Elemental migration and characterization of products during hydrothermal liquefaction of cornstalk[J]. Bioresource Technology, 2017, 243: 9-16.
[57] Pham Mai, Schideman Lance, Scott John, et al. Chemical and biological characterization of wastewater generated from hydrothermal liquefaction of Spirulina[J]. Environmental Science & Technology, 2013, 47(4): 2131―2138.
[58] Zhou Dong, Zhang Liang, Zhang Shicheng, et al. Hydrothermal liquefaction of macroalgae enteromorpha prolifera to bio-oil[J]. Energy & Fuels, 2010, 24: 4054-4061.
[59] Zhou Yan, Schideman Lance, Yu Guo, et al. A synergistic combination of algal wastewater treatment and hydrothermal biofuel production maximized by nutrient and carbon recycling[J]. Energy & Environmental Science, 2013, 6(12): 3765-3779.
[60] Yang Xiao, Lyu Hang, Chen Kaifei, et al. Selective extraction of bio-oil from hydrothermal liquefaction of salix psammophila by organic solvents with different polarities through multistep extraction separation[J]. Bioresources, 2014, 9(3): 5219-5233.
[61] Li Ruirui, Ran Xia, Duan Na, et al. Application of zeolite adsorption and biological anaerobic digestion technology on hydrothermal liquefaction wastewater[J]. International Journal of Agricultural and Biological Engineering, 2017.
[62] Shen Ruixia, Jiang Yong, Ge Zheng, et al. Microbial electrolysis treatment of post-hydrothermal liquefaction wastewater with hydrogen generation[J]. Applied Energy, 2018, 212: 509-515.
[63] Shen Ruixia, Liu Zhidan, He Yanhong, et al. Microbial electrolysis cell to treat hydrothermal liquefied wastewater from cornstalk and recover hydrogen: Degradation of organic compounds and characterization of microbial community[J]. International Journal of Hydrogen Energy, 2016, 41(7): 4132-4142.
[64] Watson Jamison, Si Buchun, Li Hao, et al. Influence of catalysts on hydrogen production from wastewater generated from the HTL of human feces via catalytic hydrothermal gasification[J]. International Journal of Hydrogen Energy, 2017, 42(32): 20503-20511.
[65] Li Hugang, Lu Jianwen, Zhang Yuanhui, et al. Hydrothermal liquefaction of typical livestock manures in China: Biocrude oil production and migration of heavy metal[J]. Journal of Analytical and Applied Pyrolysis, 2018(135): 133-140.
[66] 金斯汗. 干旱区牛粪生物炭对水中磷的吸附特性研究[J]. 新疆环境保护,2018,40(3):35-39. Jin Sihan. Adsorption characteristics of phosphorus in water by dairy manure-derived biochar in arid area[J]. Environ- mental Protection of Xinjiang, 2018, 40(3): 35-39. (in Chinese with English abstract)
[67] 马锋锋,赵保卫,刁静茹,等. 牛粪生物炭对水中氨氮的吸附特性[J]. 环境科学,2015,36(5):1678-1685. Ma Fengfeng, Zhao Baowei, Diao Jingru, et al. Ammonium adsorption characteristics in aqueous solution by dairy manure biochar[J]. Environmental Science, 2015, 36(5): 1678-1685. (in Chinese with English abstract)
[68] 韩鲁佳,李彦霏,刘贤,等. 生物炭吸附水体中重金属机理与工艺研究进展[J]. 农业机械学报,2017,48(11):1-11.
Han Lujia, Li Yanfei, Liu Xian, et al. Review of biochar as adsorbent for aqueous heavy metal removal[J]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(11): 1-11. (in Chinese with English abstract)
[69] 冯晶,荆勇,赵立欣,等. 生物炭强化有机废弃物厌氧发酵技术研究[J]. 农业工程学报,2019,35(12):256-264.
Feng Jing, Jing Yong, Zhao Lixin, et al. Research progress on biochar enhanced anaerobic fermentation technology of organic wastes[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(12): 256-264. (in Chinese with English abstract)
[70] 王健,沈玉君,刘烨,等. 畜禽粪便与秸秆厌氧-好氧发酵气肥联产碳氮元素变化研究[J]. 农业工程学报,2019,35(4):225-231.
Wang Jian, Shen Yujun, Liu Ye, et al. Variations of carbon and nitrogen during anaerobic-aerobic fermentation for co-production of biogas and organic fertilizer using animal manure and straw[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(4): 225-231. (in Chinese with English abstract)
Research progress on characteristics and utilization of products from hydrothermal liquefaction of biomass
Shen Ruixia, Zhao Lixin※, Feng Jing, Jing Yong, Yu Jiadong
(,,,100125)
In recent years, hydrothermal liquefaction (HTL) has attracted great attention because it has obvious advantages, such as various substrate types, total conversion of organic components from biomass (fat, carbohydrates and proteins), etc., compared with other biomass conversion technologies. In addition, HTL do not need to dry the raw materials, even biomass with high moisture content (more than 70%) can be used to produce biocrude oil via HTL. This paper reviews the latest progress in the HTL study of biomass, describes the separation process during HTL, and concentrates on the characteristics and utilization of HTL products (Biocrude oil, aqueous phase, solid residues and gases). Biocrude production of several model components from biomass was investigated, the results showed that biocrude yield of lipid was the highest (above 80%), followed by protein (20%-30%), and the yield of carbohydrate is the lowest (less than 10%). The aqueous phase is the main by-product of biomass HTL. There was 20%-50% of the organic matter in the substrate transferred to the aqueous phase. Different from the biocrude oil and aqueous phase, the organic components in the solid residues are much lower, the solid residue mainly contained inorganic components (ash content > 50%). Furthermore, we summarized the key elements migration in HTL products. In the process of HTL, 62%-98% of Ca, Mg, Al, Fe, Cu, Pb, Cd and Zn in the raw materials are transferred to the solid residues. Biocrude oil can be used as fuels, or can be used to extract high value-added products, the aqueous phase can be utilized for microalgae cultivation, methane production through anaerobic digestion or hydrogen production via microbial electrolysis cells, the solid residue is able to be used as biochar after further treatment, and gas phase can be used as gas fertilizer in the greenhouse. At last, the research direction in HTL is prospected. At present, a lot of researches on HTL of biomass were performed, but still some problems need to be further explored, mainly in the following aspects: 1) Biocrude oil components are complex, GC-MS of the biocrude oil can only obtain the information of low boiling point compounds, lack of understanding for high boiling point macromolecular compounds in biocrude oil, FTICR-MS or other technologies can be carried out to get a comprehensive understanding of the compounds. 2) The conversion mechanism of biomass HTL needs to be studied. At present, only some characterization of the product is carried out to speculate its reaction path, while the reaction intermediates are not monitored, which can be deeply analyzed by some in-situ on-line monitoring methods. Biomass HTL can improve the quality of biocrude oil by catalytic hydrogenation, and then the biocrude oil can be utilized by distillation. Although the above bottlenecks need to be explored and studied by researchers, the production of biocrude oil by HTL is expected to solve the problem of energy shortage in China because of its remarkable advantages, especially as a liquid fuel, so HTL technology has great potential in the renewable fuel production. This paper can provide references for future HTL study of biomass and the downstream utilization of HTL products.
biomass; hydrothermal liquefaction; fermentation; biocrude oil; elements migration
申瑞霞,赵立欣,冯 晶,荆 勇,于佳动. 生物质水热液化产物特性与利用研究进展[J]. 农业工程学报,2020,36(2):266-274. doi:10.11975/j.issn.1002-6819.2020.02.031 http://www.tcsae.org
Shen Ruixia, Zhao Lixin, Feng Jing, Jing Yong, Yu Jiadong. Research progress on characteristics and utilization of products from hydrothermal liquefaction of biomass[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(2): 266-274. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.02.031 http://www.tcsae.org
2019-08-25
2019-10-20
现代农业产业技术体系专项资金资助(CARS-02);中国博士后科学基金资助项目(2018M641295);农业农村部规划设计研究院重点实验室开放课题(KLERUAR2018-01)
申瑞霞,工程师,博士,主要从事农业废弃物资源化利用研究。Email:shenruixia20101229@163.com
赵立欣,研究员,博士,主要从事农业废弃物能源化研究。Email:zhaolixin5092@163.com
10.11975/j.issn.1002-6819.2020.02.031
X71
A
1002-6819(2020)-02-0266-09
