暗纹东方鲀低温贮藏期间水分、质地和蛋白质的变化规律
2020-11-27汪经邦刘大勇
汪经邦,谢 晶,刘大勇
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心(上海海洋大学),上海 201306;3.食品科学与工程国家级实验教学示范中心,上海 201306;4.江苏中洋集团股份有限公司,江苏 南通 226600)
暗纹东方鲀(Takifugu obscures)是一种富含蛋白质和必需氨基酸的海淡水洄游鱼类[1]。新鲜的暗纹东方鲀极易腐败变质,采用微生物检测等传统方法测定其品质变化费时费力;故探究快速监测鱼肉品质变化的方法具有较高的实用价值和经济意义。
水分是决定水产品微生物生长和腐败的主要因素之一,低场核磁共振(low field nuclear magnetic resonance,LF-NMR)技术检测水分具有快速无损的技术特点,适合对加工贮藏过程中不同阶段的水产品进行水分含量和状态的监测,结合化学计量学模型,能快速反映鱼肉的品质变化[2]。暗纹东方鲀作为一种高蛋白鱼类,其肌肉的蛋白质量分数高达18.44%,蛋白质变化是鱼肉营养素流失和质地变化的重要原因[3]。Wang Shuo等[4]分析了蛋白质和水分的变化规律,发现能通过监测水分和蛋白质的变化来快速监测冷藏期间金枪鱼的品质变化。此外,质地是反映鱼肉组织结构的重要指标之一,有研究发现鱼肉的质地和水分含量显著相关,朱丹实等[5]发现冷藏(4 ℃)条件下鲤鱼的结合水含量对弹性影响较大,Lu Han等[6]认为微冻(-3 ℃)条件下蛋白质的变化对鳙鱼的弹性、硬度和水分损失(离心损失和汁液损失)有显著影响。目前有关利用LF-NMR技术快速监测暗纹东方鲀品质变化的研究较少。
本研究的主要目的是探究低温贮藏(10、4 ℃和-3 ℃)期间暗纹东方鲀的水分、质地以及蛋白质的变化规律,此外,研究水分的横向弛豫时间和蛋白质、质地变化之间的关系,为进一步开发从水分变化角度分析和监测低温贮藏下暗纹东方鲀品质变化的快速方法提供理论支持。
1 材料与方法
1.1 材料与试剂
暗纹东方鲀购于江苏省中洋集团股份有限公司,体长25~32 cm、体质量0.25~0.30 kg。
硫酸铜、氯化钾、三氯乙酸、2-硝基苯甲酸、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、二硝基苯肼、甲醇、盐酸胍、乙酸乙酯、磷酸二氢钠、磷酸氢二钠 上海生工生物工程有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、考马斯亮蓝R-250上海安谱实验科技有限公司。其中甲醇、磷酸二氢钠、磷酸氢二钠为色谱纯,其他试剂均为分析纯。
1.2 仪器与设备
MesoMR23-060H.I LF-NMR仪 上海纽迈电子科技有限公司;TA-XT Plus质构仪 英国SMS公司;WFZ UV-2100紫外-可见分光光度计 日本尤尼柯仪器有限公司;L-8800全自动氨基酸分析仪、S-3400N扫描电子显微镜 日本日立公司;荧光分光光度计 上海棱光技术有限公司;BOC Edwards Lyofast真空冷冻干燥机北京天利联合科技有限公司;Nicolet傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪美国赛默飞世尔公司。
1.3 方法
1.3.1 样品预处理
新鲜的暗纹东方鲀宰杀后立即去皮、眼睛和内脏,直接将整条鱼装入聚乙烯拉链袋(35 cm×14 cm)后,分别贮藏于10、4 ℃和-3 ℃(前期研究表明暗纹东方鲀的冻结点为-1.121 ℃[7])的恒温恒湿箱(相对湿度90%~95%)中,每隔2 d取样进行指标测定。
1.3.2 肌原纤维蛋白的提取和含量测定
参考Lü Mingchun等[8]的方法提取肌原纤维蛋白。准确称取2 g绞碎的鱼肉于50 mL离心管中,加入10 倍体积缓冲液A(含20 mmol/L Tris-马来酸、0.05 mol/L KCl,pH 7.0),4 ℃下匀浆。匀浆液在4 ℃以10 000 r/min离心15 min,上清液为水溶性蛋白(water soluble protein,WSP)。取沉淀物加入10 倍体积缓冲液B(含20 mmol/L Tris-马来酸、0.6 mol/L KCl,pH 7.0)匀浆,匀浆液4 ℃下浸提1 h,浸提后的匀浆液为盐溶性蛋白(salt soluble protein,SOP),匀浆液10 000 r/min、4 ℃下离心15 min,上清液即为肌原纤维蛋白溶液。根据双缩脲法测定肌原纤维蛋白溶液的蛋白质量浓度,以牛血清白蛋白作为标准溶液。
1.3.3 水分相关指标分析
1.3.3.1 水分分布测定
参考Wang Xinyun等[2]的方法进行LF-NMR和核磁共振成像(magnetic resonance imaging,MRI)分析。取背部肌肉切成鱼块(2.0 cm×2.0 cm×3.0 cm)测定,迭代反演后得到横向弛豫时间T2图谱,采用LF-NMR仪对鱼块进行成像,得到质子密度图后进行映射和伪彩分析。
1.3.3.2 蒸煮损失率、离心损失率和汁液损失率测定
蒸煮损失率参考Hong Hui等[9]的方法测定。取背部肌肉(1.5 cm×1.5 cm×1.5 cm)称质量(mb/g),放入拉链袋后于85 ℃蒸煮15 min,冷却5 min后重新称样品质量(mc/g)。蒸煮损失率的计算见公式(1)。

汁液损失率参考Robinson等[10]的方法测定,测定贮藏前后的质量,分别记为mo/g和mi/g,汁液损失率按公式(2)计算。
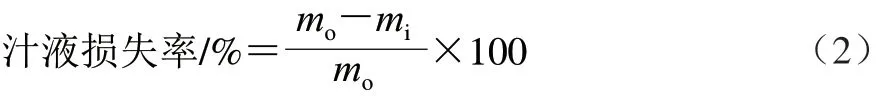
离心损失率参考Wang Xinyun等[2]的方法测定,准确量取5 g背部肌肉(mf/g),用双层滤纸包裹后置于50 mL离心管中,3 000 r/min离心10 min,重新称量沉淀后的质量(mp/g)。离心损失率按公式(3)计算。
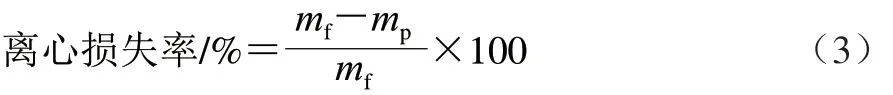
1.3.4 微观组织结构观察
参考Lu Han等[6]的方法,将背部肌肉切成立方体(1.0 mm×1.0 mm×1.0 mm),通过扫描电子显微镜对鱼块的纵切面进行扫描观察。
1.3.5 质构特性测定
参考朱丹实等[5]的方法测定鱼肉的质构特性(硬度和弹性),通过质构仪对样品的背部肌肉(3.0 mm×3.0 mm×3.0 mm)进行测定。主要参数如下:测试前速率4.00 mm/s、测试速率1 mm/s、测试后速率5 mm/s、应变(样品压缩幅度)60%、初始距离5.0 cm、测试力5.0 g。
1.3.6 总巯基、二硫键、总羰基含量,Ca2+-ATPase活力和游离氨基酸含量测定
总巯基和二硫键含量的测定:取0.5 mL 4 mg/mL肌原纤维蛋白溶液加到4.5 mL缓冲液I(总巯基:含8 mol/L尿素、3 mmol/L EDTA、1%(质量分数,下同)SDS、0.2 mol/L Tris-HCl;二硫键:含8 mol/L尿素、3 mmol/L EDTA、1% SDS、0.1 mol/L Na2SO3、0.2 mol/L Tris-HCl)中,充分混匀,取4 mL混合液,加入0.5 mL缓冲液II(总巯基:含10 mmol/L二硝基苯甲酸、0.2 mol/L Tris-HCl;二硫键:含8 mol/L尿素、3 mmol/L EDTA、1% SDS、0.1 mol/L Na2SO3、10 mL/L NTSB、0.2 mol/L Tris-HCl),40 ℃温育25 min,在412 nm波长处测定吸光度。空白组用0.6 mol/L NaCl溶液代替样品。
其中NTSB溶液的制备:将100 mg二硝基苯甲酸溶解到10 mL 1 mol/L的亚硫酸钠溶液中,38 ℃通入氧气,溶液由亮红色变为淡黄色,即表示NTSB生成。巯基和二硫键含量均按公式(4)进行计算,结果以蛋白质量计。
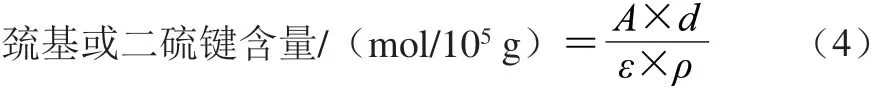
式中:A表示吸光度;ρ表示蛋白质量浓度/(mg/mL);ε表示摩尔吸光系数,为13 600 L/(mol·cm);d表示稀释倍数,为10.00。
总羰基含量参考张晗等[12]的方法测定,以摩尔吸光系数22 000 L/(mol·cm)计算暗纹东方鲀蛋白羰基含量,单位为nmol/mg,结果以蛋白质量计。
Ca2+-ATPase活力参考Lu Han等[6]的方法测定,结果表示为1 min内1 mg蛋白催化ATP生成无机磷的量,单位为μmol/(mg·min)。
游离氨基酸含量参考Sun Xinyun等[13]的方法,准确称取2 g绞碎的鱼肉,使用全自动氨基酸分析仪测定。
1.3.7 肌原纤维蛋白结构测定
1.3.7.1 二级结构测定
取2 mL 4 mg/mL的肌原纤维蛋白溶液冷冻干燥48 h,称量0.5 g干燥后的样品置于FTIR仪,在25 ℃下扫描整个条带,仪器分辨率为4 cm-1,每个样品以空气为背景进行扫描。用Omnic 9.2.106光谱软件处理原始数据,用PeckFit v4.12光谱分析拟合软件对谱峰进行拟合。
1.3.7.2 三级结构测定
肌原纤维蛋白样品被0.01 mol/L磷酸盐缓冲液(pH 7)稀释为0.4 mg/mL,用于后续测定。荧光分光光度计参数设定:激发波长295 nm,波长范围为310~400 nm,激发和发射狭缝宽度均为5 nm。
1.4 数据处理与分析
所有指标测定均设3 个平行,并用SPSS 22.0软件进行显著性分析(方差分析和邓肯氏检验),采用Origin 9.0软件绘图。
2 结果与分析
2.1 暗纹东方鲀鱼肉在不同温度贮藏过程中的水分变化情况
2.1.1 LF-NMR分析结果
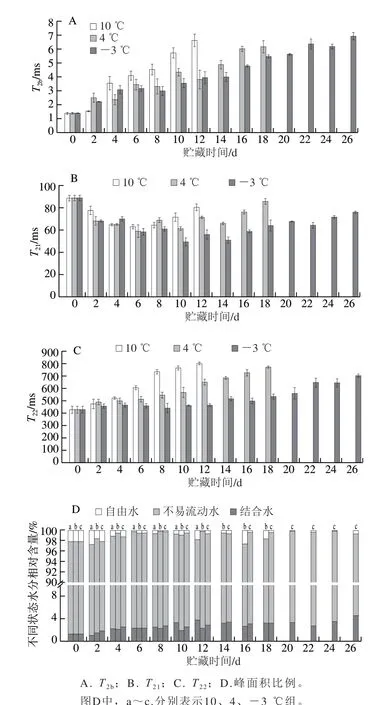
图1 低温贮藏下暗纹东方鲀不同状态水分弛豫时间、峰面积比例的变化Fig. 1 Changes in transverse relaxation time and peak area fraction of each water component in Takifugu rubripes under low temperature storage
通过LF-NMR测定的横向弛豫时间T2可以区分不同水分在鱼肉中的分布[14],T2反映各水分与鱼肉结合程度,T2越小,结合程度越紧密。弛豫图谱的3 个峰分别代表与蛋白质大分子紧密相关的结合水(T2b,1.35~6.93 ms)、肌膜与肌纤维之间的不易流动水(T21,49.33~88.67 ms)及肌原纤维外部的自由水(T22,427.00~799.67 ms)。各组T2b随贮藏时间延长呈上升趋势,可能是在酶和微生物的作用下蛋白质发生降解,使结合水流动性增加,结合程度降低(图1A)。贮藏前期冰晶的形成(-3 ℃)或环境温度的骤降均可能导致流动性较大的水分流向肌膜外,自身水分的迁移会导致不易流动水的自由度降低,因此T21降低;贮藏后期蛋白酶的作用导致肌原纤维蛋白结构被大量破坏,不易流动水和肌原纤维的结合程度下降[15],故T21随贮藏时间的延长呈先下降后上升交替波动的变化趋势(图1B)。T22呈波动上升的趋势,且贮藏温度越高,蛋白质等物质的降解速度越快,自由水的流动性越大(图1C)。
图谱的峰面积可表征各水分的相对含量(图1D)。各组结合水的相对含量(P2b)呈波动上升的趋势。不易流动水和自由水分别处于肌肉纤维膜的内外部,前期肌肉内发生无氧代谢等化学反应,导致膜通透性的增加,膜外水流入内部,不易流动水和自由水的相对含量(P21和P22)分别出现短暂的增加和减少,中后期鱼肉的自溶作用加强,膜内蛋白质水解,导致膜内水外流,P21和P22分别减少和增加,低温贮藏下鱼肉内的不易流动水和自由水可能相互转化[16]。-3 ℃组在贮藏末期的P22下降明显,贮藏至14 d的水分相对含量为0.649%,24 d下降至0.09%,可能是由于肌原纤维外部水形成冰晶导致自由水流失严重[5]。
2.1.2 MRI成像结果
通过MRI图可以观察暗纹东方鲀内部组织形态和水分子分布状况(图2)。在MRI图像中,黄色和蓝色分别对应高质子和低质子密度区域,各组的颜色和亮度随贮藏时间延长从亮黄色向绿蓝色变化,表明鱼肉中P21整体呈下降趋势,MRI成像结果与LF-NMR分析结果基本一致。
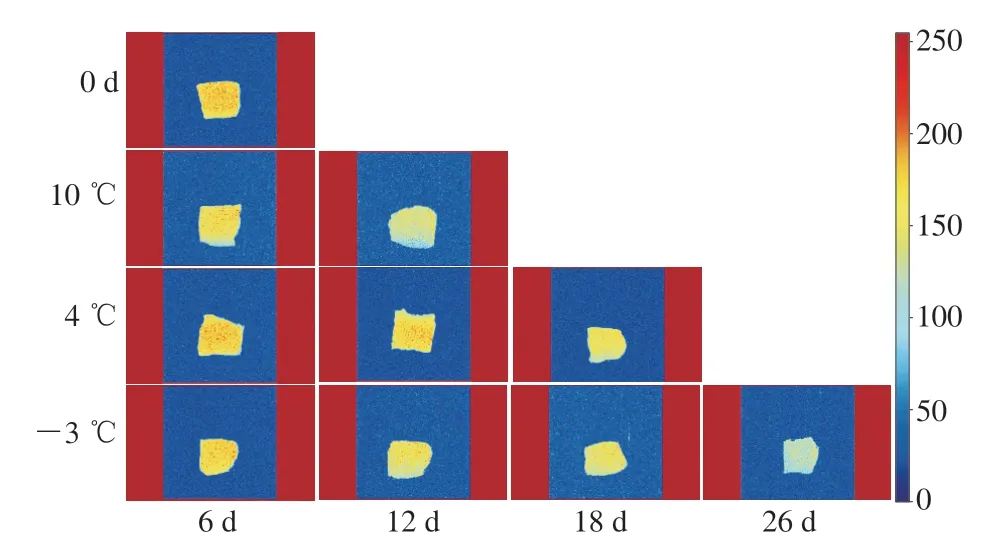
图2 低温贮藏下暗纹东方鲀核磁共振成像的变化Fig. 2 Changes in magnetic resonance image of Takifugu rubripes under low temperature storage
2.1.3 蒸煮损失率、汁液损失率和离心损失率
如图3A、B所示,暗纹东方鲀蒸煮损失率和离心损失率随低温贮藏时间延长总体呈上升趋势,且温度越高,水分损失越大。如图3C所示,各组的汁液损失率随贮藏时间延长显著上升(P<0.05),可能是肌原纤维蛋白的降解会破坏肌肉纤维结构,导致水分和水溶性成分(如肌浆蛋白)大量损失;此外,微冻(-3 ℃)组的汁液损失率明显高于其他贮藏组,从贮藏第2天开始,10 ℃和4 ℃组的变化范围分别为1.34%~3.27%和0.14%~2.71%,而-3 ℃组为0.73%~17.71%,虽然低温能减缓蛋白质的降解和氧化,但是微冻条件下形成的冰晶融化后部分水不能迁移回组织,同时携带部分可溶性蛋白质,导致汁液损失严重[17-18]。
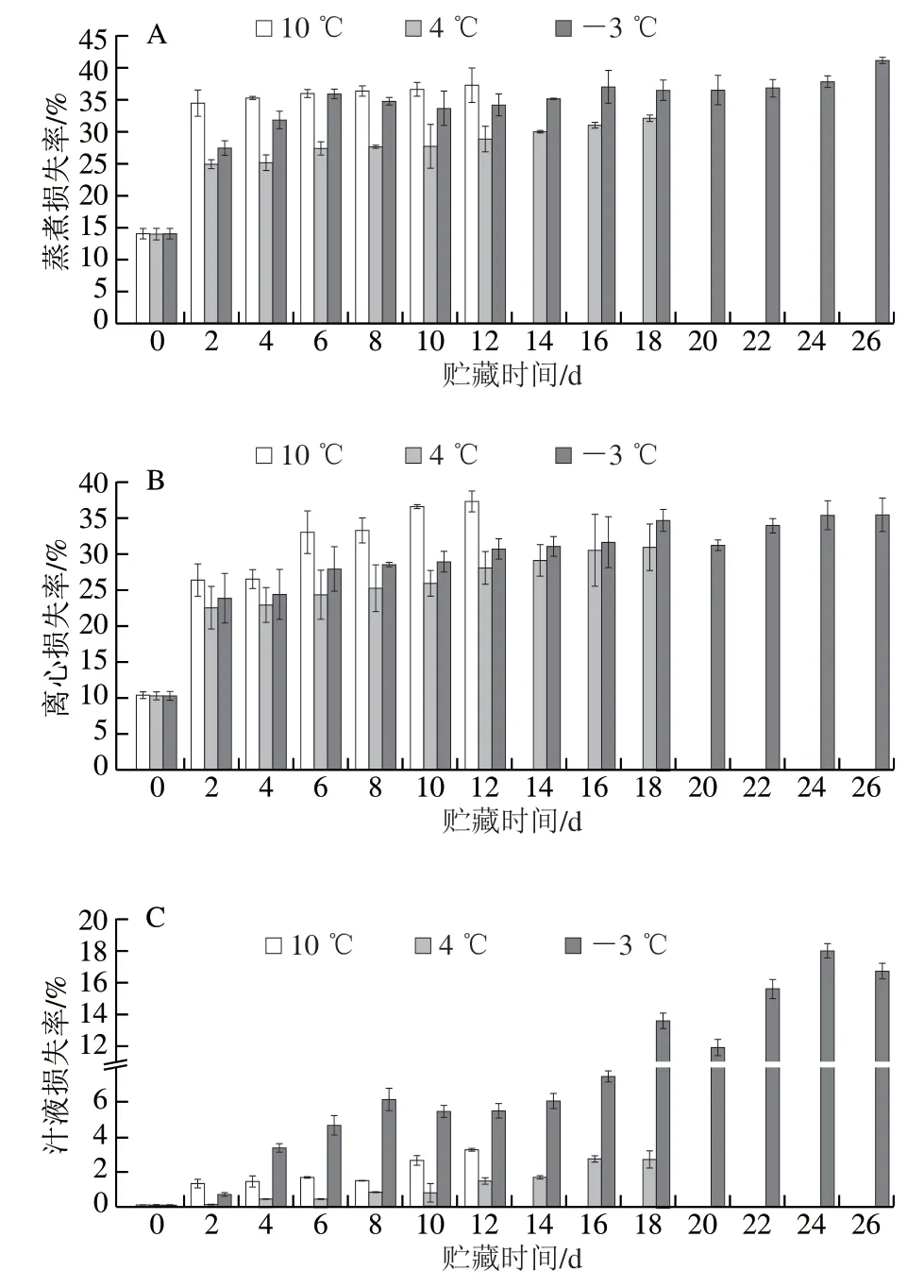
图3 低温贮藏下暗纹东方鲀蒸煮损失率(A)、离心损失率(B)和汁液损失率(C)的变化Fig. 3 Changes in cooking loss rate (A), centrifugal loss rate (B) and drip loss rate (C) of Takifugu rubripes under low temperature storage
2.2 暗纹东方鲀鱼肉在不同温度贮藏过程中的质地变化情况
质构参数是衡量鱼肉组织结构的重要指标。如表1所示,各组的弹性和硬度随贮藏时间延长呈下降的趋势,表1中的r表征不同贮藏温度下鱼肉的硬度或弹性和贮藏时间的相关性,r的绝对值越接近于1.000,说明该贮藏温度下贮藏时间对鱼肉硬度或弹性的影响越大。弹性与时间的相关系数在10 ℃组中最大,说明3 个温度中,10 ℃下的弹性与贮藏时间的相关性最高。此外,不同贮藏温度下鱼肉的硬度指标均与贮藏时间显著相关,说明贮藏时间对鱼肉硬度影响较大。
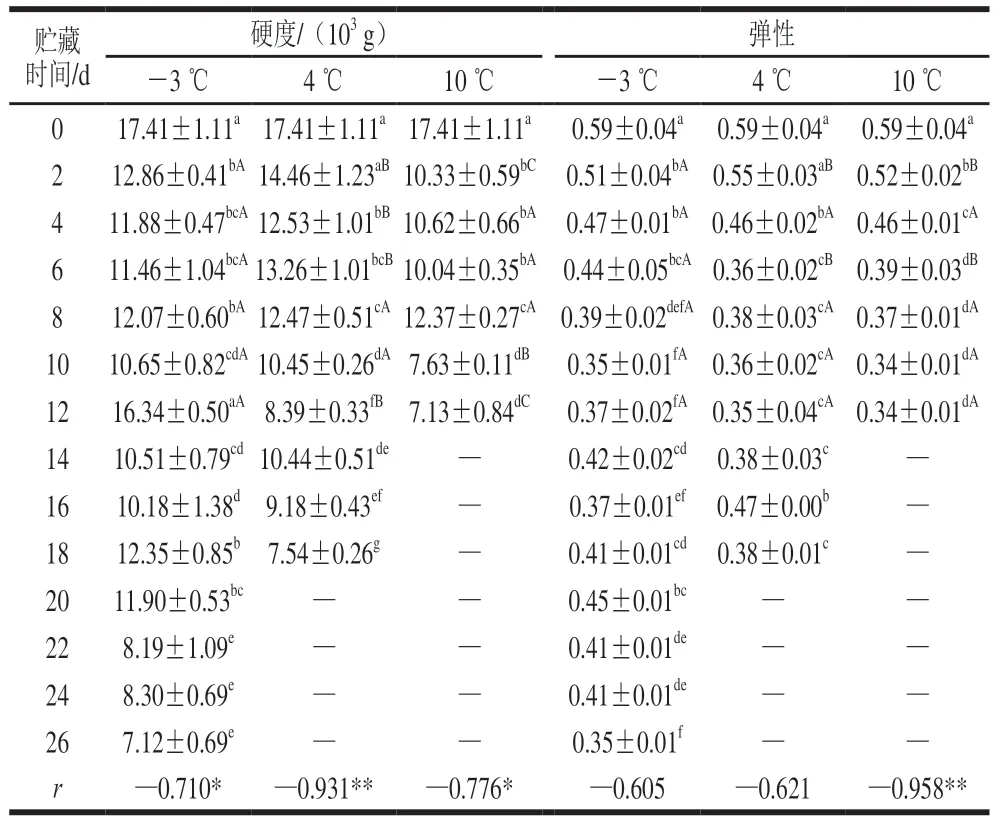
表1 低温贮藏下暗纹东方鲀质构参数的变化Table 1 Changes in TPA parameters of Takifugu rubripes under low temperature storage
图4是新鲜鱼肉(0 d)和各组鱼肉在第12天的纵切面微观组织结构情况,新鲜鱼肉(0 d)的肌纤维结构紧密且轮廓清晰,在贮藏的第12天,10 ℃和4 ℃组鱼肉的肌纤维受到挤压发生扭曲变形。-3 ℃组肌纤维结构较完整,但内部出现明显裂口损伤。因此,低温有助于维持肌肉组织结构的完整度,但微冻下的冰晶会导致肌纤维受到机械损伤,甚至断裂,影响鱼肉质地。

图4 低温贮藏过程中暗纹东方鲀肌肉微观组织结构的变化Fig. 4 Changes in muscle microstructure of Takifugu rubripes under low temperature storage
2.3 暗纹东方鲀鱼肉在不同温度贮藏过程中的蛋白质变化情况
2.3.1 SOP、WSP含量
SOP主要由肌原纤维蛋白(肌球蛋白、肌动蛋白等)组成,WSP主要由肌浆蛋白等组成。如图5A、B所示,新鲜鱼肉的SOP和WSP含量分别为101.17 mg/g和40.37 mg/g,随着贮藏时间的延长,各组的SOP含量呈下降趋势,一方面,主要是酶和微生物的作用导致肌原纤维蛋白降解,导致SOP含量降低;此外,贮藏过程中巯基会氧化为二硫键,易引起肌球蛋白重链的聚合[19],也会导致SOP含量降低。而鱼肉中的WSP含量的上升可能是由于肌原纤维蛋白降解成了一些溶于水的小分子蛋白。

图5 低温贮藏下暗纹东方鲀SOP(A)和WSP(B)含量的变化Fig. 5 Changes in salt-soluble (A) and water-soluble (B) protein content in Takifugu rubripes under low temperature storage
2.3.2 总巯基及二硫键含量
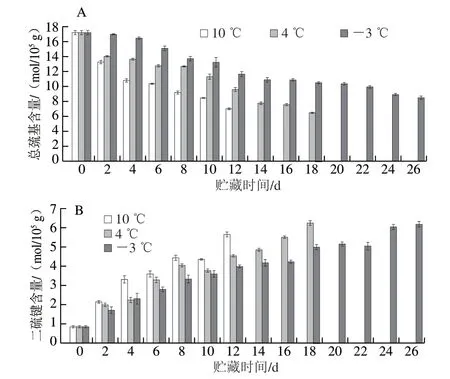
图6 低温贮藏下暗纹东方鲀总巯基(A)和二硫键(B)含量的变化Fig. 6 Changes in total sulfhydryl group (A) and disulfide bond (B)contents in Takifugu rubripes under low temperature storage
如图6A所示,鱼肉总巯基含量随贮藏时间延长呈显著下降的趋势,且贮藏温度越高,下降越快,10、4 ℃和-3 ℃组贮藏至12 d分别下降了59.38%、44.51%和33.41%,-3 ℃组贮藏26 d仅下降了50.78%。原因是半胱氨酸残基中的巯基易氧化成二硫键,且温度越高,氧化速度越快,周果等[11]研究发现4 ℃比-3 ℃条件下贮藏的金枪鱼肉更易氧化,此外,贮藏温度越高,位于肌球蛋白内部巯基的越容易暴露,也会加快巯基的氧化速度。如图6B所示,鱼肉二硫键含量总体上随贮藏时间延长呈上升的趋势,-3 ℃贮藏组鱼肉的二硫键含量在贮藏至22 d时发生短暂的下降,是因为蛋白质在氧化应激过程中,二硫键可能会转化为其他物质;此外,氧化过程中形成的无效中间体会引起二硫键外露,导致二硫键易被其他物质还原或重排,也会导致其含量下降[20]。

图7 低温贮藏下暗纹东方鲀Ca2+-ATPase活力的变化Fig. 7 Changes in Ca2+-ATPase activity of Takifugu rubripes under low temperature storage
2.3.3 Ca2+-ATPase活力
肌球蛋白约占肌原纤维蛋白含量的6 0%,Ca2+-ATPase活力是表征肌球蛋白完整性的指标,其越高,表明蛋白质变性程度越小[12]。如图7所示,新鲜鱼肉的Ca2+-ATPase活力为0.54 μmol/(mg·min),10、4 ℃和-3 ℃组鱼肉贮藏至12 d时分别下降了59.26%、44.44%和29.63%,各组的Ca2+-ATPase活力随贮藏时间延长而降低,且温度越高,下降越快。肌球蛋白的交联和其头部构象的改变可能是导致Ca2+-ATPase活性下降的主要因素[21];有报道称部分巯基的氧化也会影响Ca2+-ATPase活力[19]。
2.3.4 羰基含量

图8 低温贮藏下暗纹东方鲀羰基含量的变化Fig. 8 Changes in protein carbonyl content in Takifugu rubripes under low temperature storage
羰基含量是表征肌原纤维蛋白氧化程度的重要指标之一。如图8所示,-3、4 ℃和10 ℃组羰基含量总体呈上升趋势,一方面是因为氧化应激过程的部分氨基酸残基受到自由基的攻击,导致残基上的氨基(—NH2)或亚氨基(—NH)转化为醛基;另一方面,活性氧引起蛋白主肽链的断裂可能也会导致羰基含量增加[9]。新鲜鱼肉的羰基含量为0.88 nmol/mg,相同的贮藏时间内,各组的羰基含量变化无明显差异。-3 ℃组在贮藏前20 d的羰基含量呈上升趋势,但从20 d贮藏至26 d羰基含量下降了14%,是因为蛋白质羰基化具有一定的特异选择性[22],可能低温影响了羰基化的比例,且一旦部分羰基化蛋白质不能被降解,则易于和细胞内其他氧化物质交联生成新的高聚物[22],导致贮藏后期羰基的降解和转化速率快于生成速率,因此其含量下降。
2.3.5 游离氨基酸含量
游离氨基酸是蛋白质降解的产物,其含量变化能反映蛋白质的降解[13]。如表2所示,各组的游离氨基酸总含量随贮藏时间总体呈上升的趋势,可能蛋白水解酶和微生物引起蛋白质的降解,10 ℃和4 ℃组的样品贮藏至12 d时游离氨基酸的总含量分别增加了125.3%和50.39%,-3 ℃组在0~12 d的游离氨基酸总含量无明显变化,陈桂平[24]发现游离氨基酸的释放主要取决于易受温度影响的外肽酶(肽酶、氨肽酶和羧肽酶等)的活性,由于低温抑制了酶和微生物的活性,导致蛋白质的降解速率降低,因此-3 ℃组鱼肉游离氨基酸含量变化最小。甘氨酸、丙氨酸、赖氨酸和精氨酸是暗纹东方鲀鱼肉中主要的游离氨基酸成分,占总含量的一半以上,其中,各组的赖氨酸和精氨酸含量呈先下降后上升的趋势,可能是带正电的赖氨酸(pI 9.74)和精氨酸(pI 10.76)同暗纹东方鲀蛋白质表面的负电荷的中和导致其含量的下降[24];此外,微生物的生成代谢会消耗部分游离氨基酸,也可能会导致其含量降低[20]。
2.3.6 肌原纤维蛋白二级结构
图9 A 为低温贮藏期间的鱼肉肌原纤维蛋白在4 0 0 0 ~5 5 0 c m-1范 围 内 的F T I R 图 。 酰 胺I 带(1 700~1 600 cm-1)是目前应用最普遍的蛋白质谱带,其吸收峰通过表征C=O的伸缩振动频次反映肽链构象变化情况,新鲜鱼样的吸收峰波数为1 642 cm-1,贮藏期间样品的肌原纤维蛋白吸收峰的移动可能是多肽链构象的变化所致,各温度组红外光谱图无明显差异。对酰胺I带进行去卷积化定量分析,得到二级结构相对含量变化(图9B~D)。新鲜鱼样包含24.53%的α-螺旋、38.24%的β-折叠、16.32%的β-转角和20.71%的无规卷曲,贮藏前期(前6 d),各组的α-螺旋和无规卷曲相对含量变化不明显,主要是β-转角和β-折叠之间相互转化,巯基氧化为二硫键可能会引起β-转角和β-折叠等蛋白质结构之间的转化[25]。总体来说,各组的α-螺旋和β-折叠相对含量随贮藏时间延长分别呈波动下降和上升的趋势,维系肌原纤维蛋白二级肽链结构的氢键等被大量破坏,导致肌原纤维蛋白螺旋结构的部分解折叠,α-螺旋含量减少[26]。
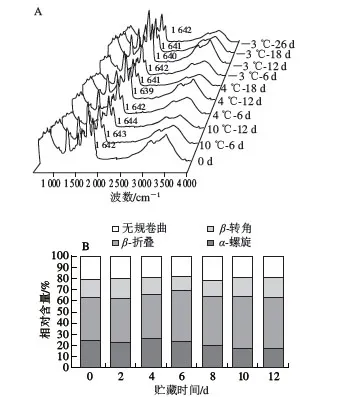
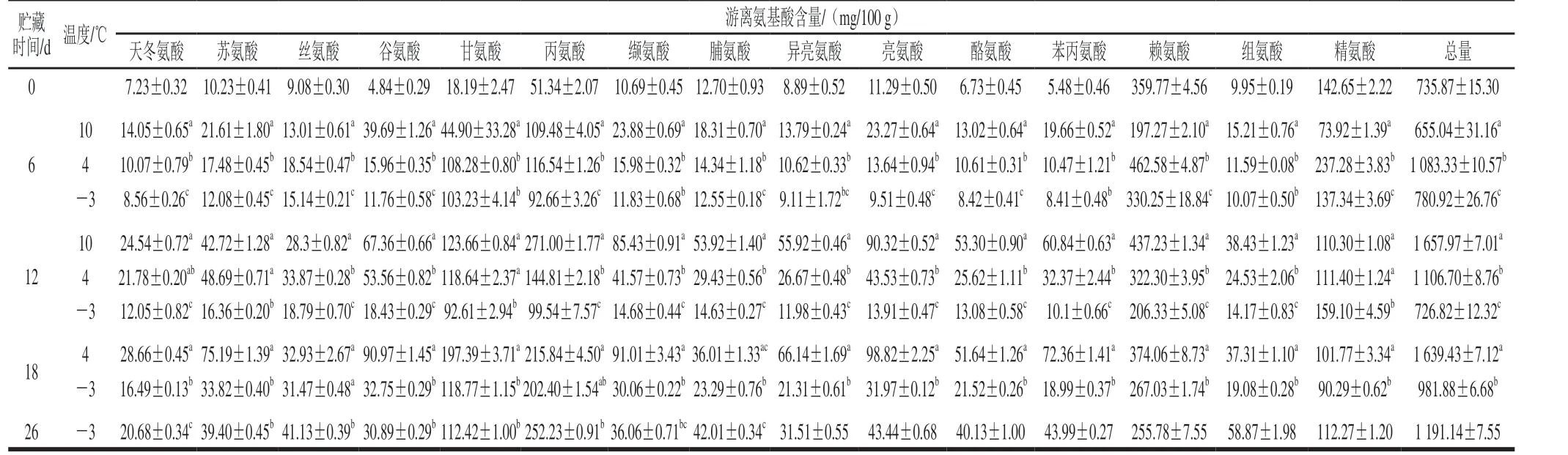
表2 低温贮藏下暗纹东方鲀游离氨基酸含量的变化Table 2 Changes in FAA contents in Takifugu rubripes under low temperature storage
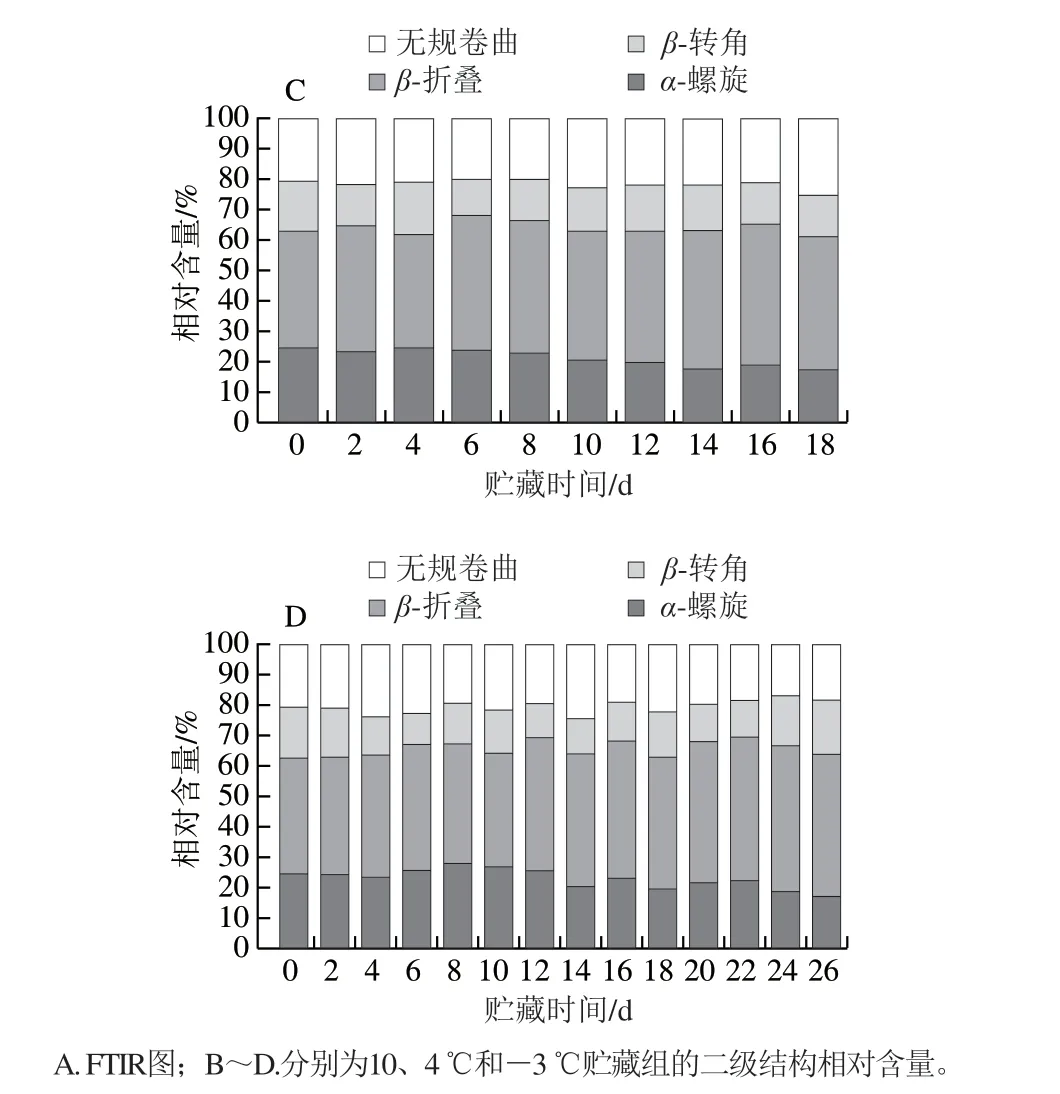
图9 低温贮藏下暗纹东方鲀肌原纤维蛋白二级结构相对含量的变化Fig. 9 Changes in secondary structure relative contents of myofibrillar protein in Takifugu rubripes under low temperature storage
2.3.7 肌原纤维蛋白三级结构
内源荧光光谱是探索蛋白质构象变化的重要方法之一。如图10所示,新鲜鱼样的荧光强度最高,发射波长为336 nm处的荧光强度最大,荧光量子产率对色氨酸残基(tryptophan residues,TR)周围的微环境变化非常敏感,贮藏初期TR大部分被包裹在肌原纤维蛋白内部,肌原纤维蛋白荧光强度较高。在氧化应激过程中,肌原纤维蛋白内源荧光强度降低,可能是因为维系肌原纤维蛋白三级结构的次级键断裂,其结构从折叠和盘绕向展开状态转化,导致TR等荧光基团易暴露在极性环境中[27];此外,郑红[28]认为冷藏(4 ℃)下的鳝鱼蛋白质二级结构的变化可能对TR的微环境也有较大影响。10、4 ℃和-3 ℃组贮藏至12 d最大发射波长的荧光强度分别下降了60.06%、41.27%和23.82%,而-3 ℃组贮藏至26 d才下降了42.41%,说明贮藏温度对肌原纤维蛋白荧光强度影响很大。
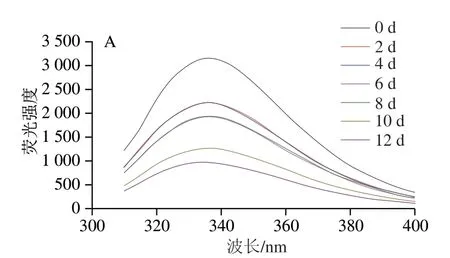
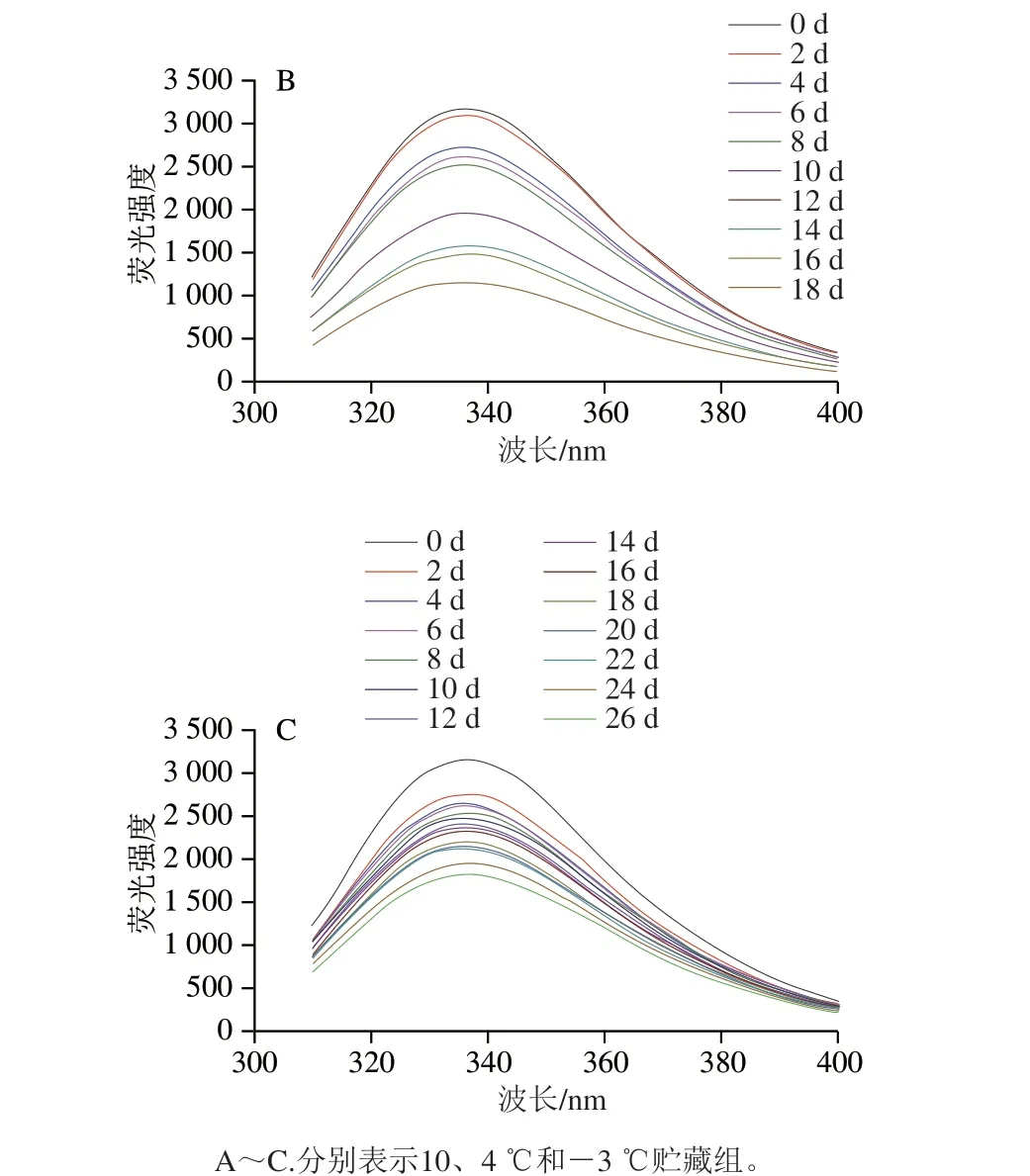
图10 低温贮藏下暗纹东方鲀肌原纤维蛋白内源荧光光谱的变化Fig. 10 Changes in intrinsic fluorescence intensity of myofibrillar protein in Takifugu rubripes under low temperature storage
2.4 相关性分析结果

表3 低温贮藏下暗纹东方鲀弛豫时间和品质指标的相关性Table 3 Correlation between relaxation times and quality indicators of Takifugu rubripes under low temperature storage
如表3所示,不同温度贮藏组T21和蛋白质、质地参数无显著相关性(P>0.05)。T2b、T22和离心损失率、汁液损失率、WSP含量、二硫键含量、β-折叠相对含量、总FAA含量、弹性、SOP含量、巯基含量、Ca2+-ATPase活力以及肌原纤维蛋白荧光强度显著(P<0.05)或极显著(P<0.01)相关,其中,10、4、-3 ℃条件下鱼肉的T2b、T22与Ca2+-ATPase活力的相关性系数分别是-0.975、-0.980,-0.967、-0.957,-0.980、-0.897。综上所述,相关性分析显示暗纹东方鲀的蛋白质、质地变化与弛豫时间(T2b和T22)有关,可以在低温贮藏过程中通过LF-NMR监测鱼肉的品质变化。
3 结 论
根据LF-NMR结构分析,贮藏温度对鱼肉的弛豫时间(T2b、T21和T22)影响较大。随贮藏时间延长,10、4 ℃和-3 ℃组鱼肉水分损失(蒸煮、离心和汁液损失)呈上升趋势,而鱼肉的弹性和硬度总体上均呈下降趋势;WSP、二硫键、羰基和总游离氨基酸含量呈上升趋势,而SOP、总巯基含量和Ca2+-ATPase活力呈下降趋势,表明蛋白质在低温贮藏过程发生了降解和氧化。内源性荧光光谱显示肌原纤维蛋白荧光强度随贮藏时间延长逐渐降低,而红外光谱结果表明α-螺旋和β-折叠相对含量分别呈波动下降和上升趋势,说明肌原纤维蛋白的二级和三级结构均发生变化。结合蛋白质相关指标测定结果和扫描电子显微镜观察结果可以得出,虽然低温有助于抑制蛋白质的降解和氧化,但是微冻条件下的冰晶会影响鱼肉的质地。由相关性分析结果可知,鱼肉在贮藏过程中的蛋白质和质地参数与T2b、T22呈显著(P<0.05)或极显著(P<0.01)相关,因此通过检测横向弛豫时间可快速无损监测低温贮藏期间暗纹东方鲀的品质变化。
