产黄青霉发酵鸭肉制品食用品质、微观结构及物理化学特性变化
2020-11-27蓝天婵孙京新王淑玲郭丽萍王宝维郝小静乔昌明
蓝天婵,于 冰,孙京新,*,王淑玲,郭丽萍,王宝维,黄 明,郝小静,乔昌明
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.青岛农业大学青岛特种食品研究院,山东 青岛 266109;3.青岛农业大学校医院,山东 青岛 266109;4.南京农业大学 国家肉品质量安全控制工程技术研究中心,江苏 南京 210095;5.青岛市畜牧兽医研究所,山东 青岛 266100;6.诸城外贸有限责任公司,山东 诸城 262200)
发酵肉制品以其独特的色、香、味、质地以及营养、健康等特点广受赞誉[1]。肉类发酵是微生物及其产生的酶与肉类成分(脂类和蛋白质)作用的过程,涉及复杂的物理、化学和感官变化[2-3]。随着发酵技术和发酵剂研究的不断深入,除了传统的发酵火腿和发酵香肠,一些新的发酵加工技术和产品也被应用于食品领域。Geeta等[4]将添加葡萄糖和淀粉并经过植物乳杆菌发酵的鸡肉糜制作鸡肉香肠,具有很好的抗氧化和抗菌效果。孙京新等[5]通过在灭菌肉块表面接种微胶囊霉菌发酵剂,克服传统发酵剂在肉制品发酵过程中发酵期长的缺点,进一步提高发酵肉制品的工业化程度。Chen Qian等[6]用戊糖片球菌、弯曲乳杆菌和木糖葡萄球菌的发酵剂混合物发酵哈尔滨风干肠,以改善风味。陈曦等[7]从贵州酸肉中分离出植物乳杆菌用于香肠的发酵,从而提高了香肠的品质特性。阮一凡等[8]以植物乳杆菌和酿酒酵母菌发酵鸭腿,提升产品口感并延长产品贮藏期。
各种真菌可在肉制品发酵过程中根据其生长优势产生有益或有害的影响。一些真菌有助于调味、抗氧化和保护作用,而另一些真菌能够导致腐败、异味和真菌毒素污染[9]。孙京新等[10]通过紫外线诱变一株原始纳地青霉,筛选出经诱变的一株高产蛋白酶纳地青霉,并将其应用于发酵畜禽原料糜类饼状产品,该菌株产蛋白能力强,降解蛋白质程度大,可以显著改善产品质构。产黄青霉(Penicillium chrysogenum)是一种丝状真菌,能够产生青霉素和多种酶类,常用于抗生素生产。在食品和饮料工业中,可从产黄青霉中提取葡萄糖氧化酶,作为安全无毒的防腐剂和稳定剂[11]。在发酵肉制品中,产黄青霉菌作为有益菌种常用于发酵香肠[12]。一般而言,有益菌种为纳地青霉和产黄青霉,而赭曲霉和疣状青霉则是造成霉菌毒素污染的主要原因。例如在产黄青霉接种的香肠中,产黄青霉的生长导致非蛋白氮值和氨基酸分解代谢中的挥发物增加,香气强度增加,硬度降低[13-14]。目前对鸭肉及鸭肉副产物深加工的研究较少,但都集中在以生肉为原料、以乳酸菌和葡萄球菌为主发酵剂的纯菌或者混菌发酵[15-16],国内外鲜见以产黄青霉为发酵剂发酵熟鸭肉的报道。本实验将产黄青霉接种于灭菌熟鸭肉中,经过前发酵、后发酵得到产黄青霉发酵鸭肉制品,并对其质地、微观结构、蛋白质构象、水分分布及挥发性物质进行测定。
1 材料与方法
1.1 菌株、材料与试剂
产黄青霉(Penicillium chrysogenum)由中国工业微生物菌种保藏管理中心提供。
新鲜鸭胸肉购自大润发超市。
戊二醛 汕头市茂城利发化工有限公司;四氧化锇北京格林莱特商贸有限公司;叔丁醇、醋酸双氧铀、柠檬酸铅 上海谱振生物科技有限公司;Epon-812环氧树脂北京达昱科仪科技有限公司;所有试剂均为分析纯。
1.2 仪器与设备
TA-XT2i质构仪 英国Stable Micro Systems公司;7500F扫描电子显微镜 日本JEOL公司;HT7700透射电子显微镜 日本日立高新技术公司;HR800显微激光拉曼光谱仪 法国Jobin-Yvon公司;MR20-025低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)仪上海纽迈电子科技有限公司;7890A-5975C气相色谱(gas chromatography,GC)-质谱(mass spectrometry,MS)联用仪 美国Agilent公司。
1.3 方法
1.3.1 产黄青霉菌悬液的制备
将保藏的产黄青霉菌株接入察氏琼脂培养基斜面,置于(27±1)℃恒温培养箱中培养4 d后,连续转接3 次,获得活化菌株。将活化好的菌株用适量无菌水洗涤,加入玻璃珠充分振荡后,用无菌纱布进行过滤,并用无菌水冲洗滤渣3 次,6 000×g离心10 min,获得孢子悬浮液。将孢子悬浮液进行梯度稀释,选择106CFU/mL左右浓度梯度稀释液作为接种的菌悬液。
1.3.2 发酵鸭肉制品的制备
将鸭胸肉切成3.0 cm×3.0 cm×1.0 cm块状,每份取4 块置于10 cm平皿中。在121 ℃、0.1 MPa条件下灭菌15 min。将制备好的产黄青霉菌悬液在无菌操作下接种于鸭肉中,每皿接种2 mL菌悬液,空白接种2 mL无菌水,混匀,在(27±1)℃条件下前发酵7 d后,将平皿中的肉块转移至质量分数4%氯化钠溶液中,密封,在30 ℃恒温条件下后发酵14 d分别得到发酵和对照鸭肉制品。
1.3.3 质构测定
在室温条件下,用质构仪测定样品,重复3 次。参照Park等[17]的方法采用二次下压法测定质构,具体参数如下:探头型号为P/0.5R柱状,测试前速率2.0 mm/s、测试速率1.0 mm/s、测试后速率5.0 mm/s、下压距离8.0 mm、触发力5.0 g,测定参数为硬度、弹性和黏性。
1.3.4 扫描电子显微镜和透射电子显微镜微观结构观察
将对照和发酵鸭肉制品用无菌水洗涤,切成0.5 cm×0.5 cm×0.3 cm条状,置于体积分数2.5%戊二醛溶液中,4 ℃固定过夜,用磷酸盐缓冲液漂洗6 次,每次20 min。再将样品放入用0.2 mol/L的磷酸盐缓冲液(pH 7.4)配制的体积分数1.0%四氧化锇溶液中,4 ℃固定2 h,然后用0.1 mol/L的磷酸盐缓冲液(pH 7.4)漂洗6 次,每次10 min;漂洗后的肉样品依次用体积分数50%、60%、70%、80%和90%的乙醇梯度脱水15 min,无水乙醇脱水3 次,每次30 min;样品脱水后,用叔丁醇置换3 次,每次30 min;将脱水后的肉样品进行真空冷冻干燥,用真空离子溅射镀膜机对肉样喷金,在扫描电子显微镜(电压为15 kV)下放大1 000 倍观察。与此同时,将肉样品在一系列分级的乙醇溶液中脱水,然后包埋在环氧树脂中。用醋酸双氧铀和柠檬酸铅进行超薄切片染色,自然干燥后在透射电子显微镜(电压为80 kV)下放大5 000 倍观察。
1.3.5 拉曼光谱测定
如Chen Hongye等[18]的方法所述,将对照和去除产黄青霉菌膜的发酵鸭肉样品进行拉曼光谱测定,激光器波长为785 nm,功率为100 mW,操作条件:开孔为200 μm,光栅600 g/mm,进行3 次扫描,积分时间为60 s,分辨率为2 cm-1,数据获取速率为120 cm-1·min-1,获取的拉曼光谱在300~3 500 cm-1。根据苯丙氨酸环在1 003 cm-1处伸缩振动强度作为内标进行归一化(强度不随蛋白质结构变化而变化)[19]。氨基酸侧链光谱条带以及肽键骨架振动指认通过与文献报道的多肽和蛋白质拉曼光谱相比对而得到[20-22]。每个样品进行3 次测试,测试完成后用仪器自带的Labspec软件对光谱进行平滑、多点基线校正去除荧光背景。参考Susi等[23]的方法计算蛋白质二级结构(α-螺旋、β-折叠、β-转角和无规卷曲)的相对含量。
1.3.6 LF-NMR测定
称取对照和去除产黄青霉菌膜的发酵鸭肉样品各1.5 g,保鲜膜包好后,装入15 mm的核磁管,而后放入LF-NMR仪,用CPMG脉冲序列进行横向驰豫时间(T2)的测试,使用SIRT算法进行1 000 000 次迭代拟合[24]。所使用的参数为:90°脉宽为4.5 μs、180°脉宽为9 μs、采样频率为200 kHz、开始采样时间为20 μs、等待时间为5 000 ms、模拟增益为20、数字增益为3、累加采样为4、回波时间为300 μs、回波个数为6 000 个,重复扫描8 次。
1.3.7 GC-MS测定
将对照和去除产黄青霉菌膜的发酵鸭肉样品分别在室温下剪碎至黄豆粒大小,各取5 g于固相微萃取瓶中,萃取头在GC进样口老化60 min(280 ℃)后插入瓶中顶空部分,在60 ℃条件下萃取60 min,吸附结束后,拔出萃取头,再于GC进样口250 ℃下解吸2 min。
G C-M S 条件:采用T R-5-M S 毛细管色谱柱(30 m×0.25 mm,0.25 μm);升温程序:起始柱温40 ℃,保持3 min,以5 ℃/min升温至200 ℃,再以10 ℃/min升温至240 ℃,保留10 min,运行总时间为49 min、检测温度240 ℃、载气为He、流速为1.6 mL/min、恒压13.02 kPa、离子源温度240 ℃、电子能量70 eV。化合物经过计算机检索同时与NIST Library、Wiley Library、Mainlib数据库匹配。匹配度和反匹配度大于600(最大值1 000)的作为定性结果。采用相对含量按峰面积归一化法处理,进行挥发性物质定量分析。
1.3.8 感官评定
将对照和去除产黄青霉菌膜的发酵鸭肉样品切成均匀的薄块,由8 名有经验的人员分别从色泽、香气、滋味和组织形态4 个方面对样品进行感官评定,分值标准见表1,每项指标的权重分别记为X1、X2、X3、X4,总分X=0.15X1+0.35X2+0.35X3+0.15X4。

表1 鸭肉制品感官评分标准Table 1 Criteria for sensory evaluation of fermented duck meat
1.4 数据处理与分析
采用SPSS 19.0软件中的ANOVA法进行方差分析,并用Duncan’s多重比较,差异显著性水平为P<0.05。运用Excel软件作图。
2 结果与分析
2.1 质构特性测定结果
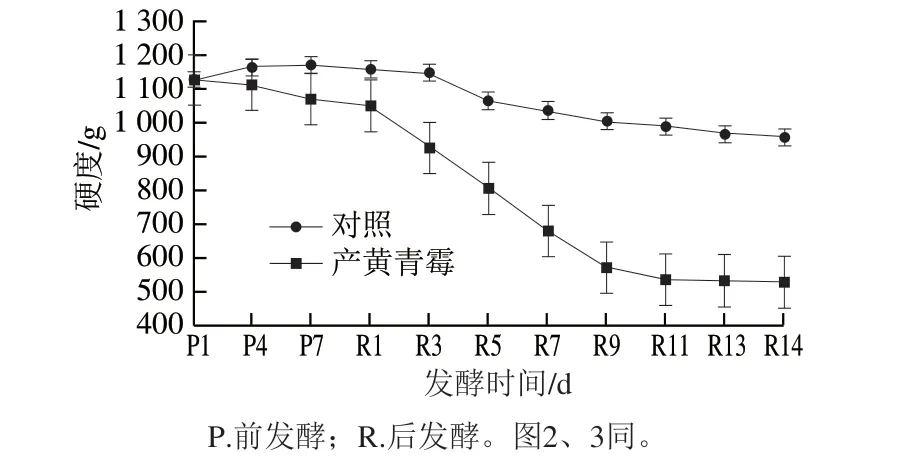
图1 发酵过程中鸭肉样品硬度变化Fig. 1 Changes in hardness of duck meat during fermentation
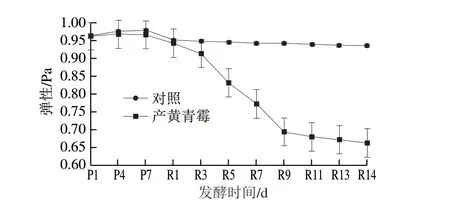
图2 发酵过程中鸭肉样品弹性变化Fig. 2 Changes in springiness of duck meat during fermentation
硬度能够衡量成熟程度,与肉蛋白的变性、水解以及水分损失有关[25]。从前发酵7 d开始,产黄青霉发酵鸭肉硬度比对照组(未发酵鸭肉)明显降低(图1)。从后发酵5 d开始,产黄青霉发酵鸭肉弹性比对照组明显降低(图2)。本研究中样品随着发酵过程中蛋白质水解程度的增加,产生大量水溶性物质,蛋白质的网状结构被破坏,样品硬度和弹性呈现下降趋势。Kargozari等[26]报道的4 种配方发酵香肠在成熟过程中弹性变化与本研究类似。除后发酵1 d外,产黄青霉发酵鸭肉比对照组黏性明显增加(图3)。Laranjo等[27]表明,在干发酵香肠发酵前期,黏性随发酵时间延长而增大。在前发酵时期,黏性先增大后减小,这与产黄青霉的生长繁殖有关。前发酵1~4 d产黄青霉生长旺盛,菌丝体分泌物增多,高水分含量导致样品表面黏性增大;前发酵5~7 d产黄青霉进入生长稳定期,大量消耗水分导致样品失水,黏性减小。刘功明等[28]用纳地青霉发酵灭菌鸡肉,发现鸡肉制品的硬度和弹性显著降低,黏性显著增加。

图3 发酵过程中鸭肉样品黏性变化Fig. 3 Changes in gumminess of duck meat during fermentation
2.2 扫描电子显微镜和透射电子显微镜观察结果
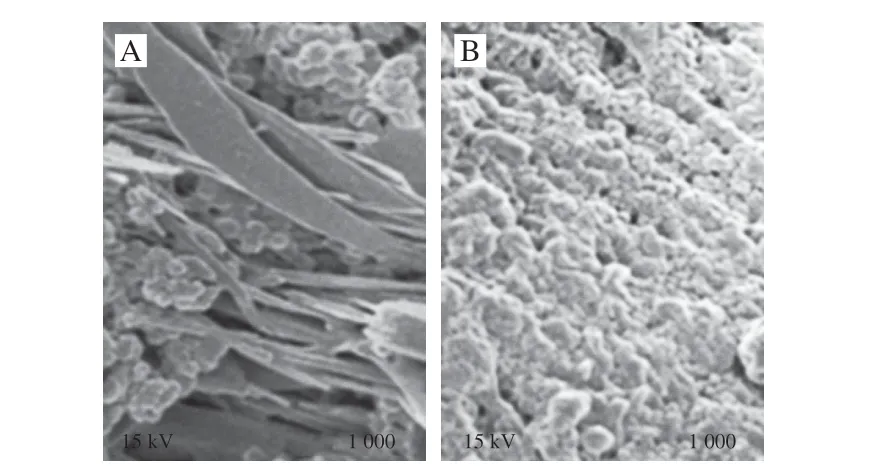
图4 对照组(A)与产黄青霉发酵鸭肉制品(B)扫描电子显微镜图(×1 000)Fig. 4 SEM micrographs of control (A) and fermented duck meat (B) (×1 000)
由图4可知,对照组经过灭菌(121 ℃、0.1 MPa)处理后,肌纤维及其中的肌原纤维结构较完整,排列较整齐;产黄青霉发酵鸭肉制品中已无完整肌纤维结构,表面微观结构均为颗粒状,无序排列、相互黏连,呈糜状。Fadda等[29]利用植物乳杆菌提高发酵肉产酸过程证明了发酵肉结构变化与蛋白分解有关。
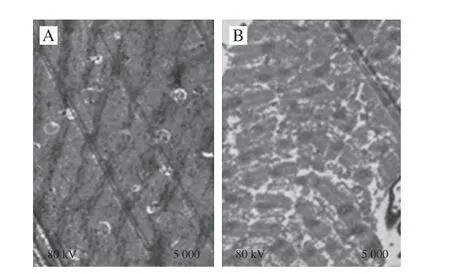
图5 对照组(A)与产黄青霉发酵鸭肉制品(B)透射电子显微镜图(×5 000)Fig. 5 TEM micrographs of control (A) and fermented duck meat (B) (× 5 000)
由图5可知,对照组肌原纤维排列紧密,肌节保持完整;产黄青霉发酵鸭肉制品无肌原纤维结构,肌节断裂为碎片状,无规则排列,且碎片间空隙明显。Katsaras等[30]通过透射电子显微镜同样发现发酵香肠的肌原纤维断裂,降解成细丝状或成絮状凝结。肌原纤维结构微观结构变化也可以解释发酵鸭肉制品硬度和弹性降低、黏性增大与产黄青霉作用密切相关。
2.3 拉曼光谱分析结果
2.3.1 蛋白质二级结构
蛋白质的二级结构包括α-螺旋、β-折叠、β-转角和无规卷曲等。拉曼光谱图中,酰胺I带和酰胺III带极少受到其他分子群的干扰,具有较强的拉曼效应,所以一般将酰胺I带和酰胺III带作为分析鉴定蛋白质二级结构的可靠模型[31]。如图6所示,拉曼光谱中酰胺I带的范围为1 600~1 700 cm-1,其中,1 645~1 657 cm-1是高α-螺旋含量的蛋白质在拉曼光谱上吸收峰所在的区域;以β-折叠结构为主的条带位于1 665~1 680 cm-1;1 680 cm-1为β-转角含量高的蛋白质吸收峰所在区域;无规卷曲结构在1 660~1 665 cm-1范围内。在酰胺III带的范围中,表征不同结构的谱带有部分重合的区域,高α-螺旋含量的蛋白质主要在1 260~1 300 cm-1,与β-转角存在重合区域;β-折叠在1 238~1 245 cm-1;无规卷曲结构出现在1 250 cm-1[32]。
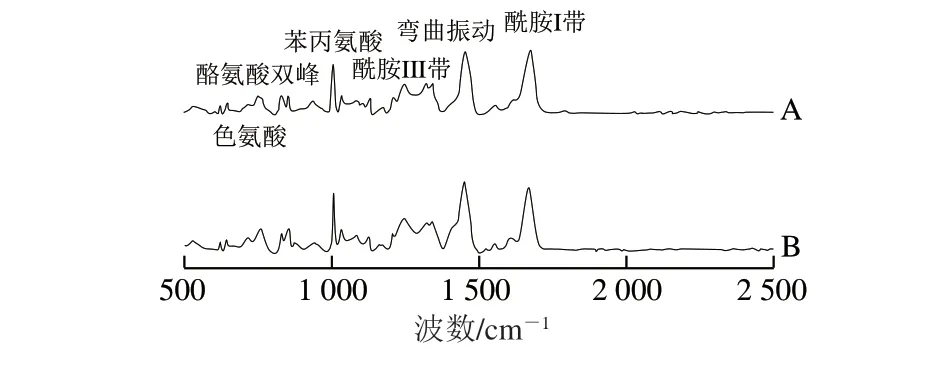
图6 对照组(A)与产黄青霉发酵鸭肉制品(B)蛋白质拉曼光谱Fig. 6 Raman spectra of control (A) and fermented duck meat (B)
产黄青霉发酵鸭肉制品蛋白质二级结构相对含量如图7所示,其中α-螺旋相对含量由57.01%降低到44.28%,β-折叠相对含量由17.65%增加到26.31%;β-转角和无规卷曲相对含量变化不明显。α-螺旋相对含量的降低和β-折叠相对含量的增加与肌肉蛋白的变化密切相关[33]。鸭肉经过产黄青霉发酵,蛋白质的网状结构被破坏,一些暴露的疏水性基团导致α-螺旋相对含量降低,从而使得产黄青霉发酵鸭肉制品硬度和弹性降低。Guo Liping等[34]用娄地青霉发酵鸡肉,鸡肉制品中α-螺旋含量降低,β-折叠含量增加,鸡肉硬度和弹性降低。
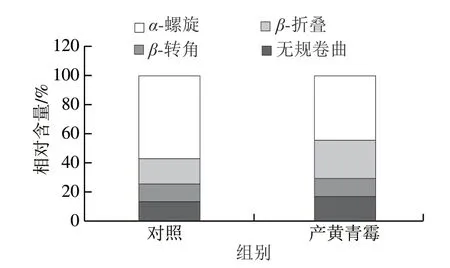
图7 鸭肉制品蛋白质二级结构相对含量Fig. 7 Secondary structure relative contents of proteins in duck meat
2.3.2 蛋白质三级结构
苯丙氨酸、色氨酸和酪氨酸等芳香族氨基酸显示出高疏水性,在维持蛋白质分子网状结构的稳定性方面起着重要作用。当蛋白质发生降解时,蛋白质分子结构会变得疏松,埋藏在蛋白质分子内部的疏水性氨基酸暴露于溶剂中,使得蛋白质非极性增强、极性减弱,从而增强了疏水性[35]。
较高强度比(I760cm-1/I1003cm-1)的色氨酸残基表示疏水环境,随着强度比的降低,色氨酸残基由疏水环境变成亲水环境。酪氨酸残基强度比(I850cm-1/I830cm-1)用于确定酪氨酸残基是否被掩埋,I850cm-1低于I830cm-1时,表示酪氨酸残基被掩埋在疏水环境中[36]。因此,色氨酸残基微环境均一化强度(I760cm-1/I1003cm-1)越大,疏水性越强;酪氨酸残基微环境均一化强度(I850cm-1/I830cm-1)越小,疏水性越强。表2为产黄青霉发酵鸭肉制品蛋白质色氨酸残基和酪氨酸残基微环境变化。与对照组相比,产黄青霉发酵鸭肉制品蛋白质色氨酸残基微环境均一化强度(I760cm-1/I1003cm-1)由0.647显著升高到0.740(P<0.0 5),酪氨酸残基微环境均一化强度(I850cm-1/I830cm-1)由0.981显著降低到0.844(P<0.05),这表明蛋白质疏水性基团暴露,其疏水性增强[37]。

表2 鸭肉制品蛋白质色氨酸残基(I760 cm-1/I1 003 cm-1)和酪氨酸(I850 cm-1/I830 cm-1)残基微环境均一化强度Table 2 Normalized intensity of microenvironment for tryptophan (I760 cm-1/I1 003 cm-1)and tyrosine (I850 cm-1/I830 cm-1) residues of proteins in duck meat
2.4 LF-NMR测定结果
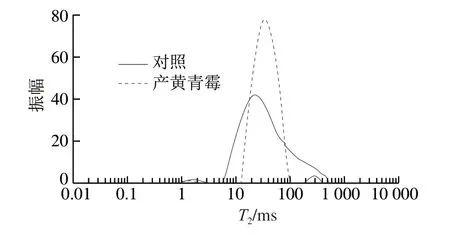
图8 鸭肉制品横向弛豫时间(T2)分布图谱Fig. 8 Distribution of transverse relaxation time (T2) of duck meat
图8 为产黄青霉发酵鸭肉制品的LF-NMR横向弛豫时间(T2)分布图谱,表3、4分别为3 种状态水分对应横向弛豫时间T20、T21、T22分布和对应积分面积P20、P21、P22分布。T20(1~10 ms)代表结合水;T21(10~100 ms)代表不易流动水;T22(100~1 000 ms)代表自由水[38-39]。P20、P21、P22分别代表3 种状态水分的相对含量。与对照组相比,产黄青霉发酵鸭肉制品横向弛豫时间T20由1.28 ms显著增加到1.76 ms(P<0.05),P20由0.77显著减小到0.68(P<0.05),这表明结合水相对含量显著降低(P<0.05);T21由19.82 ms显著增加到34.95 ms(P<0.05),P21由99.20显著减小到96.60(P<0.05),可知不易流动水相对含量显著降低(P<0.05)。水分分布变化是发酵肉制品的主要质量指标,参与了微生物生长和酶解反应,影响产品的感官品质[40]。因此,经过后发酵,最终鸭肉制品中自由水相对含量增加,表面比较湿润,赋予鸭肉良好的口感。
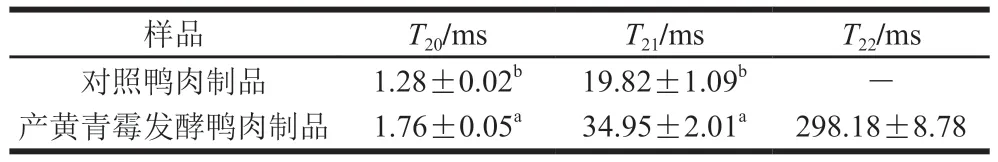
表3 鸭肉制品中3 种状态水分对应横向弛豫时间T20、T21、T22分布Table 3 Transverse relaxation times T20, T21, and T22 in duck meat

表4 鸭肉制品中3 种状态水分对应积分面积P20、P21、P22分布Table 4 Peak integral areas of three water components P20, P21 and P22 in duck meat
2.5 GC-MS分析结果

表5 鸭肉制品挥发性物质Table 5 Volatile compounds identified in duck meat
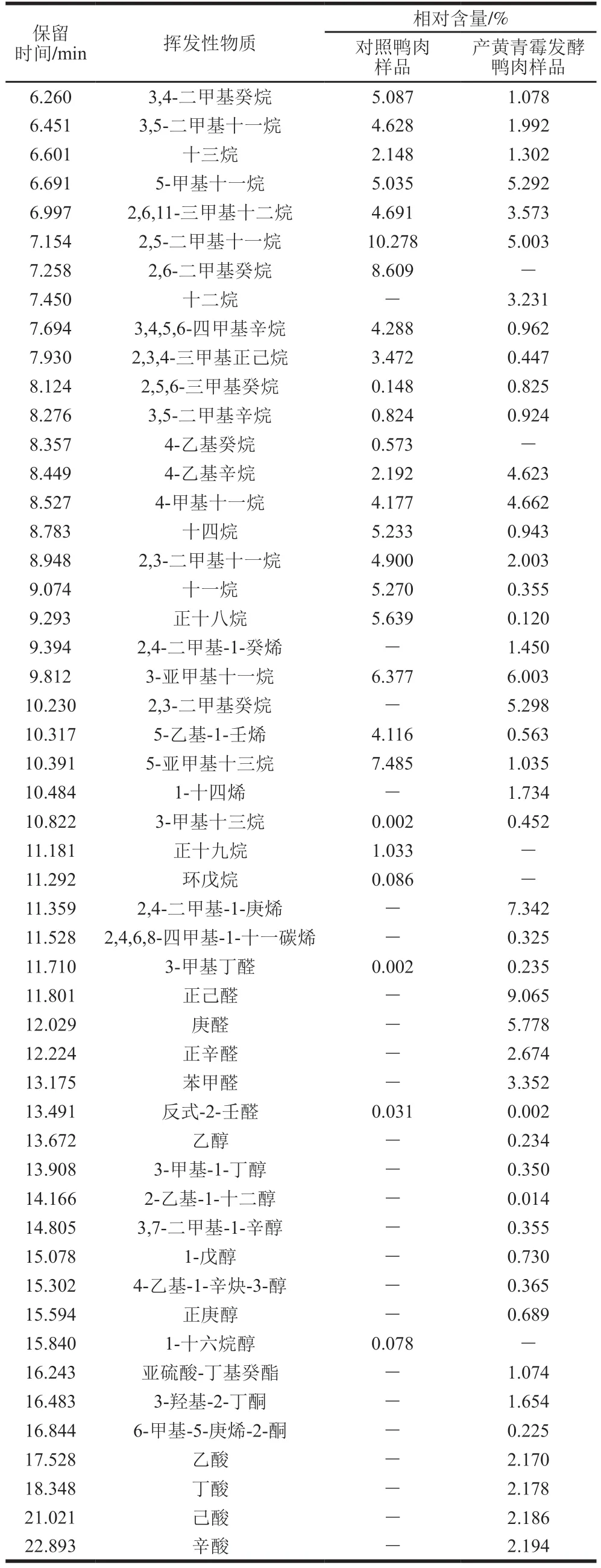
续表5
如表5所示,与对照组相比,产黄青霉发酵鸭肉制品挥发性物质在种类上有所增加。对照组中检测到挥发性
物质29 种,其中,醛类2 种、烃类26 种、醇类1 种;产黄青霉发酵鸭肉制品中检测到挥发性物质48 种,其中,醛类6 种,烃类28 种,醇类7 种,新产生的挥发性物质有酮类(3-羟基-2-丁酮、6-甲基-5-庚烯-2-酮)2 种、酯类(亚硫酸-丁基癸酯)1 种和酸类(乙酸、丁酸、己酸、辛酸)4 种。产黄青霉在肉制品发酵中,通过发达的酶系分解蛋白质、脂肪,产生小分子肽和脂肪酸,形成挥发性物质的前体。醛类是重要的中间体,能够参与氨基酸和羰基化合物的相互作用[41]。与对照相比,产黄青霉发酵鸭肉制品醛类增加了4 种(正己醛、庚醛、正辛醛、苯甲醛)。刘功明等[42]用纳地青霉发酵灭菌鸭肉,与未发酵鸭肉相比,纳地青霉发酵鸭肉制品中醇类、醛类及芳香族类物质的含量有所增加,形成了良好的风味。
2.6 感官评定结果

表6 鸭肉制品感官评定结果Table 6 Sensory evaluation results of duck meat
由表6可知,产黄青霉发酵鸭肉制品的感官评分显著高于对照组(P<0.05)。鸭肉经过产黄青霉发酵,肌原纤维被破坏,硬度和弹性明显降低,黏性明显增加。从而使产黄青霉发酵鸭肉制品质地软而松散、表面多汁,具有良好的感官品质。
3 结 论
产黄青霉发酵鸭肉及其制品与对照组相比,在质地、微观结构、蛋白质构象、水分分布和挥发性物质种类等方面发生了适于食用的品质变化。产黄青霉发酵鸭肉制品的微观结构表明,鸭肉无完整肌原纤维;产黄青霉发酵鸭肉制品的硬度和弹性明显降低,黏性明显增加;熟鸭肉经过产黄青霉发酵,在蛋白质构象方面,α-螺旋相对含量明显减少、β-折叠相对含量明显增加,疏水性显著增强(P<0.05);在水分分布方面,结合水和不易流动水相对含量显著降低(P<0.05);此外,产黄青霉发酵鸭肉制品挥发性物质种类增加,新产生的挥发性物质包括酮类、酯类和酸类。因此,产黄青霉有潜力作为发酵剂用于生产特定风味和质地的新型即食发酵肉制品,这为开发可安全食用的发酵鸭肉制品提供了一种新思路。
