冷藏过程中虾夷扇贝横纹肌微观结构变化与肌原纤维蛋白稳定性
2020-11-27姜明慧田元勇闫丽新王选飞袁春红刘俊荣
姜明慧,田元勇,2,*,闫丽新,王选飞,袁春红,刘俊荣,2
(1.大连海洋大学食品科学与工程学院,辽宁 大连 116023;2.辽宁省水产品加工及综合利用重点开放实验室,辽宁 大连 116023;3.日本岩手大学农学部食料生产环境学科,日本 盛冈 0208550)
虾夷扇贝(Patinopecten yessoensis)是我国重要的水产养殖贝类之一。我国虾夷扇贝年产量高达30万 t,零售价40~50 元/kg,产值达数百亿元[1],但活贝流通过程中运输成本高、风味下降严重等问题严重制约行业的发展[2]。我国虽然贝类产量居世界首位,但高端刺身级产品却鲜有销售,这除了与消费习惯有关之外,与基础理论研究存在局限也有很大关联。在盛行食用刺身的日本,扇贝以闭壳肌生鲜品销售方式占主要地位,研究人员围绕着贮藏温度[3]、氧气浓度[4]、清洗方法[5]以及季节[6]等因素对闭壳肌品质的影响进行了大量研究。虾夷扇贝闭壳肌包括横纹肌和平滑肌两部分,其中横纹肌所占比重大,其冰藏过程中的突出问题是由于肌肉收缩引起的质地变硬、汁液流失、口感变差。横纹肌的收缩舒张是以ATP为能量物质,在Ca2+及Mg2+参与下肌丝滑动的横桥循环过程[7]。贮藏过程中由于ATP合成终止导致横桥循环中断,进而引发了肌肉僵直。Ca2+在横纹肌的收缩过程中起到关键调节作用,贮藏过程中由于肌质网对Ca2+调节能力降低也加速了ATP的降解[8]。平滑肌虽然占比较小,但对活贝长时间维持夹持状态发挥着重要的作用,其收缩机制[9]、盐溶解性等[10]与横纹肌存在较大差异。此外,扇贝粗丝由副肌球蛋白和肌球蛋白共同构成,可结合7分子肌球蛋白,与可结合3分子肌球蛋白的脊椎鱼类以及可结合4分子肌球蛋白的甲壳类蟹存在显著差异[11]。这种蛋白结构的差异可能对不同水产品的贮藏特性产生影响。目前,扇贝横纹肌收缩机制的相关研究较多,但是关于肌肉收缩引发的肌肉微观结构和蛋白理化性质的变化缺少深入研究。本研究为解决虾夷扇贝横纹肌贮藏过程中由于肌肉收缩引发的“硬化”问题,将虾夷扇贝横纹肌进行冷藏,对僵直前、中、后不同阶段的品质变化进行了分析。通过透射电子显微镜观察横纹肌的组织结构变化,测定ATP含量、肌原纤维蛋白的Ca2+-ATPase及Mg2+-ATPase活力,分析蛋白盐溶解性的变化规律,并针对ATP含量对蛋白盐溶解性的影响进行了深入探讨。通过以上研究以期明确横纹肌冷藏过程中肌原纤维蛋白理化性质的变化规律,为最终解决贮藏过程中的“硬化”问题提供理论依据。
1 材料与方法
1.1 材料与试剂
虾夷扇贝(Patinopecten yessoensis)由大连獐子岛股份有限公司提供,质量(143.41±16.58)g、壳长度(11.17±0.27)cm。
乙二胺四乙酸二钠(ethylenediamine tetraacetic acid disodium salt,EDTA)、乙二醇双(2-氨基乙基醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)、乙酸、氯化钠、氢氧化钾 天津市科密欧化学试剂有限公司;腺嘌呤核苷三磷酸、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)试剂、β-巯基乙醇、无水甲醇 美国Sigma公司;硫酸铜、酒石酸钾钠、盐酸、硫酸、磷酸氢二钾、磷酸二氢钾、高氯酸 国药集团化学试剂有限公司;碘化钾 上海麦克林生化科技有限公司;马来酸、标准牛血清白蛋白、考马斯亮蓝R-250 北京索莱宝科技有限公司;钼酸铵、米吐尔 上海阿拉丁生化科技股份有限公司。氢氧化钾、无水甲醇、磷酸二氢钾、磷酸氢二钾均为色谱纯,其他试剂为分析纯。
1.2 仪器与设备
1260高效液相色谱仪 美国Agilent公司;AE-6500垂直电泳槽 日本ATTO公司;OS-I型回旋脱色摇床 大连竞迈公司;JEM-1200EX透射电子显微镜 日本电子公司;UV-1800PC紫外分光光度计 上海美谱达仪器有限公司;Synergy H1酶标仪 美国柏腾公司;HG-200高速分散均质机 日本HSIANGTAI;GL-21M高速冷冻离心机 德国HERMLE Labortechnik GmbH公司;BS224S型精密电子天平 北京赛多利斯仪器系统有限公司;PB-10 pH计 德国Sartorius公司;Milli-Q超纯水净化仪 美国Millipore公司。
1.3 方法
1.3.1 原料处理
活品底播虾夷扇贝送达至实验室后,立即放入充氧循环海水中缓冲处理12 h,待其生理状态稳定后快速开壳取横纹肌。置于预冷的塑料盒内,覆保鲜膜密封后4 ℃低温贮藏,分别于第0、5天观察外观和微观形态,在第0、2、5天时取样进行指标测定。
1.3.2 横纹肌的微观结构观察
取扇贝横纹肌,从中心位置切取1 mm×1 mm×3 mm的长方体,放入预冷的体积分数2.5%戊二醛溶液中固定2 h后,用4 ℃ 0.1 mol/L磷酸缓冲液清洗3 次,每次10~15 min。再用0.1 g/L四氧化锇室温下固定1~2 h,用0.1 mol/L磷酸缓冲液清洗3 次。之后分别用体积分数50%、70%、80%、90%乙醇溶液逐级脱水,再用无水乙醇脱水1 次,环氧丙烷置换2 次,每次10 min。脱水后用溶剂I(V(环氧丙烷)∶V(包埋剂)=1∶1)渗透1~2 h,再用溶剂II(V(环氧丙烷)∶V(包埋剂)=1∶2)渗透过夜,最后用纯包埋剂渗透4~5 h。将处理好的组织块包埋在包埋模板中用烤箱烘干,分别于37、45、60 ℃下烘烤12、12、24 h,聚合硬化后形成包埋块。用玻璃刀将包埋块切成薄片后,用0.2 g/L醋酸双氧铀避光染色30 min,再用柠檬酸铅染色10~20 min。超薄切片制作完成后利用JEM-1200EX透射电子显微镜对肌肉组织微观结构进行观察。
1.3.3 SDS-PAGE分析
将虾夷扇贝横纹肌肌肉切碎,加入10 倍体积缓冲液(含0.05 mol/L NaCl、20 mmol/L Tris-HCl,pH 7.5)搅匀,10 000 r/min、30 s均质3 次,即得到横纹肌全蛋白匀浆液。使用电泳上样液(含0.14 mol/L SDS、2 mol/L尿素、0.43 mol/Lβ-巯基乙醇、0.1 g/L溴酚蓝、50 mmol/L Tris-HCl,pH 6.8)将蛋白质量浓度稀释至1~2 mg/mL,混匀后100 ℃条件下加热5 min,即得到电泳样品,进样量为15 μL。采用垂直板进行PAGE,以质量分数5%浓缩胶和7.5%分离胶配制胶板。采用考马斯亮蓝R-250染色、脱色液(V(甲醇)∶V(乙酸)∶V(去离子水)=3∶1∶6)进行脱色,扫描胶片后得到电泳图谱。
1.3.4 横纹肌ATP及其关联物含量测定
ATP及其关联物(ADP、AMP、IMP、HxR、Hx)提取方法参照Hu Yaqin等[12]的方法并稍作修改。准确称取1.0 g横纹肌,加入10 mL预冷的0.8 mol/L高氯酸,冰浴下捣碎10 min,用2.0 mol/L KOH溶液调节pH值至2.0~3.5后用超纯水定容至20 mL。5 000×g条件下离心5 min,取4.0 mL上清液过膜后加入1.0 mL 0.1 mol/L磷酸盐缓冲液(pH 7.5),摇匀,采用反向高效液相色谱测定ATP及其关联化合物含量。高效液相色谱分析条件:SinoChrom ODS-BP色谱柱(4.6 mm×250 mm,5 μm);二极管阵列检测器;流动相:0.1 mol/L磷酸盐缓冲液(pH 6.5),固定相:甲醇;检测波长:254 nm;柱温:35 ℃;流速:0.7 mL/min;进样量:0.02 mL;分流比:8∶2。利用K值表征水产品的新鲜程度,按式(1)计算。

式中:ATP、ADP、AMP、IMP、HxR、Hx分别表示该物质的含量/(μmol/g)。
1.3.5 横纹肌肌原纤维蛋白提取及Ca2+-ATPase、Mg2+-ATPase活力测定
肌原纤维蛋白提取参照吴忠等[13]的方法并稍作修改。将虾夷扇贝横纹肌切碎,加入10 倍体积pH 7.5的缓冲液(含0.05 mol/L NaCl、20 mmol/L Tris-HCl,下同)搅匀,5 000×g离心5 min去上清液,重复漂洗3 次。加入10 倍体积缓冲液,10 000 r/min、30 s均质3 次,5 000×g离心5 min去上清液,重复漂洗3 次。加入适量缓冲液悬浊,过双层纱布即得到肌原纤维蛋白,全程操作均在4 ℃下进行。利用双缩脲法[14]测蛋白质量浓度,然后用缓冲溶液将蛋白质量浓度调至1.0 mg/mL用于酶活力测定。
Ca2+-ATPase、Mg2+-ATPase活力测定参考Ojima等[15]的方法并稍作修改,在玻璃管中加入9.0 mL反应液(Ca2+-ATPase:2 mmol/L ATP、5 mmol/L CaCl2、25 mmol/L pH 7.0 Tris-马来酸、0.5 mol/L KCl;Mg2+-ATPase:2 mmol/L ATP、5 mmol/L MgCl2、25 mmol/L pH 7.0 Tris-马来酸、0.1 mol/L KCl),置于20 ℃水浴锅内,5 min后加入1 mL 1 mg/mL的肌原纤维蛋白悬浊液开始反应。分别于0、2、5、10、15、20、25、30 min时取出1.0 mL混合液,加入0.5 mL 2.6 mol/L高氯酸以终止反应。静置沉淀后取0.5 mL上清液加入1.75 mL硫酸钼酸铵和0.25 mL米吐尔,混匀后25 ℃水浴发色45 min,640 nm波长处测定吸光度。Ca2+-ATPase及Mg2+-ATPase活力以每毫克蛋白每分钟分解ATP产生无机磷的物质的量表示,具体计算见公式(2)。
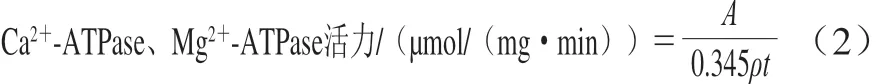
式中:ρ为反应体系中蛋白质量浓度/(mg/mL);t为反应时间/min。
1.3.6 横纹肌蛋白盐溶解度测定
将虾夷扇贝横纹肌切碎,加入10 倍体积缓冲液(含0.05 mol/L NaCl、20 mmol/L Tris-HCl,pH 7.5),10 000 r/min、30 s均质3 次,得到全蛋白匀浆液。将蛋白质量浓度调至10 mg/mL,通过添加NaCl和去离子水,将体系中NaCl终浓度分别调至0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0 mol/L,蛋白终质量浓度调整至5 mg/mL。混匀后静置20 min,10 000×g条件下离心10 min,通过上清液蛋白质量浓度和体积计算溶解度。蛋白盐溶解度的计算见公式(3)。
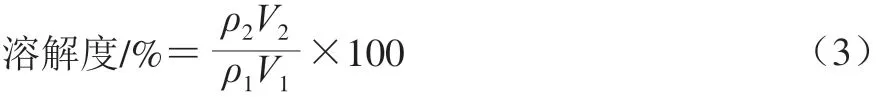
式中:ρ1为全蛋白匀浆液中蛋白质量浓度/(mg/mL);V1为全蛋白匀浆液体积/mL;ρ2为离心后上清液中蛋白质量浓度/(mg/mL);V2为离心后上清液体积/mL。
1.3.7 横纹肌蛋白盐溶解度的测定及蛋白组分分析
在1.3.6节中得到的横纹肌全蛋白匀浆液中添加外源ATP,并通过添加去离子水和NaCl将体系中ATP终浓度分别调至0、1、2、5、10、20 mmol/L,NaCl终浓度为0.5 mol/L,蛋白终质量浓度为5 mg/mL,混匀后静置20 min,10 000×g条件下离心10 min,测定上清液体积和蛋白质量浓度后,按公式(3)计算蛋白盐溶解度。
将新鲜的扇贝横纹肌切碎后分为3 组,分别加入10 倍体积的缓冲液A(含5 mmol/L EDTA、0.05 mol/L NaCl、20 mmol/L Tris-HCl,pH 7.5)、缓冲液B(含5 mmol/L EGTA、0.05 mol/L NaCl、20 mmol/L Tris-HCl,pH 7.5)和缓冲液C(含0.05 mol/L NaCl、20 mmol/L Tris-HCl,pH 7.5),10 000 r/min、30 s均质3 次后,分别作为EDTA组、EGTA组及对照组,对均质后3 组中ATP、ADP、AMP含量和盐溶解度、上清液蛋白组成进行比较。
1.4 数据处理与分析
实验数据均采用平均值±标准差的形式表示,用Excel 2003软件进行方差统计分析及图表绘制。
2 结果与分析
2.1 虾夷扇贝冷藏期间横纹肌组织结构的变化
2.1.1 虾夷扇贝外观形态变化

图1 虾夷扇贝横纹肌冷藏期间的形态变化Fig. 1 Shrinkage of scallop striated adductor muscle during chilling storage
如图1所示,横纹肌在贮藏过程中僵直明显,质地变硬,光泽度及饱满度变差,体积明显缩小。贮藏5 d后其厚度减少了20%。通常鱼类死后,贮藏过程中鱼体在肌肉收缩力和骨骼支撑力的作用下,呈现“僵直-解僵”过程并出现裂缝。而扇贝横纹肌离体后无骨骼支撑,贮藏过程中肌肉收缩导致宏观呈现出逐渐“硬化”的状态,未观察到“解僵”过程和裂缝现象。这种宏观变化对肌肉的微观结构和功能性也产生了较大影响,如攀鲈鱼在贮藏过程中持水能力会逐渐下降[16]。同时,肌肉中水分含量的降低也会对其微观结构产生影响[17]。
2.1.2 虾夷扇贝微观结构变化
在贮藏开始时,虾夷扇贝横纹肌肌纤维的结构完整,Z线清晰,肌节平均长度为0.75 μm(图2A1);贮藏5 d后肌纤维结构仍相对完整,但Z线变得模糊,肌束间隙增大,肌节平均长度为0.62 μm,比0 d时明显缩短约17.33%,此外,肌原纤维之间可观察到大量空泡(图2A2)。0 d 时横纹肌中线粒体结构完整、数量多、体积大(图2B1);5 d时线粒体出现明显空泡样变,嵴断裂严重,但双层膜结构仍完整(图2B2)。Ayala等[18-19]对鲷鱼肌肉微观结构进行观察也发现,在4 ℃冷藏5 d后,Z线出现轻微的断裂,线粒体肿胀且内部浑浊。以上结果说明冷藏期间横纹肌的微观结构仍比较完整,肌纤维结构比较清晰;但肌纤维连接处出现大量空泡、Z线模糊。因此需进一步探讨虾夷扇贝冷藏过程中是否发生了蛋白质的降解。
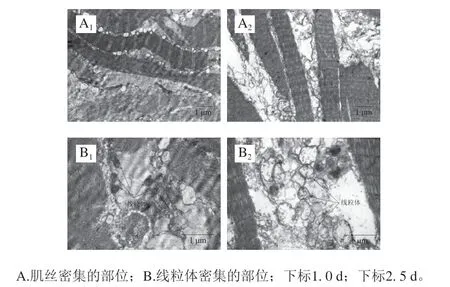
图2 横纹肌冷藏期间微观结构变化Fig. 2 Changes in microstructure of striated adductor muscle during chilling storage
2.1.3 虾夷扇贝横纹肌蛋白组成的变化

图3 虾夷扇贝横纹肌冷藏期间蛋白组成的变化Fig. 3 Changes in protein components in scallop striated adductor muscle during chilling storage
利用SDS-PAGE对贮藏0、2、5 d的扇贝横纹肌进行全蛋白组分分析,结果如图3所示,贮藏期间肌球蛋白、副肌球蛋白、肌动蛋白等各组分的蛋白含量均未出现明显变化,未观察到新条带的产生。虾夷扇贝横纹肌在冰藏条件下,水溶性蛋白的含量在5 d内也无显著变化[20]。相比之下,鳝鱼肌肉在冷藏5 d内,肌球蛋白和肌动蛋白均出现了明显的降解[21]。可能是与鱼类肌肉相比,一方面扇贝横纹肌的蛋白性质比较稳定;另一方面,本研究在前处理过程中除去了消化腺,减少了冷藏期间蛋白酶对蛋白质的降解。因此虾夷扇贝生鲜闭壳肌产品的贮藏优势较大。
2.2 虾夷扇贝冷藏期间横纹肌品质变化
2.2.1 ATP及其关联物含量变化
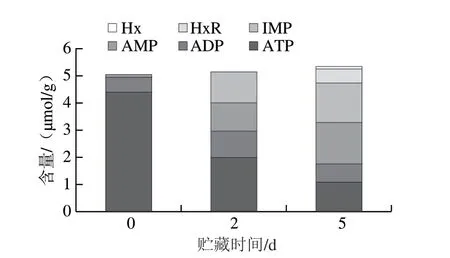
图4 虾夷扇贝横纹肌冷藏期间ATP及其关联物含量变化Fig. 4 Changes in contents of ATP and related compounds in scallop striated adductor muscle during chilling storage
虾夷扇贝横纹肌冷藏期间ATP及其关联物含量变化如图4所示,0 d时的ATP含量为4.39 μmol/g。2 d时中ATP含量为1.98 μmol/g,未检测到HxR和Hx,K值为0。K值是评价水产品鲜度的常用指标,一般认为水产品K值小于20%时为非常新鲜。贮藏5 d时仍检测到ATP含量为1.07 μmol/g,虽然检测到了HxR及Hx,但K值仅为11.6%。相比之下,活品扇贝在离水干露3 d时出现死亡,ATP耗尽[22];大菱鲆和带鱼在冷藏5 d时K值升高至40%左右,处于轻微腐败初期[23-24]。表明扇贝横纹肌在冷藏期间新鲜度较好、品质下降慢。
2.2.2 肌原纤维蛋白的Ca2+-ATPase及Mg2+-ATPase活力变化

图5 虾夷扇贝横纹肌冷藏期间肌原纤维蛋白的Ca2+-ATPase及Mg2+-ATPase活力变化Fig. 5 Changes in Ca2+-ATPase and Mg2+-ATPase activity in scallop striated adductor muscle during chilling storage
肌肉蛋白的功能特性及质地特性与肌原纤维蛋白的性质密切相关[25-26],通过测定肌原纤维蛋白中肌球蛋白的Ca2+-ATPase活力可较好地反映肌肉品质。0 d时虾夷扇贝横纹肌中提取的肌原纤维蛋白的Ca2+-ATPase活力为0.41 μmol/(mg·min),冷藏5 d后其活力为0.50 μmol/(mg·min),Ca2+-ATPase活力取决于肌原纤维蛋白中的肌球蛋白,而不受肌动蛋白的影响[26-27],因此推测冷藏过程中肌球蛋白并未发生变性。此外,肌球蛋白的Mg2+-ATPase活力能够被肌动蛋白激活,常用来反映肌球蛋白和肌动蛋白的相互作用[28],并且Mg2+-ATPase具有更高的敏感性,在肌原纤维蛋白经过长时间冷藏[29]或低离子缓冲溶液反复漂洗后[30],该活力会出现异常升高。然而在本研究中,Ca2+-ATPase活力在冷藏期间也出现了反常的升高现象,推测是虾夷扇贝横纹肌冷藏过程中的肌肉收缩使得肌动蛋白和肌球蛋白的结合更加紧密,肌球蛋白与肌动蛋白的结合作用以及提取的肌原纤维蛋白中残留的Mg2+,共同激活了Mg2+-ATPase的活性,导致实际检测到的Ca2+-ATPase活力中包含了Mg2+-ATPase的部分,使得Ca2+-ATPase活力最终呈现出升高的现象。因此,进一步讨论肌动蛋白和肌球蛋白的结合作用是否也对肌肉蛋白溶解性产生了影响。
2.2.3 横纹肌冷藏期间蛋白盐溶解度变化
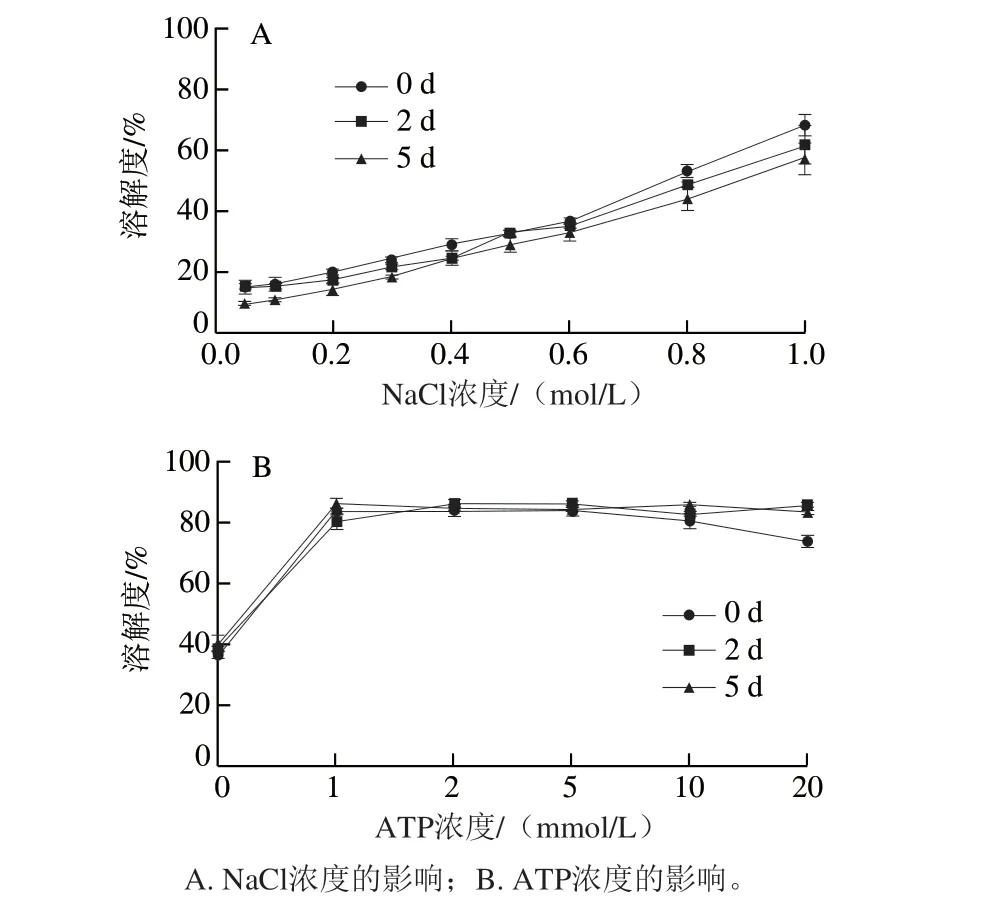
图6 虾夷扇贝横纹肌冷藏期间蛋白溶解性变化Fig. 6 Changes in salt solubility of protein in scallop striated adductor muscle during chilling storage
蛋白的溶解度与肌球蛋白杆部的性质密切相关,如肌球蛋白杆部的降解、聚合会导致蛋白的盐溶解度下降[31-32]。由图6A可知,贮藏相同的时间,虾夷扇贝横纹肌的蛋白溶解度随着NaCl浓度的增加均呈线性上升趋势,贮藏时间对蛋白的盐溶解度影响不大。通常,随NaCl浓度的增加,鱼类肌肉蛋白溶解度呈S型上升,在NaCl浓度为0.3 mol/L左右时其蛋白的溶解度迅速升高,在0.5 mol/L附近几乎全部溶出,溶解度可达到80%左右[33],且肌肉鲜度越高溶解度越高。吴忠[34]研究发现,虾夷扇贝横纹肌的水溶性蛋白质量分数约为39%,盐溶性蛋白质量分数为34%。但在本研究中,扇贝在鲜度很高的0 d时,横纹肌肌肉蛋白盐溶解度依然很低,在1.0 mol/L NaCl溶液中的溶解度仅约为60%,并且上文中Ca2+-ATPase活力实验证明了肌球蛋白并未发生变性,推测可能由于ATP的降解促使肌球与肌动蛋白紧密结合形成了肌动球蛋白,出现了超沉淀现象,对肌肉蛋白的盐溶解性产生了影响。为验证该推测,在含0.5 mol/L NaCl的扇贝肌肉匀浆液中添加外源ATP,再次评价了肌肉蛋白盐溶解度的变化,结果如图6B所示。贮藏不同时间的横纹肌的肌肉蛋白在添加超过1.0 mmol/L的ATP后,蛋白溶解度均达到了80%以上。表明虾夷扇贝横纹肌由于肌动蛋白和肌球蛋白的结合作用导致了盐溶解性降低。并且在冷藏5 d内,肌球蛋白与肌动蛋白在结合状态下通过添加ATP可重新解离,表明其并未丧失活性。
2.2.4 ATP对横纹肌蛋白盐溶解度的影响
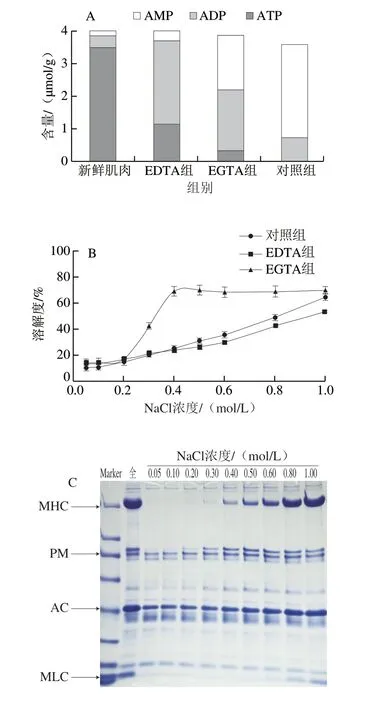

图7 ATP对虾夷扇贝肌肉蛋白盐溶解性的影响Fig. 7 Effect of ATP on salt solubility of scallop striated adductor muscle proteins
贮藏0 d的扇贝横纹肌并未出现肌肉收缩现象致使肌球和肌动蛋白结合,但蛋白溶出效果仍然很差。推测可能是在均质过程中细胞破碎导致Ca2+流出,激活了Ca2+-ATPase活性,而较高的Ca2+-ATPase活性会导致ATP迅速分解,进而引起肌动蛋白和肌球蛋白的结合,导致蛋白溶解度较差;因此,通过添加EDTA和EGTA螯合肌肉中的Mg2+、Ca2+等金属离子来控制其ATPase活性,进一步探究均质过程导致的ATP含量变化对肌肉蛋白盐溶解性的影响。如图7所示,对照组的均质过程导致肌肉中ATP完全被消耗,而EDTA处理组和EGTA处理组中仍能检测到少量的ATP,分别为1.17 μmol/g和0.34 μmol/g。同时,EGTA添加组中,由于肌肉中依然有ATP和Mg2+残余,促进了肌球和肌动蛋白解离,因此,在0.4 mol/L NaCl浓度下,溶解度由对照组的25%上升到了70%(图7B),并且和对照组相比在上清液中可检测到大量的肌球蛋白(图7C、D)。Niki等[35]的研究也证明,在肌原纤维蛋白中同时添加Mg2+、EGTA和ATP能有效促进肌球与肌动蛋白的解离。
3 结 论
虾夷扇贝横纹肌在冷藏5 d后处于完全“硬化”的状态。此时,肌肉中线粒体出现空泡样变,嵴断裂严重,但肌纤维的微观结构仍比较完整、肌肉中仍有ATP残留、K值在5 d 时仅为11.6%,鲜度较高。“硬化”状态下,ATP的降解促使肌动蛋白和肌球蛋白紧密结合,激活了肌球蛋白的Mg2+-ATPase,并形成了肌动球蛋白超沉淀,导致肌肉蛋白盐溶解性降低,但是通过外源添加ATP后蛋白溶解度明显升高,表明这种结合作用是可逆的,横纹肌肌肉蛋白仍具有较好的功能性。探讨控制虾夷扇贝横纹肌“硬化”的方法,对于提高产品的品质和延长货架期非常重要,有必要继续深入研究。
