维持性血液透析患者血清低氧诱导通路相关指标水平与肾性贫血的相关性
2020-11-26王金鑫王杨威张艺献郭思如苗里宁
王金鑫,王杨威,张艺献,郭思如,苗里宁,孙 晶
(吉林大学第二医院 肾病内科,吉林 长春130022)
慢性肾脏疾病是多因素较复杂的疾病,最终多数以肾脏替代治疗为主,其中维持性血液透析(maintenance hemodialysis,MHD)患者人数呈逐年上升趋势,而肾性贫血是其较常见的并发症,其发病率不断升高。研究发现肾性贫血机制复杂,除促红细胞生成素(erythropoietin,EPO)缺乏外,铁代谢、炎症及低氧诱导通路的调节等因素也发挥了重要作用[1]。铁调素(Hepcidin)又名肝脏抗菌多肽,是由肝脏细胞合成并分泌入血的一种小分子肽类激素,是铁稳态的重要调节因子。低氧诱导因子(hypoxia inducible factor,HIFs)是功能亚基α和结构亚基β组成的异源二聚体,其中HIF-α(HIF-1α、HIF-2α、HIF-3α)决定了其生物学活性[2]。HIF-1α与HIF-2α共同促进氧传递和细胞对缺氧的适应[3]。HIFs介导的低氧诱导通路是调节铁代谢、改善贫血的重要途径,而脯氨酰羟化酶(prolyl hydroxylase domain,PHD)是该通路的关键酶。PHD属于Fe2+、2-酮戊二酸依赖的双加氧酶超家族成员,主要包括4种亚型(PHD1、PHD2、PHD3、PHD4),其中PHD2是调节HIFs稳定性的重要亚型[4]。故本研究旨在通过检测血清中Hepcidin、HIF-1α、HIF-2α、PHD在MHD患者中表达水平,比较各个指标在MHD患者血清中的表达差异及与肾性贫血相关指标的关系,通过定量数据分析探讨低氧诱导通路在介导肾性贫血中的影响机制,对改善肾性贫血提供临床指导。
1 资料与方法
1.1 研究对象
选取2019年1月-2020年1月于吉林大学第二医院血液净化中心行长期规律MHD患者为研究对象。入组标准:①符合终末期肾脏病的诊断以及MHD的指征,MHD 3次/周≥12个月,使用动静脉内瘘患者;②年龄≥18岁;③定期复查相应实验室指标,临床资料完善;④无铁、叶酸等造血原料缺乏。排除标准:①存在各种病因导致的溶血、造血障碍等血液系统疾病者;②合并其他出血性疾病者;③合并肝炎、肿瘤等恶病质者;④合并严重感染者;⑤难治性心衰及严重心脑血管疾病患者;⑥应用除EPO之外的其他升血药物者;⑦近1年内曾输血患者。由以上标准,共计入组120例患者。根据血红蛋白(hemoglobin,Hb)水平及有无应用EPO,分为EPO应答组:应用4个月以上正规EPO治疗且Hb≥110 g/L;EPO低应答组:应用4个月以上EPO(≥150 IU·kg-1·周-1)治疗且Hb<110 g/L[4];无贫血组:近4个月内未使用过EPO治疗且Hb≥110 g/L;贫血未治疗组:近4个月内未使用过EPO治疗且Hb<110 g/L。本研究经吉林大学第二医院医学伦理学委员会批准,研究对象均签署知情同意书。
1.2 研究方法
1.2.1临床资料 收集入组患者基本信息:姓名、性别、年龄、原发病、体质指数(Body Mass Index,BMI)、透前收缩压、透后收缩压、EPO用量等。
1.2.2实验室检查 记录患者入组时血液学检验信息:Hb、红细胞计数、红细胞压积、血小板计数、白细胞计数、血浆白蛋白、血肌酐、血尿素氮、血尿酸、血钙、血磷、甲状旁腺激素、血清铁浓度、血清铁蛋白、转铁蛋白饱和度等。
1.2.3样本的检测 采用双抗体夹心酶联免疫吸附法,测定入组患者的血清中Hepcidin(R&D Systems,美国)、PHD( GenWay,美国)、HIF-1α和HIF-2α (MyBioSource,美国)表达水平,操作步骤严格按照试剂盒说明书进行。
1.3 统计学方法

2 结果
2.1 一般资料
共纳入120例MHD患者,其原发疾病如下:慢性肾炎综合征55例(45.83%),糖尿病肾病25例(20.83%),高血压肾损害21例(17.5%),肾病综合征9例(7.5%),多囊肾病6例(5%),其他4例(3.33%),各组原发病比较无统计学意义。EPO应答组患者的BMI比EPO低应答组高,但年龄及EPO用量较EPO低应答组低,差异有统计学意义(P<0.05);EPO低应答组患者的年龄及透前收缩压比无贫血组高,差异有统计学意义(P<0.05)。其一般情况比较见表1。

表1 各组MHD患者一般情况比较(n=120)
2.2 实验室检查
入组的MHD患者中,EPO应答组患者的血肌酐、血尿酸、Hb的表达水平比EPO低应答组高,但血清铁蛋白与之相反,差异有统计学意义(P<0.05);EPO应答组患者的血清HIF-1α、Hepcidin与PHD的表达水平比无贫血组高,但HIF-2α、Hb、红细胞计数、红细胞压积与之相反,差异有统计学意义(P<0.05);EPO低应答组患者的血清HIF-1α、Hepcidin、PHD、血清铁蛋白的表达水平比无贫血组高,但血清HIF-2α、血浆白蛋白、血肌酐、Hb、红细胞计数、红细胞压积比无贫血组低,差异有统计学意义(P<0.05);EPO低应答组患者的血清HIF-1α、PHD及血清铁蛋白的表达水平比贫血未治疗组高,但血清HIF-2α的表达水平比贫血未治疗组低,差异有统计学意义(P<0.05);无贫血组患者的Hb、红细胞计数、红细胞压积的表达水平比贫血未治疗组高,但血清Hepcidin比贫血未治疗组低,差异有统计学意义(P<0.05)。其临床指标比较见表2。
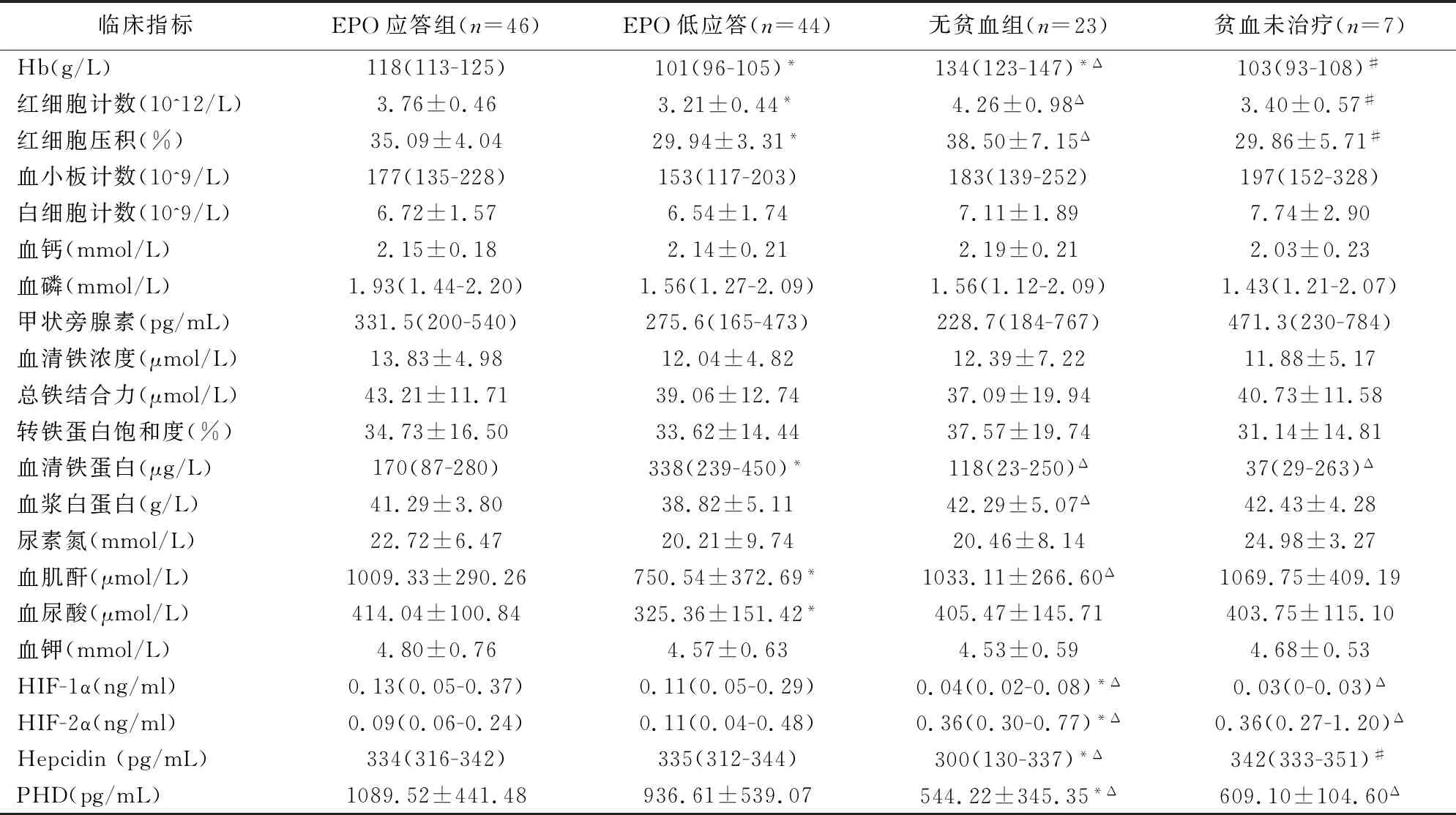
表2 各组MHD患者临床指标比较(n=120)
2.3 血清Hepcidin与相关因素分析
MHD患者血清Hepcidin水平与血清HIF-1α、血清铁蛋白、透前收缩压、年龄成正相关(图1:A-D),与Hb、红细胞计数、红细胞压积、BMI成负相关(图1:E-H),均P<0.05。见图1。

注:Hepcidin:铁调素;MHD:维持性血液透析;HIF-1α:低氧诱导因子1α;Hb:血红蛋白;BMI:体质指数
2.4 血清PHD与相关因素分析
MHD患者血清PHD的表达水平与血清HIF-1α、BMI、EPO用量、铁剂用量成正相关(图2:A-D),均P<0.05。见图2。

注:PHD:脯氨酰羟化酶;MHD:维持性血液透析;HIF-1α:低氧诱导因子1α;BMI:体质指数;EPO:促红细胞生成素。
2.5 血清HIF-1α与相关因素分析
MHD患者血清HIF-1α的表达水平与血清Hepcidin、血清铁蛋白、血清PHD成正相关(图3:A-C),与血清HIF-2α、血肌酐、血尿酸成负相关(图3:D-F),均P<0.05。见图3。

注:HIF-1α:低氧诱导因子1α;MHD:维持性血液透析;Hepcidin:铁调素;PHD:脯氨酰羟化酶;HIF-2α:低氧诱导因子2α。
2.6 血清HIF-2α与相关因素分析
MHD患者血清HIF-2α的表达水平与血清HIF-1α、EPO用量、铁剂用量成负相关(图4:A-C),与红细胞压积成正相关(图4:D),均P<0.05。见图4。
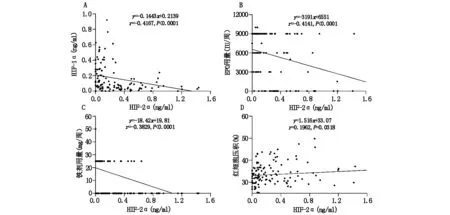
注:HIF-2α:低氧诱导因子2α;MHD:维持性血液透析;HIF-1α:低氧诱导因子1α;EPO:促红细胞生成素。
2.7 Hb与相关因素分析
MHD患者Hb水平与血清Hepcidin、血清铁蛋白、透前收缩压、EPO用量、年龄成负相关(图5:A-F),与BMI成正相关(图5:F),均P<0.05。见图5。

注:Hb:血红蛋白;MHD:维持性血液透析;Hepcidin:铁调素;EPO:促红细胞生成素;BMI:体质指数。
3 讨论
Hepcidin可经肾小球滤过,部分在近端肾小管中重吸收,最终以尿液形式排出体外。研究发现,将小鼠Hepcidin基因敲除后,小鼠体内Hepcidin表达水平下降,铁负荷升高。相反,Hepcidin基因过度表达,可使小鼠体内铁负荷降低[5]。本研究中发现MHD患者中无贫血组均较其余三组Hepcidin表达水平显著降低,无贫血患者组的Hb、红细胞计数与红细胞压积均较其余三组显著升高,相关性分析后得出Hepcidin与Hb、红细胞计数、红细胞压积成负相关,表明Hepcidin表达水平越高,MHD患者贫血越严重。MHD患者中Hepcidin表达明显增高,其一与肾功能减退,Hepcidin排泄减少有关[6],其二与MHD治疗使患者处于微炎症状态有关,高浓度的Hepcidin限制了红细胞对铁的利用,从而在炎症性贫血和EPO抵抗中起到重要作用[7,8]。
本研究中,MHD患者Hepcidin水平与炎症指标血清铁蛋白成正相关,与李萍[9]等研究结果一致。本研究还显示EPO低应答组的血清铁蛋白和Hepcidin水平较无贫血组显著增高,与相关研究结果相符[10],提示Hepcidin可能反映患者的微炎症状态。且EPO低应答组的血清铁蛋白水平较EPO应答组显著升高,Hb水平与血清铁蛋白成负相关,共同反映了慢性炎症状态可能是导致EPO低应答机制发生的部分原因。慢性贫血导致储存铁减少,加之未进行铁剂补充,因此贫血未治疗组的血清铁蛋白较其他3组低[11]。营养状况在MHD患者的疾病进展中起重要作用,本研究中发现EPO应答组患者的BMI较EPO低应答组高,与文献[12]等研究结果一致,EPO低应答组患者的血白蛋白较无贫血组低,MHD患者BMI与Hepcidin水平成负相关,与Hb水平成正相关,且年龄与Hepcidin成正相关,与Hb成负相关,共同提示营养不良与高龄患者更易受到炎症状态的影响,导致贫血与EPO低应答的发生。因此研发以Hepcidin为靶基因的药物是治疗铁代谢异常的肾性贫血及其预后的新途径,纠正营养不良与改善微炎症状态是改善肾性贫血的重要措施。Hepcidin或可成为EPO低反应的检测指标。
缺氧是MHD患者常见的病理生理改变之一,低氧诱导通路是机体应对低氧环境的重要调节机制。有研究表明,在常氧环境下HIFs被PHD羟基化进而被蛋白酶降解,使HIFs的总体表达水平降低。正常人在低氧环境下,氧敏感的PHD活性受抑制,HIF未被羟基化,使得其稳定表达,并激活一系列低氧相关的靶基因[13,14]。该通路不仅能诱导内源性EPO的表达,还可降低患者Hepcidin水平以增加体内铁利用,从而改善缺氧状态,以纠正贫血[15]。本研究中,无贫血组患者的PHD较余三组患者低,HIF-2α则相反,反映了PHD在低氧环境下活性下降、表达减少,HIF-2α因未被降解而稳定表达,是改善肾性贫血的主要因子[14]。多篇文献报道,HIF-2α是EPO合成及铁代谢的主要调节因子[16,17],EPO与铁剂用量的多少又可反应患者内源性缺失的严重程度,本研究发现EPO和铁剂用量与HIF-2α呈负相关,与PHD呈正相关,提示PHD的失活使HIF-2α稳定表达,进一步反映了PHD与HIF-2α在调节肾性贫血中的重要作用。
有研究表明,过度缺氧导致的HIF-1α活化会引起肾小管间质炎症[18],本研究中无贫血组患者HIF-1α的表达水平较余组低,且HIF-1α与Hepcidin、血清铁蛋白呈正相关,提示HIF-1α亦可能反映患者的微炎症状态。HIF-1α高表达可介导肾脏纤维化,加重肾脏损害[19],本研究中血清HIF-1α与血肌酐、血尿酸呈负相关,印证了上述研究结果。有研究发现[20],从HIF-1α为主要激活靶基因到HIF-2α为主要激活靶基因的转换,控制着从急性缺氧到慢性缺氧的过程,本研究中无贫血MHD患者的HIF-1α较余组患者低,HIF-2α、PHD则相反,且HIF-1α与HIF-2α、PHD成负相关,印证了在慢性肾脏病缺氧中HIF-1α作用微弱,HIF-2α起主要调节作用。因此外源性激活低氧诱导通路,是治疗慢性肾性贫血的新方法。已经进入中国市场的PHD抑制剂,即通过调节低氧诱导通路改善贫血[21]。但当前的PHD抑制剂未进行PHD亚型的选择,因此存在引起肿瘤恶化等副作用的可能[22]。从本研究结果来看,无贫血组中HIF-2α的高表达,提示HIF-2α是改善慢性贫血的重要因子,进一步研究出激活HIF-2α靶基因的相关药物,或可对治疗肾性贫血及减少副作用带来新的治疗方案。
综上所述,MHD患者中贫血患者的血清Hepcidin、HIF-1α、HIF-2α与PHD表达水平与相关因素分析结果,反映了低氧诱导通路与MHD患者肾性贫血的发生密切相关,炎症状态、营养状况、年龄等可影响肾性贫血的发生发展,亦可能是EPO低反应的部分原因。激活低氧诱导通路、纠正营养不良、改善炎症状态是纠正肾性贫血及改善预后的重要措施。PHD抑制剂在微炎症状态下亦可改善贫血,是EPO低应答患者改善贫血的新希望。但本研究为横断面研究,存在样本量小,单中心、检测指标少等不足,仍需更多高质量的分子水平及临床研究进一步探讨相应作用机制。
