不同产地温莪术遗传多样性及亲缘关系的ISSR分析*
2020-11-25张玉秀刘培卫留诗雨魏建和
张玉秀,刘 杨,刘培卫,留诗雨,黄 娴,魏建和,**
(1. 中国医学科学院 北京协和医学院 药用植物研究所海南分所,海南省南药资源保护与开发重点实验室 海口570311;2. 中国医学科学院 北京协和医学院 药用植物研究所,中草药物质基础与资源利用教育部重点实验室&濒危药材繁育国家工程实验室 北京 100193;3. 海南碧凯药物研究所有限公司 海口 570216)
温郁金(Curcuma wenyujinY.H.Chen et C.Ling),又称温莪术,属姜科(Zingiberaceae)姜黄属(Curcuma)多年生草本植物[1],是“片姜黄”、“温莪术”和“温郁金”等多种中药材的基原植物,同时也是莪术油的主要来源[2]。现代研究[3-5]证明温莪术含有姜黄素类、莪术醇、β-榄香烯、莪术二酮等多种活性成分,具有很好的抑菌、抗炎、抗肿瘤等药理作用。温莪术的道地产区在浙江温州,但仅靠道地产区小面积种植已不能满足日益增长的市场需求,现已大量异地引种栽培[6-8]。实践证明,很多药用植物从原产地引种到新地区后,经常出现性状变异,基原不清和种质退化等问题[9-10]。因此我们在基原鉴定的基础上,对不同产地的温莪术遗传多样性进行了研究。
简单序列重复区间(Inter-simple sequence repeat,ISSR)扩增多态性是一种在简单重复序列基础上发展起来的新型分子标记,由加拿大科学家Zietkiewicz 等在1994 年首次提出[11],现已被广泛应用于植物品种鉴定、进化与亲缘关系分析、遗传多样性与居群遗传结构检测等方面[12-13]。如 Raina 等[14]利用 ISSR 技术对花生栽培种和野生种的亲缘进行了研究,发现Arachis monticola和A. hypogaea亲缘关系密切,同时表明A.villosa和A. ipaensis(二倍体,野生种)是A. monticola和A.hypogaea(四倍体,栽培种)的祖先。陈河龙等基于ISSR对芦笋种质资源进行聚类分析,将46份芦笋种质分为 Pacific Challenger 2、A 和 B 共 3 大类;而 A 类又分为3 个亚类,B 类分为4 个亚类[15]。关萍等基于ISSR技术对贵州5个不同产地粗毛淫羊藿进行遗传多样性分析,发现粗毛淫羊藿的遗传变异主要存在于群体内,并且居群间的亲缘关系与地理分布关系密切,但人为引种会影响这种相关性[16]。
ISSR 技术在温莪术遗传多样性方面已有不少的研究报道[17-19],但得到了不同的结论。王佐元等应用ISSR 标记技术对瑞安、乐清和平阳三个地区5 个居群的温莪术遗传多样性进行分析,结果显示不同产地温莪术之间有较高的遗传多样性,且居群内发生了较高的遗传分化,基因交流也比较多[17]。陶正明等[18]运用该技术对浙江温莪术主产区6个居群的遗传多样性进行分析,发现温莪术居群间的多态性不丰富,遗传多样性水平较低。王晓慧等[19]利用ISSR-PCR 标记技术研究了不同种及居群莪术的亲缘关系和遗传多样性,数据表明温郁金不同居群间遗传相似系数在97%以上,居群内分化程度很低。本研究利用ISSR 分子标记技术对道地产区(温州)、其他种植区(海南、贵州)3个产地共8 个温莪术居群进行了研究,旨在从分子水平了解不同产地温莪术的遗传多样性及亲缘关系,期望为药用植物异地栽培及优良种质选育提供一定的理论依据。
1 材料与方法
1.1 植物材料
样品采自浙江温州温莪术主产地、海南温莪术种植基地和贵州麻江种植地。海南和贵州麻江最初种植的种茎都来自浙江温州,在当地连续种植4年以上。目前海南种植基地的种茎少量来自浙江温州,绝大部分为自留种,为了减少误差,课题组在海南种植基地多地、多点采样。采样后立即用硅胶干燥留存备用。所有样品由中国医学科学院药用植物研究所海南分所朱平老师鉴定为温莪术(C.wenyujinY.H.Chen et C.Ling),样品信息见表1。

表1 不同产地温莪术的来源及编号
1.2 方法
1.2.1 仪器
凝胶水平电泳仪(君意JY600c,中国)、凝胶成像系统(Bio-rad ChemiDoc,美国)、微波炉(美的,中国)、高速离心机(Hettich 220R,德国)、核酸蛋白质仪(Thermo Nanodrop 2000,美国)、梯度PCR 仪(Biometra TProfessional,德国)
1.2.2 试剂
植物总DNA 提取试剂盒(OMEGA HP Plant DNA Kit,中国)、2×Taq PCR MasterMix(Transgen As151,中国)、液氮(海南青峰生物科技有限公司)、核酸染色剂(Solarbio Gold view I 型,中国)、超纯水(Thermo,美国)、Agarose(Biowest Agarose G-10,西班牙)、β-巯基乙醇(上海艾研生物科技有限公司)、冰醋酸(西陇科学股份有限公司)、无水乙醇(西陇科学股份有限公司)、TBE 电泳缓冲液(Biosharp,中国)、D2000 Marker(Tiangen,中国)。
1.2.3 DNA提取
参照OMEGA 公司的植物总DNA 试剂盒的操作方法(适用于新鲜/冷冻样品提取),提取每个样品叶片的总DNA。为了避免样品间的交叉污染,每个样品需单独处理,提取后用核酸蛋白质仪检测DNA浓度和纯度,浓度值要求在 20 ng•μL-1以上,OD260 和 280 的比值在1.8-2.0范围内。
1.2.4 ISSR引物筛选
采用加拿大英属哥伦比亚大学(University of British Columbia,UBC)设计的引物为筛选对象,引物由华大基因(深圳)股份有限公司合成,通过已确定的反应体系与扩增程序从20条引物中筛选出多态性好、扩增谱带清晰的6条引物(表2)。
1.2.5 引物最佳退火温度确定
反应体系 25 μL,包括 DNA 模板 1 μL,2×EcoTaq PCR SuperMix 12.5 μL,引物1 μL,ddH2O 10.5 μL。采用PCR 仪进行退火温度梯度试验,逐一确定所筛选引物的最佳退火温度。设定退火温度梯度范围50-62℃,自动形成8 个梯度。PCR 扩增程序为94 ℃预变性 5 min;94℃变性 30 s,50-62 ℃复性 30 s,72℃延伸1.5 min,35 个循环;72℃延伸 10 min;反应结束后4℃保存。扩增产物用1.5%琼脂糖凝胶进行电泳,凝胶成像系统检测拍照,根据多态性条带多少及清晰度确定每条引物的最佳退火温度(图1、表2)。
图1 最佳退火温度筛选(UBC-859)

表2 ISSR分析的引物
1.2.6 数据统计与分析
ISSR-PCR 条带分析和数据处理以D2000 Marker作为相对分子质量标记的标准,根据PCR 扩增条带在琼脂糖凝胶上的迁移程度,确定各居群ISSR-PCR 条带的位置。同一条引物的扩增产物,依据电泳图谱中同一位置上DNA条带的有无进行统计与聚类分析,有带的记为“1”,无带的记为“0”,用 Excel 软件建立0/1格式的原始表征二元数据矩阵。利用PopGene 32 软件计算多态位点百分率(PPB)、等位遗传标记数(Na)、有效等位遗传标记数(Ne)、总的遗传多样性(Ht)、居群内遗传多样性(Hs)、各居群间的遗传分化指数(Gst)、基因流(Nm)、Nei’s 遗传多样性(He)、Nei’s 遗传距离(D)、Shannon’s 信息指数(I)等;通过NTsys 2.1中的非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)建立聚类树。
2 结果与分析
2.1 ISSR引物筛选和最佳退火温度确定
每个物种都有各自的适宜的ISSR 引物,根据文献从UBC 设计的100 条ISSR 引物中首先选择20 条引物,发现其中的6条引物扩增产物的条带性较好(表2)。图2 为引物UBC-859 扩增产物在琼脂糖凝胶电泳后获得的凝胶图,从图中可以看出此引物的ISSR条带的多态性较好,不同样品间差异明显(图2)。
ISSR-PCR 试验中,退火温度对条带的有无和清晰度有显著的影响,例如UBC-859的最佳退火温度为53.8℃,高于这个温度条带数减少,低于这个温度清晰度下降(图1)。对上述筛选到的6 条引物的退火温度进行了进一步优化,筛选到了各自的最佳退火温度(表2)。
2.2 遗传多样性分析和居群间遗传变异分析
2.2.1 遗传多样性分析

图2 引物UBC-859对温莪术样品的扩增结果
6 条引物共扩增出42 条清晰、可重复的DNA 条带。通过对8 个居群的温莪术进行ISSR 遗传多样性分析表明(表 3),瑞安1、瑞安2、临高1、临高2、澄迈1、澄迈2、红旗、贵州多态位点百分率(PPB)在19.05%-47.62%之间,其中红旗最高(47.62%),临高2 最低(19.05%),平均值为29.17%。居群内Nei’s 基因多样性(He)在 0.0640-0.1440 之间 ,平均值为 0.1005;Shannon’s 指数(I)在 0.0998-0.2220 之间,平均值为0.1511。可以看出温莪术居群内ISSR 多态性不丰富,遗传多样性水平偏低。
2.2.2 居群间遗传变异分析
通过对温莪术居群间和居群内的遗传分化及基因流分析,结果显示,8个温莪术居群总的遗传多样性(Ht)为 0.1709,居群内的遗传多样性(Hs)为 0.1045,说明温莪术居群内和居群间都存在一定的遗传分化。根据Ht 和Hs 计算不同温莪术居群间的遗传分化系数Gst 为0.3886,即总的遗传变异中有38.86%的变异存在于居群间,61.14%的变异存在于居群内,表明居群内遗传分化大于居群间遗传分化。居群间每代个体的基因流系数(Nm)为0.7868,表明居群间基因流动性水平偏低。
2.2.3 不同产地温莪术的聚类分析
运用PopGene 32 软件计算出温莪术各居群间遗传一致性和遗传距离,然后基于遗传一致性运用NTsys 2.1 软件进行UPGMA 聚类(图3)。从结果中可以看出温莪术各居群间的遗传一致性的范围为0.8481-0.9736,平均值为 0.9155,遗传距离(D)范围为0.0268-0.1647,平均值为0.0901,这些数据表明温莪术不同居群间在分子水平上差异较小。具体到居群间可以看出,临高1和临高2温莪术的遗传一致性最高(0.9736),遗传距离最小(0.0268)(表4),在聚类图上最先聚为一支(图3);贵州麻江与临高1温莪术的遗传一致性最低(0.8481),遗传距离最大(0.1647)(表4),在聚类图上最后才与其他居群聚在一起(图3)。
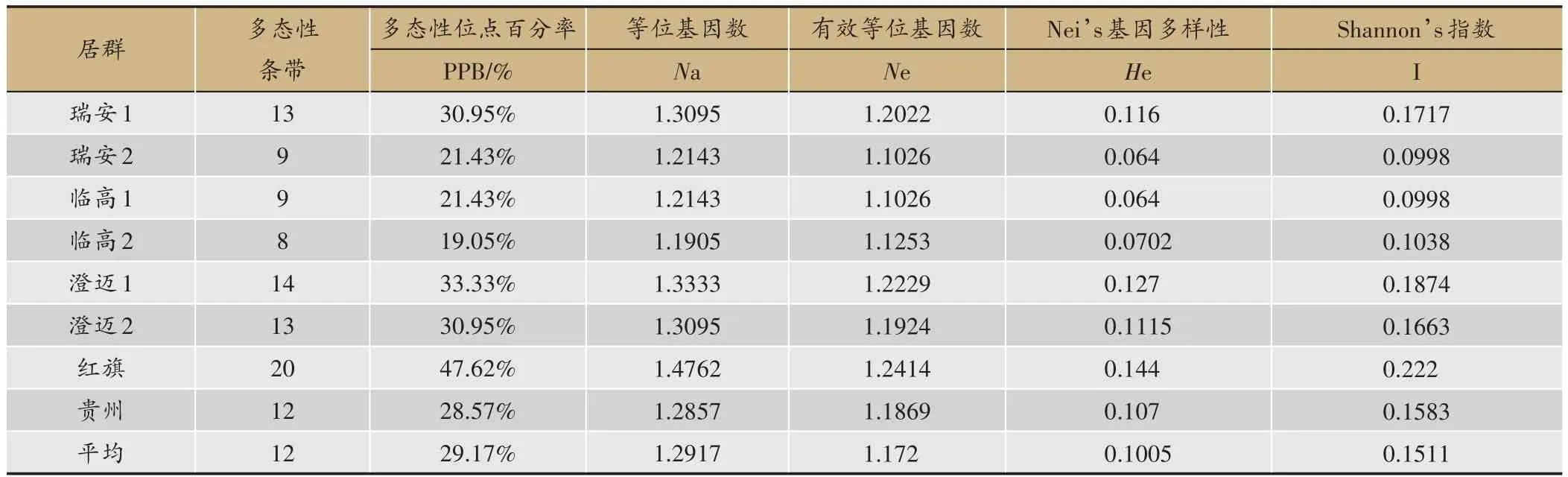
表3 居群内的遗传多样性

图3 不同产地温莪术群体间的UPGMA聚类图
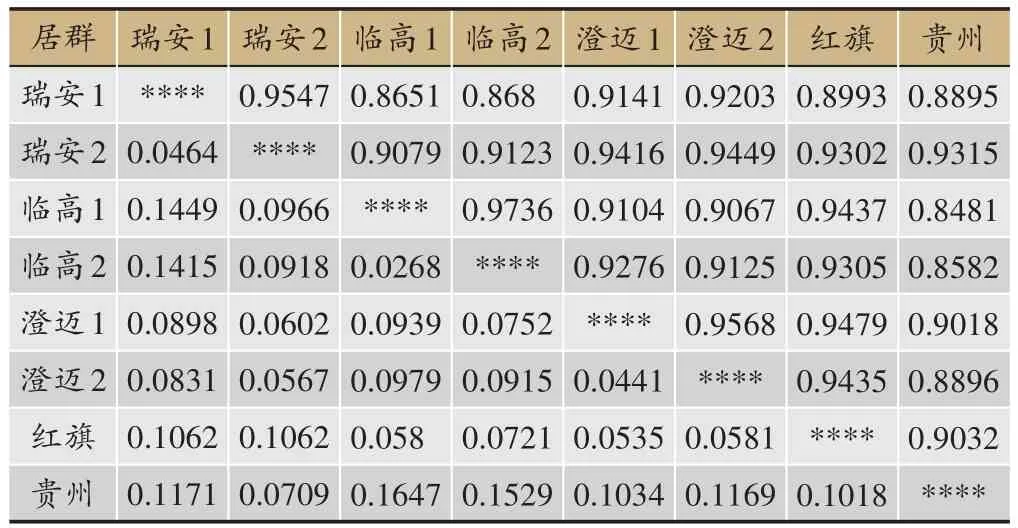
表4 Nei’s遗传一致性(右上角)和遗传距离(左下角)
3 讨论
遗传信息在外界或内在的因素作用下,在复制过程中出现偏差导致了不同程度的遗传变异,形成了物种间和物种内丰富的遗传多样性[17]。物种或居群的遗传多样性是长期进化的产物,是其生存适应和发展进化的前提,一个居群或物种遗传多样性越高或遗传变异越丰富,对环境变化的适应能力就越强,越容易扩展其分布范围和开拓新的环境,即使无性繁殖占优势的种也不例外,遗传多样性是保护生物学研究的核心之一。因此,对遗传多样性的研究无疑有助于人们更清楚地认识生物多样性的起源和进化,进而为育种和遗传改良奠定基础[17]。
陶正明等[18]利用ISSR技术对温州传统产区的6个温莪术居群进行研究,发现其ISSR 多态位点百分率(PPB)为31.7%,遗传一致性范围为0.9129-0.9943,遗传距离范围为0.0057-0.0911,这些数据均表明这些道地产区的温莪术之间遗传变异小、较为稳定。王晓慧等利用该技术对广西、福建和浙江等5 个温莪术居群研究发现,其PPB 范围为3.08%-12.31%,遗传一致性范围为0.97-0.9991, 遗传距离为0.009-0.030,这些数据表明这3 个产地温莪术遗传多样性较小[19]。本文中8 个温莪术居群的PPB 范围为19.05%-47.62%,遗传一致性范围为0.8481-0.9736,遗传距离为0.0268-0.1647。综合以上的研究可以看出,不同温莪术居群间遗传多样性普遍较低,居群间在分子水平上差异较小。但有的学者研究发现,温莪术有着较高的遗传多样性水平,且居群内发生了较高的遗传分化,这可能由于所选用的引物、样本来源和样本数量及分析方法等因素造成的。在今后的研究中,应扩大样品收集的区域和样本数量,同时结合其他技术手段,分析温莪术遗传多样性,为寻找出优良的种质资源提供理论依据。
温莪术原产浙江温州,但随着社会的发展,异地引种栽培越来越多[6-9]。据调查,海南和贵州种植的温莪术的种茎最初都来自道地产地浙江温州,其中海南温莪术大规模种植已有5 年时间,目前绝大部分为自留种,贵州种植的温莪术的种植至少有4年的时间,每年都是利用自留种茎无性繁殖。本文的数据表明,温莪术从温州引种到海南和贵州以后,其遗传信息确实发生了一些改变,但整体上变异不大。究竟是自留种茎进行繁殖好,还是每年从原产地购买种茎进行繁殖好,还需要多年的对比研究。
中药材是治病救人的特殊商品,必须保证其安全性、有效性、稳定性及一致性。因此对异地引种栽培与道地产区的中药材进行科学的比较评价十分必要。早先课题组从形态学及化学水平证明了海南产温莪术与道地产区温莪术的形态结构和化学构成基本一致[7,20]。本文通过对温莪术5 个居群遗传多样性的分析,从分子水平证明了海南温莪术和道地产区温莪术的差异很小。随着温莪术引种栽培规模的增大和种植年限的增加,下一步我们将从遗传信息、有效成分和疗效等方面进行比较研究,为海南产温莪术的合理开发和利用提供保障,为其他中药材的引种栽培提供参考。
