电针对APP/PS1双转基因老年性痴呆模型小鼠认知能力及海马NMDARs表达的影响*
2020-11-25许安萍李志刚
许安萍,王 鑫,韩 丽,李志刚
(1. 北京中医药大学针灸推拿学院 北京 100029;2. 首都医科大学附属北京中医医院 北京 100010;3. 北京中医药大学中医学院 北京 100029)
老年性痴呆,又称阿尔茨海默病(Alzheimer’s disease,AD),临床表现为学习和记忆功能不断衰退,并可能伴有精神症状和行为障碍[1],是最常见的痴呆类型。随着社会老龄化的必然趋势,AD 作为一种老年期常见病,其产生的沉重家庭负担及严重社会问题日益突出,已经成为亟待解决的公共卫生问题之一[2]。
海马区是学习、记忆等认知功能的重要结构基础。谷氨酸是中枢内重要的兴奋性神经递质,其在兴奋性突触传递和突触可塑性改变中发挥关键作用。突触传递的可塑性变化是学习、记忆的神经生理基础。而记忆加固依赖于N-甲基-D-天冬氨酸型谷氨酸受体(NMDARs)的协调活动[3-4]。研究[5-6]表明,NMDARs 通过介导钙离子依赖性信号转导机制,参与学习空间策略。然而,在AD 等与年龄相关的神经退行性疾病中,NMDARs 介导的功能通常被破坏[7,8]。研究[9-11]已证实电针具有改善学习记忆能力的作用,但其作用机制仍未完全阐释,是否与督脉电针调节NMDARs 功能尚不明确。基于此,本研究以“通督启神”理论为指导,选用百会穴(GV20)、印堂穴(GV29)及水沟穴(GV26)三个督脉穴位,通过Morris水迷宫实验,观察电针干预对小鼠认知能力的影响;聚焦NMDARs,应用蛋白质免疫印迹(Western blot)技术,探讨电针治疗对海马N-甲基-D-天冬氨酸型谷氨酸受体NMDAR1及NMDAR2B的调节作用,旨在探讨督脉电针在AD预防中的作用机制。
1 材料与方法
1.1 实验动物
6 月龄 APP/PS1 雄性小鼠和 C57BL/6J 年龄、性别匹配小鼠购自于北京华阜康生物科技有限公司(实验动物许可证号:SCXK(Jing)2014-0004)。小鼠体重为(28.0 ± 2.0)g,于北京中医药大学实验动物中心单笼饲养,给予常规饮食。室温保持在(24 ± 2)℃,湿度40%-60%。每天更换垫料和饮用水,保持鼠笼清洁和干燥。在实验前适应性喂养7天。本实验严格按照中华人民共和国卫生部医学实验动物的使用要求进行操作。
1.2 主要实验仪器试剂
主要实验仪器及试剂见表1。
1.3 动物分组与干预方法
16只APP/PS1小鼠采用随机数字表法分为两组:痴呆模型组和电针治疗组,每组8 只。另外,8 只C57BL/6J小鼠为对照组。
根据以往研究结果,本实验选取百会穴、水沟穴及印堂穴,定位方法参考《实验动物腧穴标准》。电针治疗组,利用自制鼠套固定后进行电针干预,隔日1次,连续治疗4 周。具体穴位定位及操作方法见表2。对照组及痴呆模型组小鼠,以相同方法用自制鼠袋束缚20 min。
1.4 指标检测
1.4.1 Morris 水迷宫
Morris水迷宫测试分为2个实验,第1个实验是定位航行实验,于电针治疗结束后第二天进行,持续4天。第2 个实验是空间探索实验,于定位航行实验后进行。
定位航行实验[12]:Morris 水迷宫划分为Ⅰ、Ⅱ、Ⅲ、Ⅳ4 个象限。正式实验前1 天,保持动物在水池中自由游泳90 s,上午、下午各1 次,使其熟悉迷宫环境。正式实验时,水池注水30 cm 深,滴加奶粉使水呈不透明,使用温度计监测水温并维持在(22±1)℃,保持实验过程中室内光线强度一致。圆柱形平台置于Ⅲ象限中央水面下2 cm。在Ⅰ、Ⅱ、Ⅳ3 个象限各选距离水池圆心相等的点作为入水点,训练时先将动物置于平台上10 s,然后将动物面朝池壁轻轻放入水中,图像采集系统记录小鼠从入水至找到平台的时间(即逃避潜伏期),小鼠在平台上停留5 s视为上台成功。若60 s内找不到平台,逃避潜伏期记为60 s。每天Ⅰ、Ⅱ、Ⅳ3 个象限各训练2 次,以6 次潜伏期的算术均值作为这一天的成绩进行统计分析。以此评价小鼠空间学习能力。

表1 主要实验仪器试剂信息
空间探索实验:定位航行实验结束后,撤除平台。然后分别在Ⅰ、Ⅱ、Ⅳ象限的入水点放入小鼠,记录小鼠在60 s内穿越原平台所在位置的次数及在Ⅲ象限停留时间进行统计分析。以此评价小鼠空间记忆能力。
1.4.2 Western Blot 检测
(1)样本制备:Morris 水迷宫测试后 1 天,每组随机选取6只小鼠麻醉后开颅取海马,然后储存在-80℃冰箱备用。
(2)Western blot 步骤:海马组织蛋白抽提后,BCA法进行蛋白定量,以RIPA 调整蛋白浓度,加入5 ×还原样品缓冲液后样品终浓度:4 mg/ml。煮沸变性5 min。配制12%的分离胶,浓缩胶浓度为5%。20 μg/孔上样,浓缩胶恒压90 V,约20 min;分离胶恒压160 V 300 mA 恒流,0.45 μm 孔径 NC 膜,转膜时间 1 h。将膜完全浸没3% BSA-TBST 中室温轻摇30 min 封闭后分别加入NMDAR1(1:1000)及NMDAR2B(1:2000)抗体,4℃孵育过夜。加入二抗(1:20000),洗膜后加入ECL,反应后胶片曝光显影定影后扫描分析结果。β-actin作为内参蛋白。

表2 实验穴位定位及操作方法
1.5 统计学分析
采用SPSS 20.0 软件进行统计分析。实验数据以均数 ± 标准差()表示,Morris 水迷宫定位航行实验中逃避潜伏期采用重复测量设计资料的多变量方差分析(Repeated measures two-way ANOVA)分析;Morris 水迷宫空间探索实验及Western blot 结果采用单因素方差分析(One-Way ANOVA)分析,组间采用最小显著差异法(LSD)分析。P< 0.05 表示差异具有统计学意义,P<0.01表示差异具有显著统计学意义。
2 结果
2.1 定位航行实验结果
在Morris 水迷宫定位航行实验中,空间学习能力通过小鼠爬上平台躲避水的时间(逃避潜伏期)来评估。对照组及电针治疗组的逃避潜伏期均随着训练有所减少,但痴呆模型组的逃避潜伏期无明显变化,说明模型小鼠的学习能力下降(见图1);与第1 天相比,对照组在第3 天,电针治疗组在第4 天,逃避潜伏期开始明显缩短(P<0.01)(见图2)。
2.2 空间探索实验结果
在Morris 水迷宫空间探索实验中,痴呆模型组小鼠在第Ⅲ象限目标平台穿越次数及该象限停留时间均较对照组明显减少(P<0.05),说明模型小鼠的记忆能力受损;与痴呆模型组相比,电针治疗组的穿越平台次数及在Ⅲ象限停留时间均有所增加,但差异无统计学意义(见图3-4)。
2.3 Western Blot结果
与对照组比较,痴呆模型组小鼠的海马NMDAR1及NMDAR2B 表达水平明显下降(P< 0.01);与痴呆模型组相比,电针治疗组的NMDAR1 及NMDAR2B 表达均有所增加(P<0.01)(见图5-6)。
3 讨论
根据中医理论,“脑为元神之府”,AD 以认知障碍和记忆能力损害为主要表现,病位在脑。《素问·骨空论》中记载督脉“入络脑”。督脉是脏腑气血精气上输于脑的重要路径,其功能正常,阳气得以运行于周身,内化精微以养神明;若督脉为病,神无所统,则会导致神志相关病症[13]。前期研究[14,15]表明,通调督脉可以调节β淀粉样蛋白相关分泌酶及降解酶的水平,增加脑血流量,良性调节星形胶质细胞有关通路[16],从而促进淀粉样蛋白代谢,保护认知功能,改善记忆能力,达到治疗AD的作用。

图1 各组逃避潜伏期变化趋势图
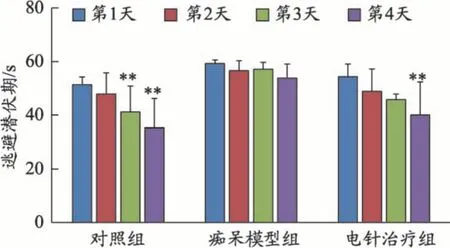
图2 各组逃避潜伏期组内比较

图3 各组穿越平台次数比较

图4 各组Ⅲ象限停留时间比较

图6 各组海马NMDAR2B表达情况
AD 起病隐匿,早期症状轻微,典型的征象是记忆障碍,疾病中期患者认知障碍随着病情进展逐渐出现,甚至出现空间定向障碍。学习与记忆两者关系密切,学习是获取新知识的过程,其结果是记忆。评估小鼠学习记忆能力的方法有多种,Morris 水迷宫实验是目前公认有效的方法之一[17]。在定位航行实验中,小鼠通过多次练习寻找水下固定的圆形平台,从而获得稳定的空间位置认知。结果显示,痴呆模型组小鼠逃潜伏期均值高于对照组,并且通过4 天训练无明显变化。这一现象表明,APP/PS1 小鼠6 月龄学习记忆能力明显下降,避水积极性下降。而电针治疗组中,APP/PS1 小鼠的逃避潜伏期随训练逐渐下降,在第4天明显缩短,提示电针对痴呆模型小鼠的学习能力有促进作用。在空间探测实验中,模型组小鼠表现出对目标(平台)无明显倾向性的随机搜索策略。这一策略表明小鼠的学习行为模式发生了改变,记忆能力明显受损。而电针治疗组平台穿越次数、目标象限停留时间均有所增加,提示电针对痴呆模型小鼠记忆同样具有保护作用。
谷氨酸是一种兴奋性氨基酸,是中枢内重要的内源性兴奋性氨基酸递质,对神经元有极强的兴奋作用。谷氨酸在中枢神经元间发挥的兴奋性突触传递作用主要通过NMDAR。中枢谷氨酸受体至少分为5种,研究[18]表明,NMDARs参与了海马CA1区长时程增强(LTP)等突触可塑性诱导及学习和记忆机制,是中枢神经系统学习和记忆等关键功能的基础[19]。在认知能力减退为主要特征的疾病中,NMDARs的表达下降引起NMDAR依赖性的突触可塑性降低[20]。NMDAR 存在多个亚单位,但功能性的 NMDAR 由 NMDAR1 和 NMDAR2 共同组成,NMDAR1和NMDAR2共表达可显著增强通道活性。其中NMDAR1是发挥生物效应的必要结构蛋白。NMDAR与学习记忆密切相关,其中NMDAR2B与之最为密切[21]。本实验结果表明,督脉电针促进痴呆模型组小鼠海马NMDAR1及NMDAR2B的表达。
综上所述,本研究重点在于督脉电针对痴呆模型小鼠海马NMDARs的影响。实验结果显示电针治疗组的学习记忆能力改善,并且NMDAR1及NMDAR2B的表达增加。因此,电针可能通过调整NMDARs介导的LTP,增强认知能力。这可能是电针治疗痴呆的作用途径之一[22-24]。值得注意的是,NMDARs还参与介导Ca2+/钙调蛋白通路、NO 通路等多条信号转导通路,然而各条信号通路并不是孤立的,而是彼此联系,其在调节学习记忆的过程中可能存在其他潜在作用机制[25-26]。今后,本课题组将围绕NMDARs进一步研究相关信号通路,深入探讨电针保护学习和记忆等脑高级功能的机制。
