盐胁迫下异甜菊醇浸种对油菜种子萌发和幼苗生长的影响
2020-11-25李玉婷夏文静许晓风
张 亮,李玉婷,夏文静,许晓风,2
(1.南京师范大学泰州学院化学与生物工程学院,江苏 泰州 225300;2.南京师范大学生命科学学院,江苏 南京 210023)
0 引言
【研究意义】土壤盐渍化是影响作物生长发育的非生物逆境之一,严重制约了农产品产量和品质的提升。据统计,全球盐渍化土地面积已超过10 亿hm2,由于不合理灌溉等原因,全球盐渍化土地面积还在逐年增加;土壤盐渍化不仅影响植物种子的发芽能力,而且还会影响到植物的产量和品质[1-2]。高盐环境中,植物细胞内积累大量的Na+,高浓度的Na+会对机体产生盐毒害和渗透伤害双重效应,进而影响抗氧化酶的活性,导致活性氧(reactive oxygen species,ROS)代谢失衡,而植物体内大量积累的ROS,可氧化攻击细胞膜系统,引起质膜局部损伤和非选择透性增加,细胞内容物大量外渗,植物生长受到阻碍,严重时影响植物的生存[3]。因此,通过施入外源物质等措施来缓解土壤盐渍化造成的危害,增强植物的抗盐能力,将有利于提高作物的产量和品质,减少盐胁迫给农作物带来的经济损失。【前人研究进展】植物种子发芽和幼苗生长期间对外界环境非常敏感,极易受到Na+的毒害[4]。近年来,许多植物生长调节物质在植物的抗盐胁迫中发挥至关重要的作用,研究表明,赤霉素对较高浓度盐胁迫下的红砂种子发芽率降低有显著的改善作用,同时可以提高种子的发芽速度和发芽指数[5];用外源水杨酸浸种,可以提高萝卜幼苗在盐胁迫下叶片的叶绿素含量,促进光合作用,提高植物的抗氧化酶活性,降低膜脂过氧化程度,调控Na+离子吸收与分布,以缓解离子毒害[6];施加0.1 mmol·L-1精胺到小麦培养液中,可显著提高小麦幼苗叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性,降低叶片MDA 含量,有效缓解小麦幼苗受到盐胁迫的伤害[7]。此外,如6-苄氨基腺嘌呤、抗坏血酸、一氧化氮、硒元素等在植物受到盐胁迫时,也能发挥较好的缓解作用[8]。目前,在这些植物生长调节剂的研究领域中,赤霉素类的应用研究最为活跃[9]。异甜菊醇(isosteviol),又称异斯特维醇,是一种具有贝叶烷骨架的四环二萜类化合物,由Mosetling 和Nes 在1955 年首次报道[10-11]。异甜菊醇由甜菊苷(stevioside)通过酸水解,或由甜菊醇(steviol)在酸性条件下官能团重排制备获得;而甜菊醇由甜菊苷经高碘酸钠氧化水解得到[12-13]。异甜菊醇和赤霉素均由乙酸板块通过甲瓦龙酸、贝壳杉烯酸等中间体次生代谢而来,在母体结构上两者表现出相似性。刘秀芳等[14]指出,异甜菊醇和甜菊醇在促进水稻种子发芽方面,活性优于赤霉素。【本研究切入点】关于异甜菊醇缓解植物盐毒害方面的研究几乎是空白。【拟解决的关键问题】秦油2 号属甘蓝型冬油菜冬性“三系”杂交油菜品种,具有早熟、适应性广、抗逆性强的特点。通过用异甜菊醇浸种,研究盐胁迫下秦油2 号种子发芽情况及幼苗生理指标的变化,探讨异甜菊醇对盐胁迫抑制油菜幼苗生长的缓解效应。
1 材料与方法
1.1 供试材料
试验材料为甘蓝型油菜秦油2 号的种子,购于河南省博韬种业有限公司。异甜菊醇由东南大学医学院许德义教授提供,纯度为99%。
1.2 试验设计
1.2.1 盐胁迫处理浓度的筛选 挑选大小均匀、籽粒饱满的油菜种子,控制每50 粒种子质量在0.15~0.20 g,用1∶500(m∶m)的高锰酸钾溶液浸泡消毒30 min,消毒后用无菌水冲洗3~4 次后吸干水分。用37 ℃的温水浸种24 h 后,将种子置于垫有双层滤纸的培养皿(直径15 cm)中,每皿50 粒,然后分别加入20 mL 浓度为40、80、100、120、140、160 mmol·L-1的NaCl 溶液,以等量去离子水浸种和发苗为对照1(CK1),每个处理设置5 次重复,置于光照培养箱内培养,温度25 ℃,光照时间12 h。每天记录种子的发芽情况,以胚根长度2~3 mm 为发芽标准,连续3 d 无种子发芽即为发芽结束。培养7 d 后,统计发芽率、发芽指数和活力指数,测量幼苗苗高和根长[15]。
1.2.2 异甜菊醇浸种和盐胁迫处理 依据盐胁迫处理浓度试验的结果,确定使用140 mmol·L-1NaCl 溶液作为盐胁迫处理。按照上述消毒方法进行种子消毒。先用浓度梯度为1×10-10、1×10-9、1×10-8、1×10-7、1×10-6mol·L-1的异甜菊醇浸种24 h,以去离子水浸种为对照2(CK2)。然后置于双层滤纸的培养皿中,每皿50 粒,分别加入20 mL 浓度为140 mmol·L-1的NaCl 溶液进行盐胁迫处理,以去离子水浸种和培养发芽作为对照1(CK1),5 次重复,每天更换培养液。置于光照培养箱内培养,温度25 ℃,每天光照时间12 h。每天记录种子的发芽情况,以胚根长度2~3 mm 为发芽标准,连续3 d 无种子发芽即为发芽结束。培养7 d 后,统计发芽率、发芽指数和活力指数,测量幼苗的苗高和根长,取适量子叶和根系测定相关生理生化指标。
1.3 指标测定
取适量幼苗胚根和子叶测定相关指标[16]。采用TTC 法测定根系活力(以单位时间、重量的四氮唑还原量来表示,μg·g-1·h-1);采用丙酮提取法测定叶绿素含量;采用硫代巴比妥酸法测定丙二醛含量;采用氯化硝基四氮唑蓝光化学还原反应法测定SOD 活性;采用愈创木酚法测定POD 活性;采用紫外分光光度法测定CAT 活性。
发芽率=(发芽的种子总数/供试种子总数)×100%;发芽指数=ΣGt/Dt,Dt为发芽日数,Gt为在t日的发芽数;活力指数=GI×S,GI为发芽指数,S为单株幼苗长度(cm)。
1.4 数据处理
试验数据采用Excel 2010 进行基本计算和绘图,采用SPSS 19.0 中的Duncan's 法进行多重比较。
2 结果与分析
2.1 NaCl 胁迫下油菜种子发芽和幼苗生长情况
由表1 可知,在盐胁迫的各处理中,随着NaCl浓度升高,油菜种子的发芽率、发芽指数、活力指数,幼苗的苗高和根长均表现出不同程度的降低。其中,当NaCl 浓度为40 mmol·L-1时,油菜幼苗苗高略有增加,但随着NaCl 浓度升高,总体趋势表现为下降。当NaCl 浓度为120 mmol·L-1时,与CK1(去离子水浸种和发苗)相比,油菜种子的发芽率、发芽指数、活力指数、苗高和根长等指标,均存在极显著差异;但是,与100 mmol·L-1NaCl 处理相比,在发芽率、苗高和根长等指标上均未达到极显著差异(P<0.01)。当NaCl 浓度为140 mmol·L-1时,与CK1相比,油菜种子的发芽率、发芽指数和活力指数分别下降20.86%、39.30%和78.39%,幼苗的苗高和根长分别下降47.06%和70.41%,差异均达极显著水平(P<0.01)。当NaCl 浓度为160 mmol·L-1时,与CK1相比,油菜种子的发芽率、发芽指数和活力指数分别下降46.77%、71.95%和94.47%,幼苗的苗高和根长分别下降64.71%和85.71%,除发芽率以外,其余指标的下降率均超过了50%,各项指标的差异均达极显著水平(P<0.01)。表明NaCl 浓度高于140 mmol·L-1会严重影响油菜种子的发芽和成苗过程。因此,选择NaCl 浓度140 mmol·L-1作为感受盐胁迫的敏感浓度,进行后续的试验。
2.2 NaCl 胁迫下异甜菊醇浸种对油菜种子发芽及幼苗生长的影响
由表2 可知,与CK1相比,CK2(去离子水浸种、140 mmol·L-1NaCl 胁迫)的油菜种子发芽率、发芽指数、活力指数、苗高和根长均显著降低,分别降低19.24%、31.97%、75.59%、51.43%和68.75%。
与CK2相比,不同浓度的异甜菊醇浸种处理,各项指标均表现出不同程度的升高,但均显著低于无NaCl 胁迫的CK1。其中,1×10-9mol·L-1异甜菊醇浸种处理的发芽率比CK2提高14.08%;1×10-8mol·L-1异甜菊醇浸种处理的发芽指数、活力指数、苗高和根长分别比CK2提高33.02%、146.24%、70.59%和93.33%。表明用异甜菊醇浸种,可缓解盐胁迫对油菜种子萌发和幼苗前期生长产生的抑制作用。
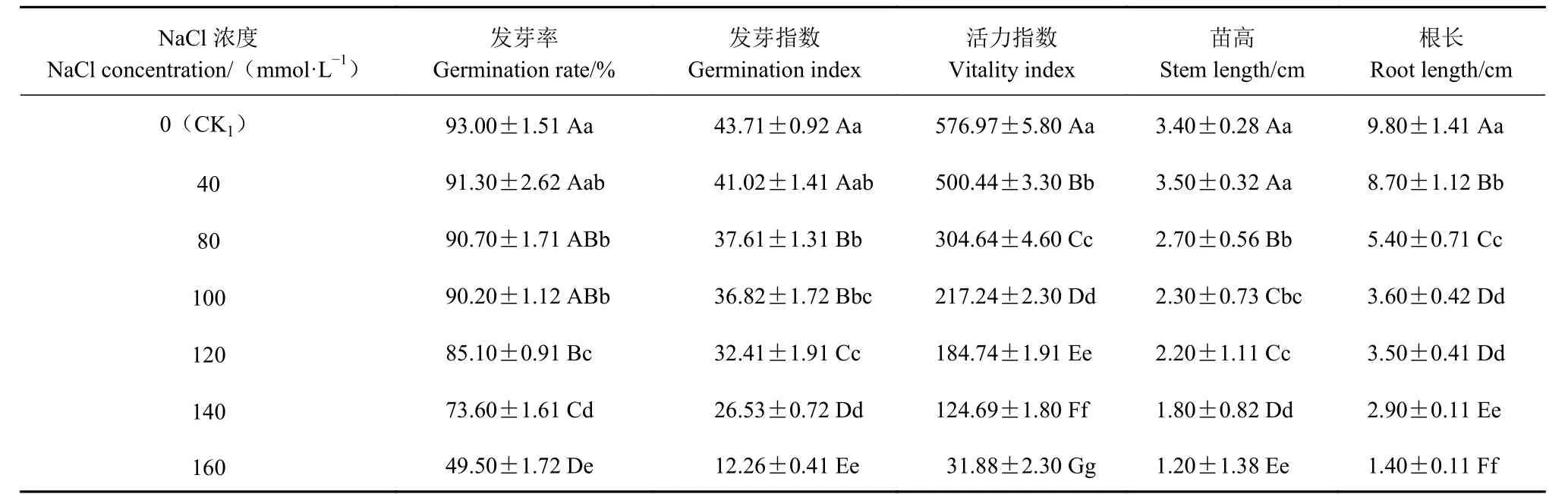
表1 NaCl 胁迫对油菜种子发芽指标的影响Table 1 Effect of salt stress on seed germination of B.napus
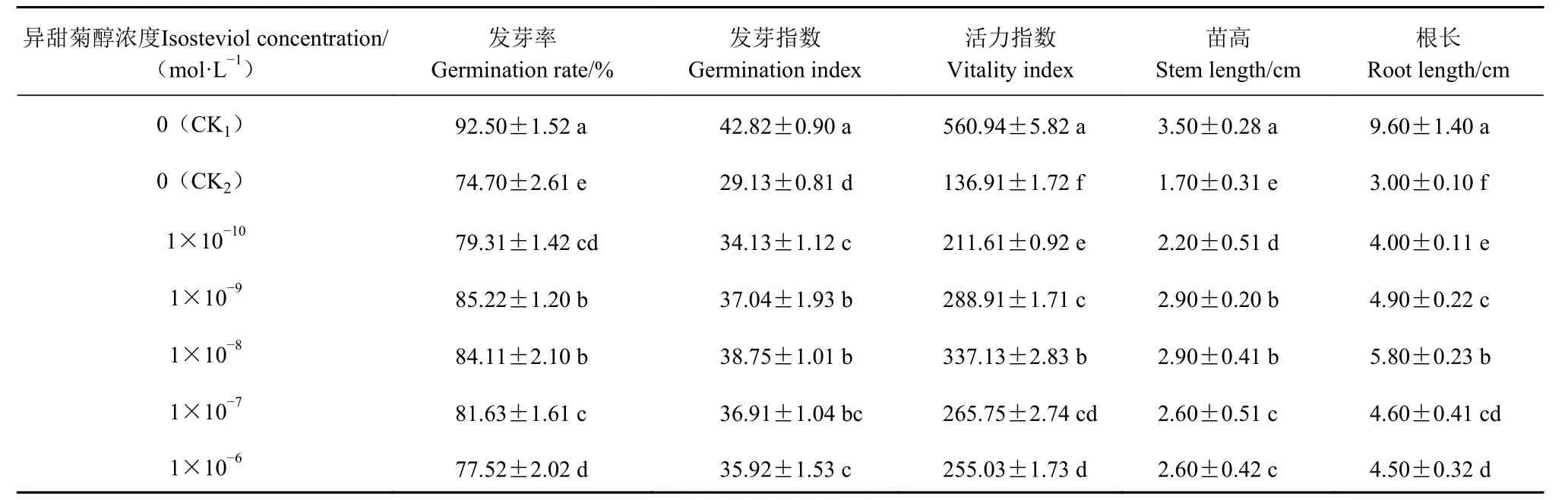
表2 NaCl 胁迫下异甜菊醇浸种对油菜种子发芽及幼苗生长的影响Table 2 Effects of pre-soaking in isosteviol solution on seed germination and seedling growth of B.napus under salt stress
2.3 NaCl 胁迫下异甜菊醇浸种对油菜幼苗生理指标的影响
2.3.1 根系活力 由图1 可知,与CK1相比,CK2的油菜幼苗根系活力显著降低25.05%。与CK2相比,不同浓度的异甜菊醇浸种处理,均显著提高了幼苗根系活力,其中1×10-8mol·L-1异甜菊醇浸种处理的根系活力增加27.33%。表明盐胁迫下,用异甜菊醇浸种可提高油菜幼苗根系活力。
2.3.2 叶绿素含量 由图2 可知,与CK1相比,CK2的油菜幼苗子叶中叶绿素的合成受到显著抑制,比CK1降低37.99%。与CK2相比,不同浓度的异甜菊醇浸种处理,均显著提高了子叶中叶绿素含量,其中1×10-8mol·L-1异甜菊醇浸种处理的叶绿素含量提高36.94%。表明在盐胁迫下,用异甜菊醇浸种有利于油菜幼苗光合色素的合成。
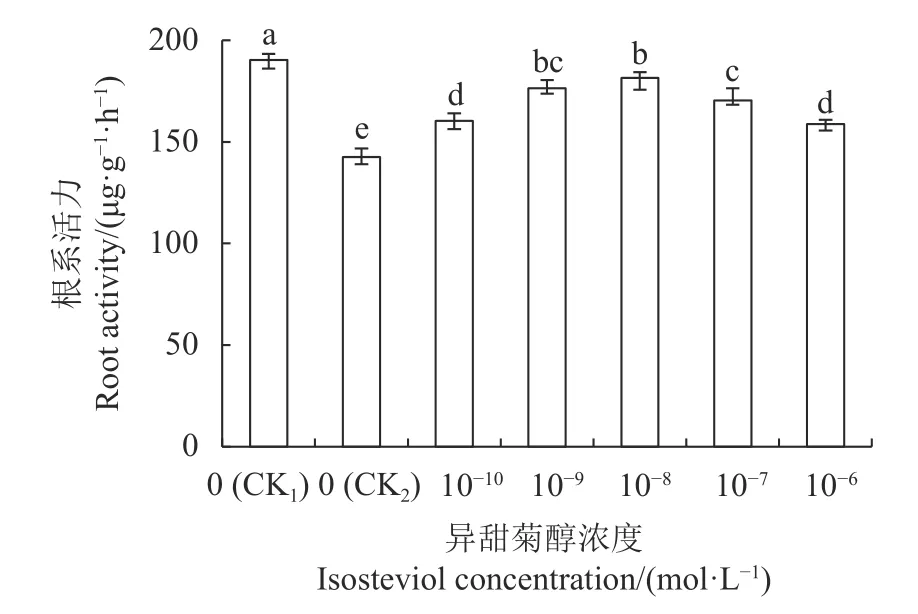
图1 NaCl 胁迫下异甜菊醇浸种对油菜根系活力的影响Fig.1 Effect of pre-soaking seeds in isosteviol solution on root activity of B.napus seedlings under salt stress
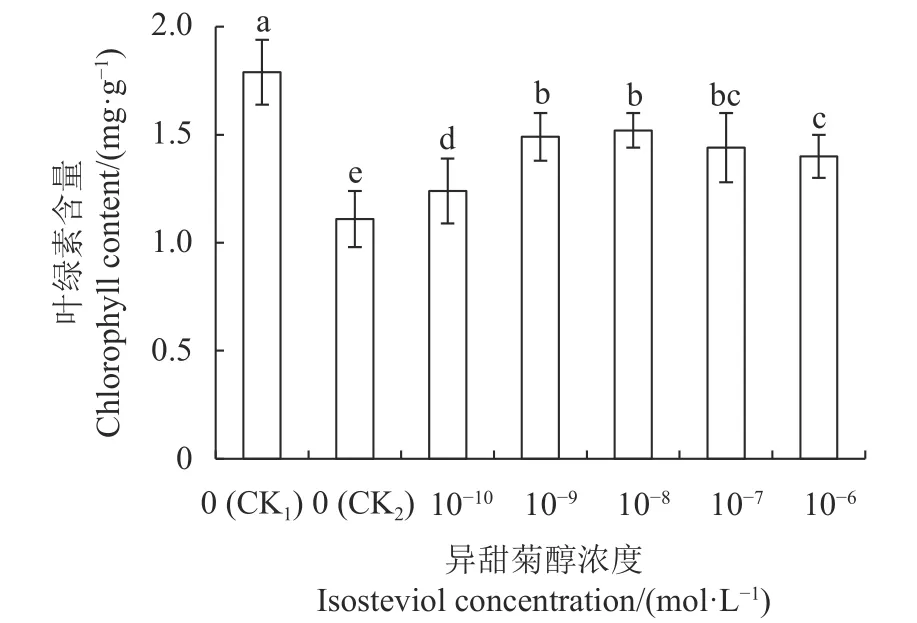
图2 NaCl 胁迫下异甜菊醇浸种对油菜幼苗(鲜样)叶绿素含量的影响Fig.2 Effect of pre-soaking seeds in isosteviol solution on chlorophyll content of B.napus seedlings (fresh samples)under salt stress
2.3.3 MDA 含量 由图3 可知,与CK1相比,CK2的油菜幼苗子叶中MDA 含量显著升高65.98%。与CK2相比,不同浓度的异甜菊醇浸种处理,均显著降低子叶中MDA 含量,其中1×10-8mol·L-1异甜菊醇浸种处理的MDA 含量降低32.11%。表明在盐胁迫下,用异甜菊醇浸种可降低油菜幼苗子叶中MDA的含量,具有缓解活性氧对细胞造成的氧化损伤作用。
2.3.4 抗氧化酶活性 由图4 可知,与CK1相比,CK2的油菜幼苗子叶中SOD、POD 和CAT 活性均略有增加,但未达到显著水平。与CK2相比,不同浓度的异甜菊醇浸种处理,均显著提高了油菜幼苗子叶的SOD、POD 和CAT 活性,其中:1×10-9mol·L-1异甜菊醇浸种处理,幼苗子叶的POD 和CAT 活性最高,分别比CK2增加140.80%和47.25%;1×10-8mol·L-1异甜菊醇浸种处理,幼苗子叶中SOD 活性最高,比CK2增加83.31%。表明在盐胁迫下,用异甜菊醇浸种可增强油菜幼苗子叶中抗氧化酶的活性。

图3 NaCl 胁迫下异甜菊醇浸种对油菜幼苗子叶(鲜样)丙二醛含量的影响Fig.3 Effect of pre-soaking seeds in isosteviol solution on MDA content of B.napus seedlings (fresh samples) under salt stress
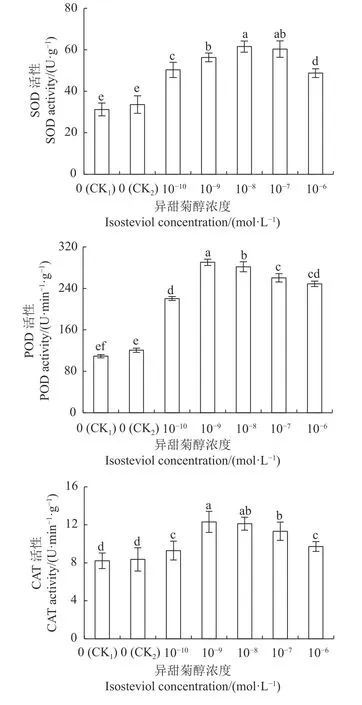
图4 NaCl 胁迫下异甜菊醇浸种对油菜幼苗子叶(鲜样)抗氧化酶活性的影响Fig.4 Effects of pre-soaking seeds in isosteviol solution on SOD, POD, CAT activities of B.napus seedlings (fresh samples) under salt stress
3 结论与讨论
3.1 异甜菊醇浸种处理有助于盐胁迫下油菜种子的萌发
植物种子在萌发阶段和幼苗生长初期对外界环境的变化最为敏感,是整个生活史中最为关键的阶段。一般认为,植物种子发芽受低浓度的盐处理影响不明显,而较高浓度的盐处理将会抑制植物种子发芽和幼苗生长[17]。有研究表明,在低浓度的盐处理中对棉花种子发芽有促进作用,而高浓度的盐处理将显著抑制种子的发芽[18]。另外,有学者发现,当盐浓度为0.40%时,对甜高粱种子的发芽率和发芽势无显著影响;当盐浓度高于0.80%时开始产生抑制作用[19]。本研究发现,当NaCl 浓度为40 mmol·L-1时,油菜幼苗苗高略有增加,种子最终的发芽率和发芽指数与CK1处理相比无显著变化;随着NaCl 浓度的升高,种子发芽和幼苗生长情况均受到抑制,当NaCl 浓度超过140 mmol·L-1时,严重抑制种子萌发和成苗的过程。
有研究发现,赤霉素能促进植物种子在盐胁迫条件下发芽,缓解盐胁迫对幼苗生长产生的毒害作用[20]。由于异甜菊醇和赤霉素具有母体结构上的相似性,同时也表现出促进种子发芽和幼苗生长的能力[21]。Nevmerzhitskaya 等[22]研究发现,低温和镉胁迫下,用甜菊醇浸种,可以增加冬小麦幼苗的苗高和根长,提高冬小麦的抗逆性,缓解非生物胁迫条件对冬小麦产生的不利影响。本研究结果与之相似。本研究发现,在NaCl 胁迫条件下,加入1×10-10~1×10-6mol·L-1的异甜菊醇浸种处理与对照(CK2)相比,油菜种子的发芽率、发芽指数、活力指数,幼苗的苗高和根长均显著升高,其中以1×10-9~1×10-8mol·L-1异甜菊醇浸种处理效果最优。表明用适宜浓度的异甜菊醇浸种,能有效缓解盐胁迫对种子发芽和成苗过程产生的伤害。
3.2 异甜菊醇浸种处理有助于提高盐胁迫下油菜幼苗根系活力和叶绿素含量
植物根系作为植物吸收水分和矿物质质元素的重要器官,也是最先感受土壤胁迫环境的部位,根部细胞通过离子平衡、拒盐作用和Na+分隔等方式来响应盐胁迫环境[23]。根系活力主要反映根部氧化、还原、吸收和合成物质的能力,其活力的大小对维持植物地上部的快速生长起到关键作用[24]。有研究表明,茉莉酸甲酯、氯化钙和脯氨酸能促进盐胁迫下植物的根系活力,这可能与外源物质参与调解根系细胞渗透压、清除自由基和调控相关酶的活性有关[25]。本研究发现,与CK1相比,CK2显著减低油菜幼苗根系活力。而1×10-8mol·L-1异甜菊醇浸种处理与CK2相比,根系活力增加27.33%。表明在盐胁迫下,异甜菊醇浸种可提高油菜幼苗根系活力,有利于根系对水分和矿物质的吸收,提高幼苗的抗盐能力。
在盐胁迫下,由于植物根系活力减弱,吸收不到足够的养分和水分,造成营养不良,致使叶片中叶绿素含量降低[26]。叶绿素含量的稳定有助于维持植物在逆境中光合作用的正常运转,其含量的多少直接影响植物光合能量的收集、传递和转化的效率,从而影响净光合产物的积累,最终影响植物体的生物量[27]。有研究表明,盐胁迫下甜高粱幼苗叶片中的叶绿素a、b 含量均有所下降,当加入硝酸钾后,叶片中光合色素含量显著增加[28]。另外,有学者发现,赤霉素可提高盐胁迫下水稻叶片叶绿素总量,增强植物的抗逆性[29]。本研究发现,在盐胁迫下,1×10-8mol·L-1异甜菊醇浸种处理与CK2相比,叶绿素总含量提高36.94%。表明异甜菊醇浸种,可缓解盐胁迫对油菜幼苗光合色素合成产生的抑制作用,从而有利于保证幼苗正常进行光合作用。
3.3 异甜菊醇浸种处理能调节盐胁迫下油菜幼苗抗氧化酶系统
植物在正常生理作用下,体内ROS 的清除与产生处于一种动态平衡。当植物体处于生物或非生物胁迫环境下,这种动态平衡会被打破,体内将会积累过量的ROS,进而对植物细胞膜系统产生氧化损伤[30]。MDA 作为膜脂过氧化作用的产物之一,其含量的多少常被用于反映植物细胞的氧化损伤程度[31]。植物在长期进化的过程中,抗氧化酶系统的形成有助于ROS 的平衡,其中植物细胞内的SOD、POD、CAT 等抗氧化酶系统的主要成分在胁迫环境中将会被激活,能有效清除多余的过氧化物、羟基自由基、超氧化物阴离子等活性氧,减少细胞内MDA 的产生[32]。有研究表明,在盐胁迫下,水稻幼苗喷施25~100 mg·L-1赤霉素后,抗氧化酶活性显著增加,可有效清除过量的ROS,减少膜脂过氧化作用,显著降低叶片的MDA 含量,提高水稻的耐盐能力[33]。Mikhailov 等[34]研究发现,在镉和锌的胁迫下,用浓度为1×10-8mol·L-1的甜菊苷浸种,可以提高冬小麦叶片中抗坏血酸过氧化物酶活性,有利于清除体内多余的ROS,缓解重金属对冬小麦幼苗的毒害。本试验结果显示,在盐胁迫下,用1×10-9mol·L-1的异甜菊醇浸种,油菜幼苗子叶的POD 和CAT 活性最高,分别比CK2提高140.80%和47.25%;用1×10-8mol·L-1的异甜菊醇浸种,幼苗子叶的SOD 活性比CK2提高83.31%,同时MDA 含量降低32.11%。由此表明,盐胁迫下,用适宜浓度的异甜菊醇浸种,能有效调节植物体内抗氧化酶系统,清除多余的ROS,减少因ROS 积累对植物细胞造成的伤害,从而提高幼苗的抗盐能力。
综上所述,采用适宜浓度的异甜菊醇浸种,能有效缓解盐胁迫对油菜种子发芽和幼苗生长产生的伤害。其中以1×10-9~1×10-8mol·L-1异甜菊醇浸种处理,油菜种子的发芽率、发芽指数和活力指数最高,同时能显著提高幼苗根长、苗高、叶绿素含量、抗氧化酶活性和根系活力,降低子叶的MDA 含量,提高油菜幼苗的抗盐能力。
