氧化乐果降解菌ZZY-C13-1-9 的筛选、鉴定及降解能力
2020-11-25孙晓宇赵玲侠沈卫荣
陈 锐,瞿 佳,门 欣,邓 媛,孙晓宇,赵玲侠,沈卫荣
(1.陕西省微生物研究所微生物菌种资源研究中心,陕西 西安 710043;2.陕西省科学院秦岭天然产物工程中心,陕西 西安 710043)
0 引言
【研究意义】氧化乐果是常用的一类有机磷杀虫剂,其作用原理是通过抑制乙酰胆碱酶(AChE)活性,导致神经损伤,从而杀死目标物[1]。残留于土壤中的氧化乐果一方面对自然环境造成破坏,研究表明氧化乐果在土壤中显著抑制土壤脲酶活性[2],对自然环境中的蜜蜂、斑马鱼、水藻等有较高毒性[3-5];另一方面对人类健康产生威胁,据研究表明有机磷酸酯诱导迟发性多发性神经病[6],诱导咽癌细胞增殖[7],具有发育毒性和神经毒性[8],成人及儿童暴露于有机磷的威胁不容乐观[9]。快速降低土壤残留的氧化乐果水平可改善土壤质量,保护环境及人类健康。【前人研究进展】土壤中残留的有机污染物一般采用物理、化学及生物等方法进行处理,已有研究表明微生物具有降解有机磷类农药的潜能[10]。目前报道的对有机磷农药具有降解能力的微生物有很多[11],已分离出降解马拉硫磷的假单胞菌(Pseudomonassp.)和绿色木霉(Trichoderma viride)[12],降解甲基对硫磷、三唑磷的斯氏假单胞菌(Pseudomonas stutzeri)[13],降解草甘膦的苍白杆菌(Ochrobactrumsp.)和无色杆菌(Achromobactersp.)[14],降解久效磷的鞘氨醇单胞菌(Sphingobiumsp.)[15]等。根据我国微生物肥料生物安全通用技术准则的要求(NY 1109-2006),前述部分菌株可能为条件致病菌,需经过急毒或致病性实验验证其安全性才可应用,例如绿色木霉或假单胞属。另外一部分菌株虽对氧化乐果有降解能力,但降解水平较低,例如:短波单胞菌属(Brevundimonassp.)在土壤中可降解1 mg·kg-1的氧化乐果,降解率87.75%[16]。【本研究切入点】关于高浓度氧化乐果的生物降解研究报道不多,土壤试验及田间试验报道则更少,单一微生物是否可加速棚室土壤残留氧化乐果降解有待进一步验证。【拟解决的关键问题】本研究拟通过高浓度的氧化乐果富集筛选方法从土壤中筛选获得微生物菌株,该菌株不仅在摇瓶中对氧化乐果有较好的降解效果,在土壤中亦能发挥迅速降低氧化乐果含量的功能,对加快土壤中氧化乐果降解具有一定应用价值。
1 材料与方法
1.1 材料
1.1.1 样本 土壤样品来源于陕西省渭南、周至枣园及秦岭田峪等地,共收集土壤样本24 份(表1)。
1.1.2 无机盐培养基 硫酸铵 0.4 g,硝酸铵 1.2 g,磷酸二氢钾 0.5 g,磷酸氢二钾1.5 g,硫酸镁 0.5 g,氯化钠 0.5 g,pH 7.0,定容至1 L。121 ℃ 灭菌20 min。
1.1.3 发酵培养基 酵母浸粉2.5 g、蛋白胨5 g、甘油2.5 mL、NaCl 2.5 g、磷酸二氢钾2.5 g,加水至500 mL。
1.1.4 有机磷测试试剂 (1)4 % NaOH 溶液:4 g NaOH 加去离子水定容至100 mL。(2)3.75 mol·L-1硫酸溶液:100 mL 容量瓶内加去离子水80 mL,慢慢滴加20 mL 浓硫酸至100 mL。(3)2.769 %钼酸铵溶液:准确称取2.769 g 钼酸铵,加去离子水定容至100 mL。(4)0.2 %氯化亚锡:0.2 g 加去离子水定容至100 mL。
1.2 方法
1.2.1 氧化乐果降解菌的分离 在100 mL 无机盐培养基中加入2.5 mL 氧化乐果(质量浓度1 000 mg·L-1,沙隆达,40%乳油)混匀。加入土样1 g,30 ℃ 180 r·min-1摇床培养7 d。取1 mL 转接至100 mL 无机盐液体培养基(含氧化乐果1 000 mg·L-1),30 ℃ 180 r·min-1继续培养7 d,连续3 次[17]。取发酵培养液1 mL,梯度稀释,涂布于含氧化乐果(1 000 mg·L-1)的无机盐固体培养基上,30 ℃培养,待菌落形成。选取单菌落进行营养肉汤平板划线纯化3 次,甘油管-80℃超低温保藏。
1.2.2 菌株降解能力的初步测定 将菌接种于营养肉汤培养基中,30 ℃、 180 r·min-1震荡培养24 h。100 mL 发酵培养基(含氧化乐果 400 mg·L-1),接入 菌 液1 mL,30 ℃、180 r·min-1震 荡 培 养240 h。3 次重复,设无菌培养液作为空白对照。以钼酸铵显色法进行氧化乐果含量的测定[18]。配制不同浓度标准试剂(沈阳化工研究院,含量大于95%),制作标准曲线。取发酵液100 μL 至带刻度试管,加入4%NaOH 溶液1 mL,振摇1 min,然后依次加入3.75 mol ·L-1的硫酸溶液280 μL,2.769%钼酸铵溶液200 μL,0.2%的氯化亚锡溶液150 μL,定容至2.5 mL,混匀。放置5 min,各取100 μL 至96 孔板,710 nm下检测。
1.2.3 降解菌的形态及种属鉴定 取菌株在营养肉汤平板上划线,30 ℃培养48 h,观察其菌落形态,取菌体涂片进行革兰氏染色鉴定。
取培养的单菌落,使用Biolog 鉴定系统,MicroPlates 微孔板:Biolog GEN III MicroPlates(Biolog Catalog No.1030),接种液:IF-A(Biolog Catalog No.72401),试验方法参照说明书,对菌株进行种属鉴定。
1.2.4 降解菌的16S rDNA 序列鉴定 取菌液2 mL,离心取菌体,提取菌株的基因组(TIANGEN DP302)。选择保守区M13 序列,引物采用27F5'-AGAGTTTG ATCMTGGCTCAG- 3′、1492R5′-TACGGYTACCTTG TTACGACTT-3′,PCR 扩增16S rDNA,测序(奥科)。测序结果利用Blast 软件在GenBank 数据库中进行比对,用系统发育树软件Clustal X 及MEGA 4 构建分类系统发育树。
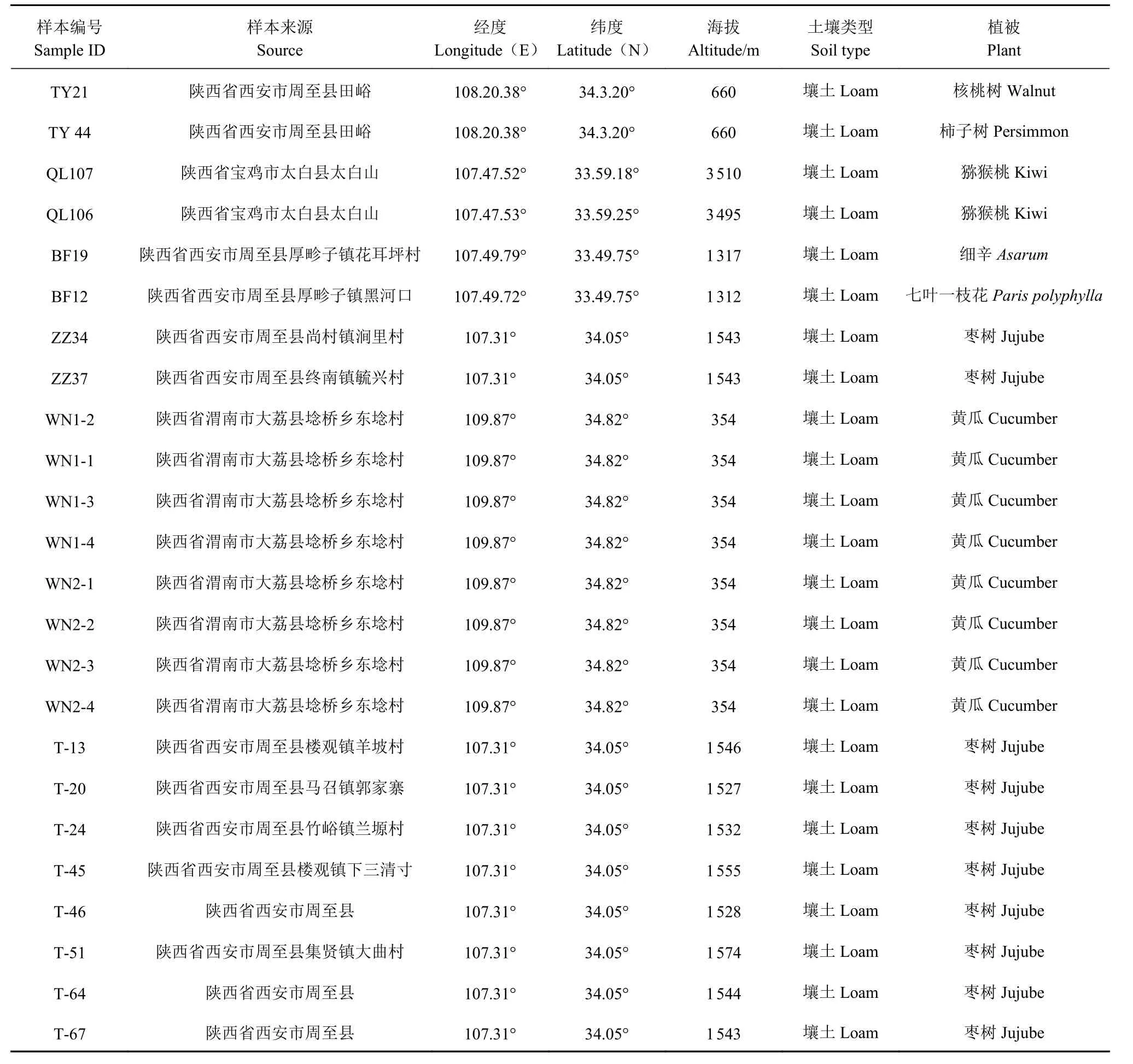
表1 土壤样本信息Table 1 Information on soil sample
1.2.5 HPLC 法测定氧化乐果残留量 吸取10 μL 氧化乐果标准品,用水∶甲醇=4∶1(v/v)稀释成500、400、200、100、50、10 mg·L-1等梯度浓度,各5 mL,HPLC 测定,制作标准曲线。
取氧化乐果乳油1 mL 加入100 mL 发酵培养基中(质量浓度约为400 mg·L-1),接入菌液1 mL,30 ℃、180 r·min-1摇瓶培养。0 h、240 h 分别取样测定氧化乐果含量。取8 mL 发酵液,加入2 mL 甲醇,离心去除菌体,待HPLC 测定[19]。HPLC 检测:色谱柱依利特C18柱,粒径5 μm,检测波长220 nm,流动相水∶甲醇=4∶1,流速1.0 mL·min-1,柱温40 ℃,进样量10 μL。
1.2.6 降解菌株对其他有机磷农药耐药能力测定 在10 mL 发酵培养基中分别加入不同浓度的敌敌畏(77.5% 乳油 沙隆达)、敌百虫(90% 原药 沙隆达)(质量浓度为1 000、500、200 mg·L-1),接入菌 液100 μL,30 ℃、180 r·min-1培 养48 h 后 测 定OD600nm,观察菌株的生长受农药抑制情况。
1.2.7 菌剂制备及土壤室内验证试验 将降解菌接种于发酵培养基进行菌体发酵,30 ℃、180 r·min-1培养48 h,离心收集菌体。按照菌体∶甘油的体积比1∶1 的比例加入甘油,并搅拌混合均匀;再按照菌体∶活性炭∶高岭土体积比2∶3∶3 的比例加入过300 目筛的活性炭和高岭土,搅拌混合均匀,获得农药氧化乐果降解微生物菌剂。在室内进行土壤降解试验。取4 kg 无菌营养土,人工添加氧化乐果,使氧化乐果含量达到200 mg·kg-1,再加入菌剂20 g 搅拌均匀,保持室内温度25~34 ℃,定期轻翻土壤、喷施补充水分,保持土壤湿度25%~30%,45 d 后测定土壤氧化乐果残留量。准确称取土壤20 g,加无水硫酸钠研磨至干粉状后,移置300 mL 具塞锥形瓶中, 加入60 mL 二氯甲烷浸泡6~8 h,过滤,再次加入二氯甲烷,萃取3 次[20]。合并萃取液,60 ℃水浴旋转真空蒸发至干,加入甲醇∶水(1∶4)溶解,定容至20 mL,HPLC 测定。
2 结果与分析
2.1 氧化乐果降解菌的分离
通过富集培养筛选从周至枣园土壤中分离获得1 株细菌,该菌株可在无机盐(含氧化乐果1 000 mg·L-1)平板上正常生长,经数次纯化获得单一纯培养菌株,将该菌命名为ZZY-C13-1-9。
2.2 ZZY-C13-1-9 降解能力初步测定
240 h 后取发酵液100 μL,钼酸铵显色,测定OD710nm。与空白对照相比,ZZY-C13-1-9 显著降低了氧化乐果在发酵液中的含量,240 h 发酵液中残留量为14%,空白对照为92%,具有显著差异(图1,P<0.01),ZZY-C13-1-9 可有效降解氧化乐果。为进一步验证该菌株的降解能力需通过其他更精准的方法进行检测。

图1 氧化乐果残留含量Fig.1 Omethoate residue in fermentation broth
2.3 降解菌ZZY-C13-1-9 形态鉴定
镜检ZZY-C13-1-9 为直的革兰氏阴性杆菌,不产生芽孢。菌落形态,光滑,圆形,微微凸起,表面湿润,半透明,直径1~2 mm(图2)。

图2 ZZY-C13-1-9 菌株形态鉴定Fig.2 Morphology of ZZY-C13-1-9
该菌可利用D-甘露醇、D-阿拉伯醇、肌醇、D-半乳糖、D-葡萄糖、甘油、肌醇、L-丙氨酸、L-精氨酸、L-天冬氨酸、L-谷氨酸、L-组胺、L-乳酸、柠檬酸、L-焦谷氨酸和L-丝氨酸,不分解利用蔗糖、糊精、麦芽糖、乳糖、明胶、甲酸。耐受林肯霉素、万古霉素、利福平等抗生素。过氧化氢酶阳性和氧化酶阴性。参考伯杰氏细菌鉴定手册,初步鉴定该菌为嗜松香假单胞菌(Pseudomonas abietaniphila)。
2.4 降解菌ZZY-C13-1-9 的16S rDNA 序列鉴定
将降解菌16S rDNA 基因序列扩增测序,经GenBank 数据库比对。选取DSM、ATCC、BCRC 等库藏标准菌株核酸序列作为参考,用系统发育树软件Clustal X 及MEGA 4 构建系统发育树(图3)。系统发育树显示该菌为嗜松香假单胞菌(Pseudomonas abietaniphila)。将该序列提交Genbank,登录号为:MN 709 129。
2.5 降解菌ZZY-C13-1-9 对氧化乐果的降解率测定
不同浓度标准品经HPLC 测定,绘制标准曲线为:y=1 915.3x+446.3,R2=0.998 2,曲线适用范围为10~500 mg·L-1。取发酵液8 mL 加 入2 mL 甲 醇 助溶,去除菌体后经HPLC 法测定,摇瓶发酵240 h后氧化乐果残留量如图4 所示。ZZY-C13-1-9 接入发酵培养基(含氧化乐果400 mg·L-1),30 ℃、180 r·min-1摇瓶培养240 h 后,发酵液中氧化乐果残留量为31.5 mg·L-1,残留量约7.7%,空白对照发酵240 h 后氧化乐果含量为336 mg·L-1,约为85.0%,差异极显著(t-test,P=0.003 9)。
2.6 假单胞菌ZZY-C13-1-9 对其他有机磷农药耐受测定
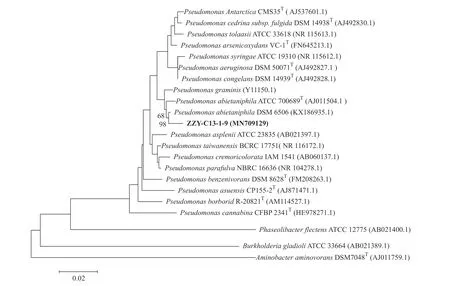
图3 ZZY-C13-1-9 与模式菌株系统进化树Fig.3 Phylogenetic tree of ZZY-C13-1-9
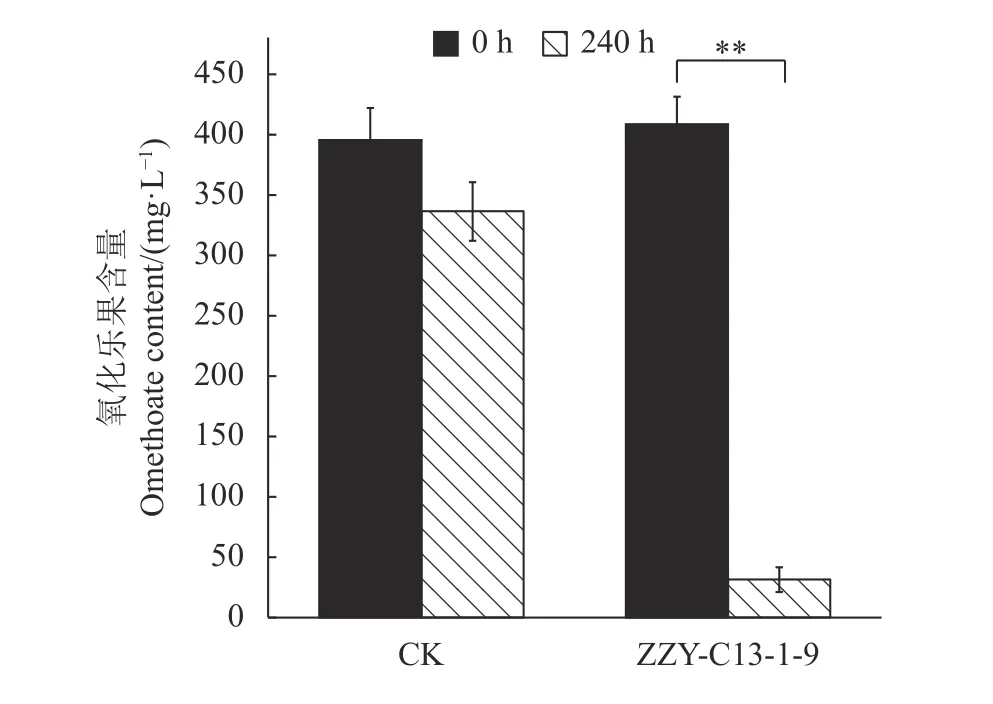
图4 氧化乐果残留量Fig.4 Quantity of omethoate residues
有文献表明对有机磷农药有降解能力的微生物对其他有机磷农药也具有一定的降解能力[21]。为了验证嗜松香假单胞菌ZZY-C13-1-9 对其他有机磷农药的耐受能力,将不同浓度的敌百虫或敌敌畏加入10 mL 发酵培养基试管,30 ℃、180 r·min-1发酵48 h后测定OD600nm。其结果表明,假单胞菌 ZZY-C13-1-9 不但可耐受其他高浓度有机磷农药(表2),敌敌畏还可能刺激该菌株的生长。对其他有机磷是否具降解能力待进一步检测验证。
2.7 菌剂制备及土壤室内试验
降解菌ZZY-C13-1-9 发酵后离心与甘油、活性炭、高岭土复配后形成菌剂。所使用的试验土壤pH 为6.4±0.4,含盐量(0.91±0.24)g·kg-1,总 磷2.44 g·kg-1,总钾 21.10 g·kg-1,总碳 28.00 g·kg-1,含水量25%~30%。土壤室内试验中依照土壤重量的5‰施用菌剂,保持室内温度25~34 ℃,保持土壤相当的湿度及松散度,定期进行补水及翻动。45 d后取土壤样本进行萃取,HPLC 法测定,土壤中约213 mg·L-1的氧化乐果被降解至87.0 mg·L-1,降解率达59.2%,空白对照土壤为169.58 mg·L-1,自然降解率为24.33%(表3),具有极显著差异(t-test,P=0.016)。
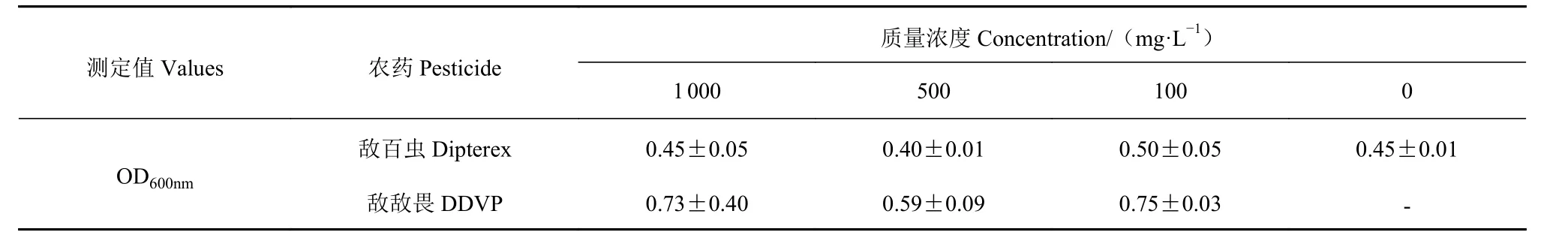
表2 ZZY-C13-1-9 对其他有机磷农药的耐受Table 2 Tolerance of ZZY-C13-1-9 to organophosphorus pesticides
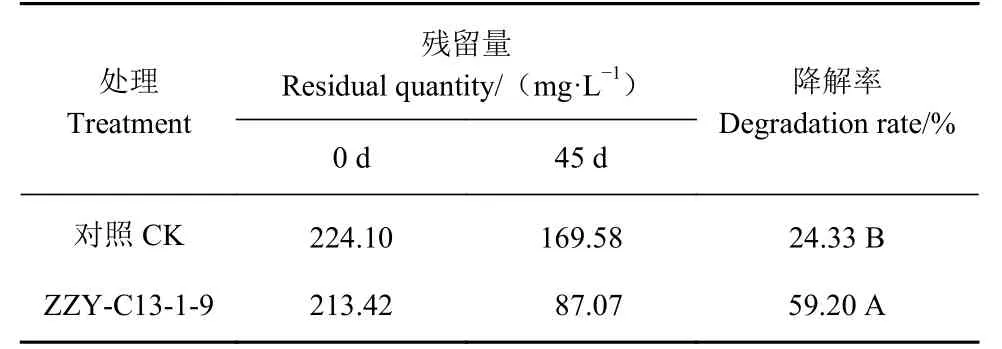
表3 土壤室内试验氧化乐果残留量及降解率(t-test,P=0.016)Table 3 Residues and degradation rate of omethoate in laboratory soil (t-test, P=0.016)
3 讨论与结论
环境污染是生态环境及人类健康面临的重要威胁,农药和化学污染物、重金属是最为主要的环境污染因素[22]。一方面农药使用控制了植物病害,提高作物产量,促进了经济发展,另一方面过量使用的农药又引起了生态环境问题[23]。残留的农药通过各种途径进入环境,引起了生态改变[24-25],造成人类神经系统疾病[26]、引发遗传癌变[27]或肠道微生物菌群改变等问题[28]。微生物法降解土壤残留农药对于恢复生态环境、降低食品安全风险具有重要意义[29]。微生物可将复杂有机分子最终分解成为水和CO2,利用微生物增殖速度快的特点,在短时内快速降低土壤中农药残留的水平,使土壤恢复健康状态[30],并且该方法经济,没有二次污染[31]。
关于氧化乐果的生物降解研究报道并不太多,M Chun 等[32]报道曲霉(Aspergillus spp.)菌株F-1 可将2 000 mg·L-1的氧化乐果在8 d 内降解90%。Li 等[33]报道植物乳杆菌菌株(Lactobacillus plantarum)P9 可将0.5 mg·L-1的氧化乐果在7 d 内降解56%。在本研究中除嗜松香假单胞菌ZZY-C13-1-9 以外也获得无色杆菌(Achromobactersp.)、阴沟肠杆菌(Enterobacter cloacae)、成团泛菌(Pantoea agglomerans)、苍白杆菌(Ochrobactrum sp.)等菌株对氧化乐果也具有一定的降解性能。但具有条件致病性的菌株如苍白杆菌(Ochrobactrumsp.)、阴沟肠杆菌(Enterobacter cloacae)等不利于应用型研究的开展。本研究筛选获得的微生物菌株ZZY-C13-1-9,在含1 000 mg·L-1的氧化乐果无机盐培养基中正常生长。经鉴定确定该菌为嗜松香假单胞菌(Pseudomonas abietaniphila)。经HPLC 证实,在含氧化乐果400 mg·L-1发酵培养基中,30 ℃、180 r·min-1摇瓶培养240 h,氧化乐果的降解率达92.3%,该菌株无生物毒性,非条件致病,适于农业生产应用。
顾欣等[16]报道短波单胞菌(Brevundimonassp.)菌株A1A18 在田间试验中可将氧化乐果(1 mg·kg-1)在7 d 内降低86.19%。本研究获得的假单胞菌ZZYC13-1-9 经土壤室内试验验证有效,土壤室内试验证明:土壤水分含量保持25%~30%,室内温度25~34 ℃嗜松香假单胞菌ZZY C13-1-9 在45 d 后可将土壤中200 mg·L-1的氧化乐果降解59.2%。但其代谢途径及盆栽、田间试验则需进一步进行研究。并且假单胞菌ZZY-C13-1-9 可在其他两种有机磷农药中正常生长,具有降解其他有机磷农药的潜能,对其他农药的降解效果亦待进一步验证。
