绵羊抗消化道线虫感染育种技术研究进展
2020-11-25阎晓菲刘明军
阎晓菲,刘明军
(1.石河子大学动物科技学院,新疆 石河子 832000;2.新疆农业大学科学技术学院,新疆 乌鲁木齐 830052;3.新疆畜牧科学院生物技术研究所/农业农村部草食家畜遗传育种与繁殖重点实验室/新疆动物生物技术重点实验室,新疆 乌鲁木齐 830011)
0 引言
绵羊消化道线虫病主要是由毛圆科(Trichostrongylidae)、 毛 线 科(Trichonematidae)、圆线科(Strongylidae)、钩口科(Ancylostomatidae)的多种线虫混合寄生于皱胃、小肠、大肠所引起的慢性消耗性疾病。该病以消化道炎症、胃肠组织完整性受到损害、营养障碍为主要特征,从而使绵羊渐进性消瘦、贫血、生长发育受阻、增重减缓、饲料利用率降低、甚至衰竭死亡,由此造成养殖费用增加及经济效益下降,严重制约养羊业健康发展[1-3]。目前防治该病以药物治疗为主,每年全世界用于治疗的费用达到数十亿美元[4]。然而,新药的研制是一个长期的过程,而寄生虫对长期使用的药物很快会产生耐药性。早在1980-1990 年间就有养殖户发现,需要使用更昂贵的驱虫药才能达到有效治疗[5],因此寻找控制消化道线虫病的替代方法极为迫切。筛选绵羊消化道线虫的抗性基因进行抗病育种,从遗传本质上提高绵羊的抗性,已成为控制和减少消化道线虫病发生的可持续策略,是提高养羊业生产水平的重要途径[6]。抗病育种技术现已从传统表型选择逐步发展出了标记辅助选择、全基因组关联分析等多种方法,并筛选了多种动物的抗病相关基因[6-9]。本文对已报道的绵羊消化道线虫抗性相关候选基因位点的筛选技术进行了全面综述,旨为今后绵羊消化道线虫病的抗病育种研究提供借鉴。
1 抗病育种技术
从基因水平上增强绵羊对消化道线虫抗性的育种方法主要包括对消化道线虫抗性个体的直接选择和主要由环境导致宿主基因变异的间接选择。
1.1 抗病育种直接选择
绵羊对消化道线虫的抗性受遗传控制。由于个体间遗传变异,不感染或感染强度小的个体通常具有抗性遗传基因,将其选育出进行世代繁殖,可使抗性个体增多,抗性基因频率提高。这种方式直观简便,可顾及所有抗性或易感性的遗传基因。利用这个方法,在自然感染或人工感染条件下,绵羊对消化道线虫的抗性个体的选育有较为广泛的研究报道(见表1)[10-25]。前人研究证明绵羊品种间对消化道线虫的抗性能力存在很大差异,在不同绵羊群体中也证明了存在品种内遗传变异。这些品种在高寄生虫感染和不使用驱虫药的环境条件下,经过长期自然选择,具抗性个体存活、繁衍形成了对寄生虫的较强抵抗力。 因此越是在持续强的疾病感染环境下形成的羊的品种,相对于引进品种对疾病的抵抗力和耐受力越强[26]。传统的育种策略是基于指标性状的使用,其中粪便虫卵数(Faecal egg counts, FEC)可以推算寄生虫的感染强度,是绵羊对消化道线虫抗性的主要指标。用FEC 评价的抗线虫性在小型反刍动物中具有遗传力,遗传力在0.01~0.65[27]。但高抗病性状的形成需要花费几千年的持续表型选择,遗传进展缓慢,耗时长,费用高。尽管对绵羊和山羊进行抗病性选择是可能的和有效的,但由于在收集表型和系谱信息方面的复杂性以及与管理育种计划所涉费用相关的限制,大多数发展中国家尚未完全采用这一方法,而仅限于研究群体。此外,还有其他因素需要考虑。例如,与技术和基础设施有关的问题是大多数绵羊和山羊养殖系统基因改良方案的最大瓶颈:羊群规模小、缺乏明确的育种目标、缺乏或较差的基础设施;尤其是一些小的养殖户没有准确的系谱。这些都是导致农民在育种计划中参与率低的所有因素,使得实现品种内遗传改良具有很大的挑战性[27]。
1.2 抗病育种间接选择
1.2.1 分子遗传标记辅助选择 分子遗传标记辅助选择就是在基因水平上,利用控制性状的DNA 分子标记选择来代替以表型为基础的传统选择方法,特别是用以选择抗病性状和中低等遗传力性状的个体,可以克服直接选择的弊端,实现种羊提早选育,缩短世代间隔,提高育种的准确性,有效减少育种费用。很多疾病是由多基因控制,其标记物较为复杂,但采用数量性状位点(Quantitative trait locus,QTL),可以将影响数量性状的多基因分为几个不连续的遗传因子,使其定位于特定的染色体上,分析它们与其他基因的联系,最终获得其DNA 序列。目前,使用家系研究和连锁分析、串连重复序列数(Variable-number tandem repeat, VNTR)多态性、原位杂交等技术,可以快捷方便地进行QTL 定位,从而开展畜禽抗病性及其他重要经济性状的分子遗传标记选择[28]。通过识别候选基因组区域,绘制QTL 有助于理解寄生虫抗性的复杂性。研究微卫星标记的使用旨在揭示寄生虫抗性机制。目前在寻找绵羊消化道线虫抗性QTL 标记的报道较多(见表2)[29-37]。在绵羊数量性状位点数据库中[Sheep Quantitative Trait Locus (QTL) Database, Sheep QTLdb]包含了 107 个与寄生虫抗性相关的 QTL,这些 QTL涵盖了几乎所有的染色体。与传统的选择方法相比,标记辅助选择可以利用已识别的QTL 加速选择,即使在低频率下也可以找到适合该性状的等位基因[27,38]。尽管利用QTL 可以加快遗传进展,但是由于目前没有发现与胃肠道线虫(Gastrointestinal nematode, GIN)抗性相关的主要QTL,因此使用遗传标记仍然存在一些实际问题,如抗性似乎是多基因性状,在基因组中有许多影响较小的基因座[27]。
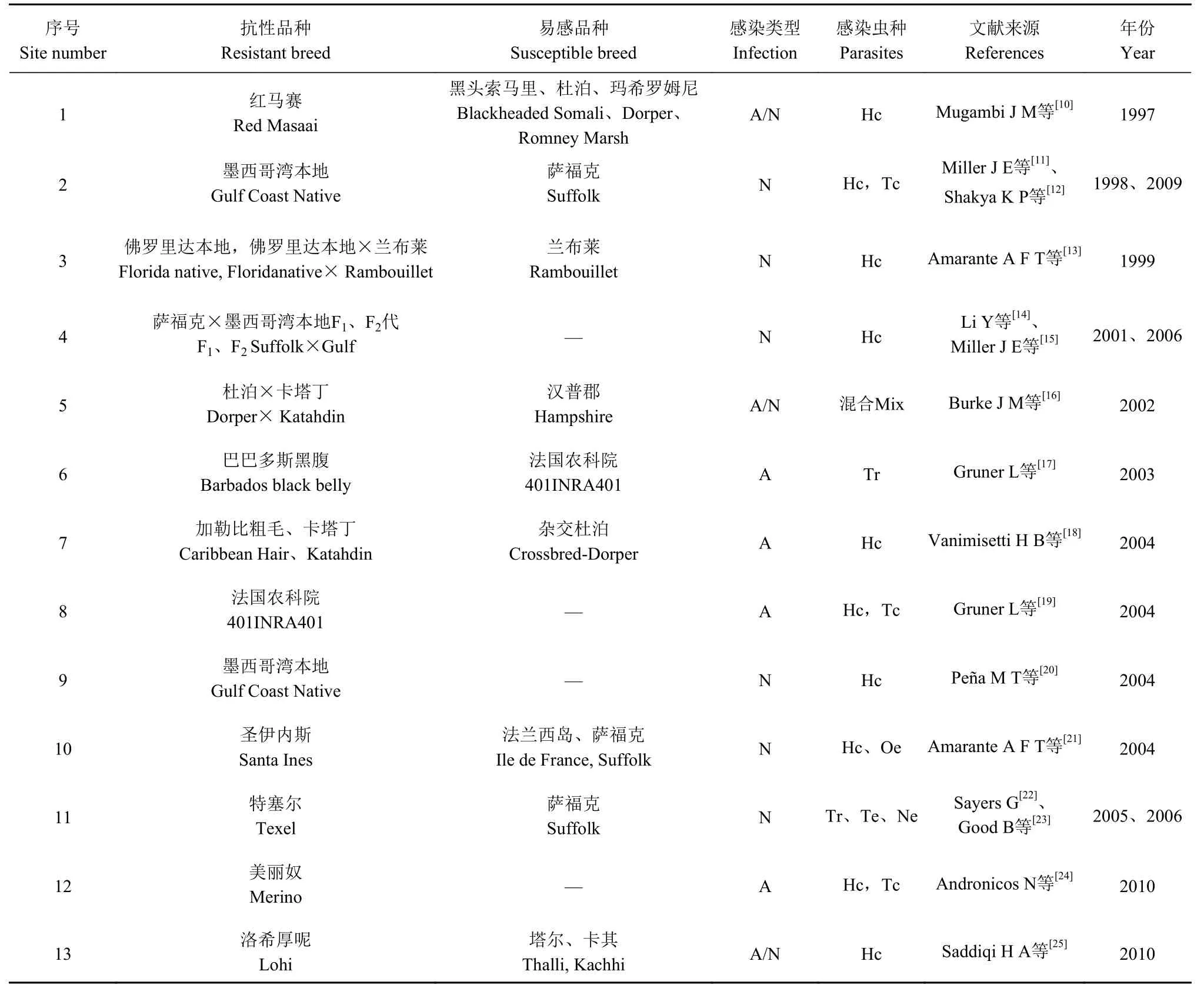
表1 绵羊抗消化道线虫病品种的相关研究Table 1 Studies relating to GIN disease in sheep
1.2.2 全基因组关联分析(Genome wide association,GWA) 通过GWA 研究可揭示抗病性状的遗传基础和遗传机理,是发现影响绵羊复杂性状的基因变异的新策略。传统的QTL 定位仅是对已知的抗性基因进行分析研究,而GWA 是对全基因组范围内的所有位点进行关联分析,拥有更全的关联信息,相比传统遗传标记选择,GWA 更有可能找到与性状真正关联的候选基因,因此不再受到预先假设的候选基因的限制。对于GWA 在分析不同的复杂性状之前,不再像以前一样盲目地预设一些假定条件,而是在病理和对照组中,有目的地比较全基因组范围内所有单核苷酸多态性(Single nucleotide polymorphism,SNP)的等位基因频率或者通过家系进行传递不平衡检验,从而找出与复杂性状显著相关的序列变异。
Benavides M V 等(2015)[39]利用基于GWA 的方法分析了红马赛和杜泊羊的双回交群体中的SNP,鉴定与宿主的消化道线虫抗性密切相关的多态性。结果发现在7 号染色体上检测到一种关联,为相似遗传背景的双回交群体绵羊的消化道线虫抗性标记,提供了额外的SNP 标记信息。Riggio V 等(2013)[40]通过比较GWA 和区域遗传力作图(Regional heritability mapping, RHM)方法,分析了苏格兰黑面羔羊线虫抗性和体重的遗传结构,对FEC 和抗环纹背带线虫3 期幼虫的IgA 活性进行性状分析,作为线虫抗性指标,2 种方法都证明了14 号染色体与绵羊感染细颈属线虫的相关性,6 号染色体与圆线虫FEC 的相关性。整个数据表明,RHM 方法识别出的区域比GWA更多,这表明RHM能够捕获一些GWA分析未检测到的变化。Kemper K E等(2011)[41]人工感染蛇形毛圆线虫和捻转血矛线虫,并测定FEC。通过SNP50串珠芯片和48 640 SNP 标记进行基因分型分析,发现虽然单个标记的影响很小,但可以成功预测绵羊对线虫的抗性。

表2 绵羊消化道线虫病抗性QTL 标记的相关研究Table 2 Studies on GIN-resistant QTL markers in sheep
到现在为止,采用GWA 分析及SNP 标记已经挖掘出很多与消化道线虫抗性相关联的基因和染色体区域,鉴定出的基因位点和染色体区域中,只有很少的部分是位于之前报道的染色体区域之中或者附近,大部分是位于之前从未被报道过的染色体区域,而这些未报道的区域可能对绵羊的消化道线虫抗性形成非常重要。
1.2.3 转录组测序技术 转录组测序,也称为RNA测序 (RNA-Sequencing, RNA-Seq),是这几年新兴的一种高通量转录组测序技术,可在单核苷酸水平上对细胞的全部转录活动进行检测,提供更多的生物体转录信息,辨别一些未知的转录本,定量分析基因的表达水平,识别SNP,研究基因结构变异,能够为全面揭示生物体生命活动中相关基因功能、系统发生与进化及与其他生物相互作用等奠定基础,为进一步提高基因结构信息、挖掘新的基因和新基因的功能及育种和治疗疾病的研究提供重要信息[42]。
RNA-Seq 技术已报道应用于绵羊对消化道线虫感染的抗性基因筛选,已鉴定出多个未曾报道的基因,可作为研究成年羊感染线虫引起免疫应答的分子机制的平台。Chitneedi P K 等(2018)[43]通过抗性和易感成年羊皱胃黏膜和皱胃淋巴结转录组分析,研究了绵羊感染环纹背带线虫的抗性机制。用2 种软件(Deseq 和EdgeR)进行特异性表达分析,发现皱胃黏膜和皱胃淋巴结共有106 个共同的特异性表达基因,可能具有绵羊对消化道线虫抗性活性。与前人的研究结果进行系统性的比较,发现了一些已报道的绵羊抗性基因,如内凝集蛋白2(ITLN2)、氯离子通道辅助蛋白1(CLCA1)和半乳糖等,同时也发现了一些未报道的基因,如过氧化物酶体增殖物激活受体γ 辅助激活因子(PGC)、肺表面活性蛋白D(SFTPD)、微 管 蛋 白α-4A 链(TUBA4A)等12 个。Guo Z 等(2016)[44]通过RNA-Seq 技术,研究了加那利群岛的两个品种绵羊对捻转血矛线虫抗性的分子机制,发现在感染后,抗性品种有711 个基因的转录丰度受到显著影响,易感品种有50 个基因的转录丰度受到显著影响,结果表明,抗性品种易于诱导急性炎症反应、补体激活、加速细胞增殖和随后的组织修复,以及具有针对寄生虫繁殖力的免疫,这些都有助于宿主对寄生虫感染的抵抗力的形成。Mcrae K M 等(2016)[45]为确定抗性和易感羔羊差异表达的生物进程,对消化道线虫抗性和易感苏格兰黑面羔羊的皱胃淋巴结进行转录组测序比较,结果发现在抗性和易感羔羊感染消化道线虫(人工感染3 000 个环纹背带线虫)后,皱胃淋巴结有大量基因表达差异,抗性羔羊比易感羔羊较早出现免疫反应,其中2 个差异表达基因中的SNP 与FEC 有相关性,表明差异表达基因可能是线虫抗性的候选位点。
绵羊对线虫的抗性在品种内和品种间都不同,具有一定的遗传性。为了帮助未来的育种策略和有效、可持续的线虫防治方法的发展,需要详细了解保护免疫所涉及的基因和机制,以及调节这种反应的因素。而芯片只能检测到已知的RNA 转录本的相对丰度,无法获得极微小的基因表达水平改变,这对于了解抗性反应至关重要。因此RNA-Seq 技术可具有更准确的定量、更高的重复性、更广的检测范围、更可靠的分析等特点,使以前从未研究过的新基因得以鉴定,而无需背景知识[46]。
2 绵羊抗消化道线虫感染育种的主要候选基因
目前,已发现的绵羊抗消化道线虫感染相关的免疫候选基因较多,有主要组织相容性复合物(Major histocompatibility complex,MHC)基因、干扰素γ 基因(Interferon Gamma,IFNG)、白介素基因(Interleukin,IL)、半乳凝素基因(Galectin,GAL)、内凝集素基因(Intelectin,ITLN)等。其中MHC和IFNG基因是报道最多的与绵羊消化道线虫感染相关的标记物[47]。
2.1 MHC 基因和IFNG 基因
现已报道的绵羊抗消化道线虫候选基因的遗传标记中,使用最多的是位于20 号染色体的MHC区域[22,31,35,37]。MHC基因具有很高的多态性[48],在向宿主T 淋巴细胞提供经过处理的抗原,引起T 细胞活化和在建立宿主的免疫级联反应中发挥重要作用。仅次于MHC区域的是位于20 号染色体的IFNG基因[32-33,49]。小鼠模型显示,高水平的IFNG可能会刺激Th2 应答拮抗,对消化道线虫产生保护性免疫反应[50]。因此MHC和IFNG可以增加绵羊对消化道线虫的抵抗力。
2.2 ITLN 基因
凝集素具有糖专一性、可促使细胞凝集蛋白质或糖蛋白,由于它对糖的特异结合性决定了它在动物体内具有重要而特殊的生物学功能,使其在兽医临床疾病防治、机体生理活动调控以及生物工程等方面展示出了十分广阔的应用前景[51]。Banwell J G(1993)等[52]首先发现凝集素能促进小肠发育。French AT 等(2008、2009)[53-54]在苏格兰黑脸与莱斯特杂交F1 羔羊感染环纹背带线虫后的淋巴结组织中发现ITLN1和ITLN3的表达,及在皱胃中发现ITLN2表达,研究表明内凝集素基因(ITLN1、ITLN2、ITLN3)与分泌黏液细胞相关,ITLN的早期表达对寄生虫的感染有防御作用,可以改变黏液的特性,能截留线虫。Chitneedi P K 等(2018)[43]在具有对消化道线虫抗性的成年羊皱胃淋巴结转录组分析中,发现ITLN2呈上调表达。因此推测绵羊的内凝集素基因(ITLN1、ITLN2、ITLN3)在消化道线虫感染中发挥着重要作用。
2.3 IL 基因
白介素是人和动物分泌最多和最常见的细胞因子,其主要作用是激活T细胞、巨噬细胞和自然杀伤细胞等及在炎症反应中起重要作用,因此具有很强的抗寄生虫感染作用。Gossner A 等(2013)[55]在对感染环纹背带线虫具有抗性的苏格兰黑脸羔羊研究中,发现绵羊对线虫抗性与体液免疫反应、蛋白质合成、炎症反应、血液系统发育和功能的关系最为密切,其中的IL4RA、IL5RA、IL13RA,特别是IL13RA的活性对抗性表型至关重要。Pease J E 等[56]发现IL5RA是IL5发挥生物学活性所必需的,可促进嗜酸性粒细胞介导活性作用和在严重的炎症反应中补充到组织。嗜酸性粒细胞水平的增加与绵羊对毛圆线虫感染的抗性相关联,也作为绵羊对环纹背带线虫的抗性标记[57]。Chitneedi P K 等[43]的研究中发现IL5RA是绵羊对消化道寄生虫抗性的重要基因。Zaros L G 等(2014)[58]研究发现自然感染消化道线虫后,具有抗性的巴西索马里绵羊皱胃淋巴结IL4、IL13呈上调表达。Gossner A G 等(2012)[59]在研究对环纹背带线虫感染具有抗性的羔羊中发现,其皱胃淋巴结组织的IL6 转录水平与抗性呈正相关,IL21和IL23A转录水平与成虫数量、FEC、IgA 抗体水平呈负相关。
3 结语
传统表型选择、遗传标记辅助选择等技术都可以使绵羊抗消化道线虫感染选择取得一定进展,但不管采用哪种方法开展抗病力选择,都存在不足之处。抗病力同时受遗传和环境的影响,而抗病力遗传力低,传统表型选择虽然性状选择面宽,但遗传进展缓慢,且准确性差;分子标记确定性高,但抗性性状由微效多基因控制,基因间又存在互作,单独用分子标记辅助选择全面性不足。因此,单纯采用一种技术进行选择都有很多局限性,应充分将传统表型选择和标记辅助选择相结合,优势互补。
目前,国外报道的绵羊对消化道线虫的抗性基因及遗传标记不少,但应用于育种实践的报道甚少,一些候选基因抗病作用机制复杂,尚处于试验研究状态。此外,抗性性状与生产性状之间以及对不同疾病的抗性之间常存在一定程度的负相关,且抗性性状和生产性状之间关联的试验证据还很缺乏,抗病基因对生产性状的效应还不是十分清楚。这些问题都在某种程度上制约了绵羊抗消化道线虫感染的育种进展。但随着免疫学与分子遗传学技术的进步,抗病育种技术将进一步完善,建立持久的抗病力,这将是今后控制绵羊消化道线虫感染的可持续的补充控制策略。
