2型糖尿病慢性肾病1期患者肾小球滤过率与腹内脂肪面积的相关性研究
2020-11-24许瑶胡天晓谭擎缨姚佳琦王秀景王惠玲王静
许瑶 胡天晓 谭擎缨 姚佳琦 王秀景 王惠玲 王静
2017国际糖尿病同盟数据显示:全球共有4.25亿成年人患有糖尿病(diabetes mellitus,DM),其中 90%以上为 2 型糖尿病(type 2 diabetes mellitus,T2DM)[1]。T2DM 常合并慢性肾病(chronic kidney disease,CKD),流行病学调查结果显示,糖尿病患者中CKD的患病率为27.1%~83.6%[2],CKD已成为中国糖尿病患者的主要死因之一[3]。为了加强对早期CKD的认知和防治,美国肾病基金会(K/DOQI)专家组提出将肾小球滤过率(glomerular filtration rate,eGFR)≥90 ml/(min·1.73m2)且伴有肾病的患者视为CKD1期。DM早期存在肾小球高滤过、高灌注、高内压等肾血流动力学改变,这种改变是糖尿病肾病(diabetic nephropathy,DN)的始动因素,能诱发糖尿病性肾小球硬化的发生。国外有学者证实,腹型肥胖与DN存在密切关系,肥胖也是终末期肾病的一个重要危险因素[4-5]。CT被公认为是目前测量腹部脂肪含量和分布的金标准[6]。虽然腹型肥胖与DN存在相关性被许多学者所证实,但早期DN患者腹型肥胖与eGFR是否存在相关关系的研究较少。本研究旨在通过CT测量T2DM CKD1期患者腹腔内脏脂肪面积(intra-abdominal fat,VFA),分析eGFR与VFA的相关性,以探讨腹内脂肪在DN机制中的作用。
1 对象和方法
1.1 对象 选取2014年7月至2019年3月在本院内分泌科就诊的T2DM患者228例,男155例,女73例,年龄 25~80(55.94±10.62)岁。所有患者均符合 1999 年WHO糖尿病诊断及分型标准。排除标准:(1)eGFR<90 ml/(min·1.73m2);(2)尿微量白蛋白肌酐比(urine microalbumin-to-urine creatinine ratio,UACR)<30 mg/gCr;(3)妊娠或哺乳期妇女;(4)DM 急性并发症者;(5)恶性肿瘤者;(6)注射胰岛素治疗者;(7)合并其他影响血糖或肾脏功能的内分泌疾病者。所有患者均签署知情同意书。本研究经本院医学伦理委员会审批同意。
1.2 方法
1.2.1 一般资料的收集 性别、年龄、病程、体重、身高、腰围(waist circumference,WC)、臀围、血压,计算 BMI:BMI=体重(kg)/身高(m2),腰围臀围比值(waist-hip ratio,WHR)=腰围/臀围,腰围身高比值(waist-height ratio,WHtR)=腰围/身高。
1.2.2 实验室检查 采用全自动生化仪(德国西门子ADVIA 2400)测量血糖、TC、TG、LDL-C、HDL-C、游离脂肪酸(free fatty acids,FFA)、谷氨酸-丙酮酸转氨酶(glutamate pyruvate transaminase,GPT)、肌酐、尿素氮、白蛋白等生化指标水平,采用ABBOTT免疫分析仪(美国雅培公司,型号 MY01 14000)测量胰岛素,并计算胰岛素抵抗指数(insulin resistance index,HOMA-IR)和eGFR,HOMA-IR=空腹胰岛素(mIU/L)×FPG(mmol/L)/22.5;eGFR采用MDRD计算法计算,eGFR=170×肌酐(μmol/L)-0.999×年龄(岁)-0.176×(女性×0.762)×尿素氮-0.17×白蛋白×0.318,以ml/(min·1.73m2)为单位,精确到小数点后2位。采指尖血用AfinionTMAS100(奥菲领)全自动特种蛋白干式免疫散射色谱分析仪测定糖化血红蛋白(glycosylated hemoglobin,HbA1C);采用尿用AfinionTMAS100(奥菲领)全自动特种蛋白干式免疫散射色谱分析仪测定UACR。
1.2.3 VFA 采用美国GE Discovery CT750 HD型CT机,扫描条件为120 kv,自动毫安,旋转时间0.6 s,扫描层厚1.25 mm,患者取仰卧位,吸气后屏气扫描脐部上下5 cm之间,选定脂肪组织CT值范围-250~-50 Hu,通过软件计算得出VFA,以dm2为单位,精确到小数点后2位。
1.2.4 分组90≤eGFR<120 ml/(min·1.73m2)为A组,eGFR≥120 ml/(min·1.73m2)为B组。
1.3 统计学处理 采用SPSS 19.0统计软件。计量资料以±s表示,两组间比较采用独立样本t检验;计数资料组间比较采用χ2检验;eGFR与年龄、收缩压、舒张压、TG、LDL-C、VFA相关性分析采用Pearson相关,eGFR与 HbA1C、HOMA-IR、TC、HDL-C、FFA 相关性分析采用Spearman秩相关。以eGFR为应变量,进行多重线性逐步回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料的比较 最终A组纳入112例,B 组纳入 116例。B 组BMI、WC、WHR、WHtR、VFA、TG均高于A组,A组年龄高于B组,差异均有统计学意义(均P<0.05);两组间性别、收缩压、舒张压、病程、HbA1C、HOMA-IR、TC、HDL-C、LDL-C、FFA、UACR 均无统计学差异(均P>0.05),见表1。
2.2 eGFR影响因素分析 相关性分析发现,eGFR与VFA呈正相关(r=0.317,P<0.05)。eGFR与TG呈正相关(r=0.240,P<0.05)。eGFR 与年龄呈负相关(r=-0.430,P<0.05)。eGFR与性别、病程、收缩压、舒张压、HOMAIR、HbA1C、TC、LDL-C、HDL-C、FFA、UACR 均无相关。
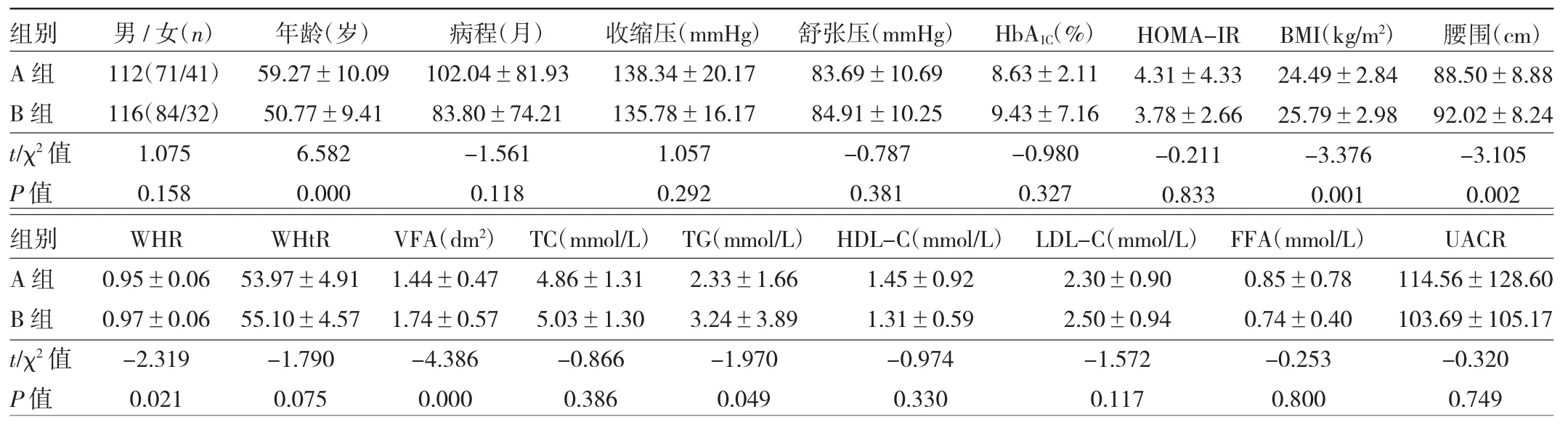
表1 两组患者一般资料的比较
多重线性逐步回归分析以eGFR为应变量,以VFA、TG、年龄、病程、收缩压、舒张压、HOMA-IR、HbA1C、TC、LDL-C、HDL-C、FFA、UACR 为自变量,结果显示VFA、年龄、UACR、TG是eGFR的独立相关因素,见表2。
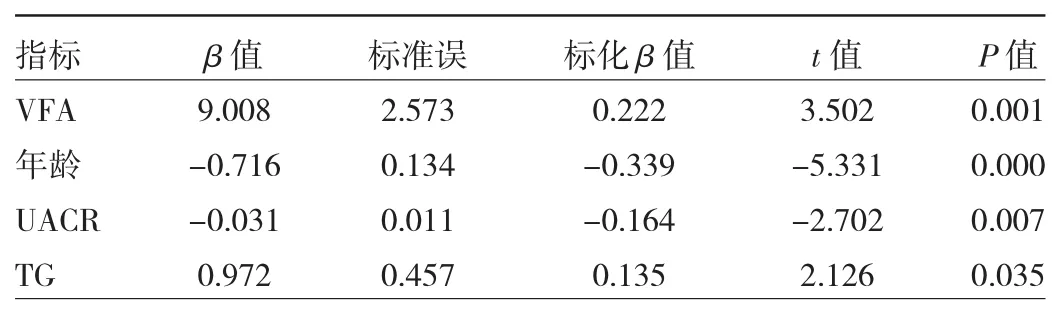
表2 eGFR的多重线性回归分析
3 讨论
众所周知,DN是T2DM常见的并发症之一。Zhang等[7]研究中国CKD发病趋势时发现,2015年数据显示,约有21.3%的DM伴有DN,糖尿病相关CKD所占比例超过了肾小球肾炎相关CKD(分别为1.10%和0.75%),DN已经成为CKD的首要病因。因此,早期干预有助于降低DN的发病率。尿白蛋白是DN常见的临床症状和评价CKD的临床指标之一,但有研究发现有近一半的T2DM伴慢性肾功能不全的患者无白蛋白尿改变[8]。血肌酐也因影响因素较多,且当eGFR低于1/3时,血肌酐才会明显升高。因此,血肌酐、尿白蛋白对早期DN的评价不如eGFR敏感[9]。根据eGFR水平美国KDOQI专家组将CKD分为5期。其中,CKD1期患者eGFR正常或呈高滤过状态,为DN早期,研究此期患者对于DN的筛查,并发症治疗,延缓DN的进展,减少心血管患病风险更具有意义。有研究发现,在初发的T2DM患者中就有39.5%存在肾小球高滤过,且这种高GFR状态可能与高血糖、高胰高糖素和生长激素、高蛋白摄入及肾血流动力学改变有关,是DN进展的高度危险因素[10]。
因此,本研究以eGFR为切入点,选取T2DM CKD1期患者,通过分析eGFR与VFA的相关性,以探讨腹内脂肪在DN机制中的作用。
虽然目前测量腹部脂肪、评价腹型肥胖的方法多种多样,但因CT可以精确计算出腹内和皮下脂肪组织的面积,一般测量脐部上下5 cm之间,此处可避开肝脏、肾下极的干扰,数值为精确体脂参数,所以被公认为是目前测量腹部脂肪含量和分布的金标准。腹型肥胖包含腹腔内脏脂肪和皮下脂肪。腹腔内脏脂肪较皮下脂肪血流及神经分布更丰富,受体表达更高,细胞活性更强。因此,腹腔内脏脂肪对人体交感神经更为敏感,脂肪因子及FFA等形成更多。由此可见,腹腔内脏脂肪可能与DN等代谢相关联性疾病关系更为密切,而VFA较其他方式更精确的区分腹内和皮下脂肪。本研究通过CT测量VFA评判肥胖,将eGFR进行分组,90≤eGFR<120 ml/(min·1.73m2)为A组,eGFR≥120 ml/(min·1.73m2)为B组,两组间VFA差异有统计学意义。本研究结果显示,B组BMI、WC、WHR、VFA均高于A组,差异有统计学意义,说明VFA增多会引起肾脏高滤过。eGFR与VFA呈正相关,矫正相关因素影响后仍存在相关关系,说明VFA可能是DN的危险因素之一;T2DM CKD1期患者,eGFR随着VFA的增加而增加。
腹型肥胖是胰岛素抵抗和T2DM的主要病理生理基础。一方面,脂肪可以通过刺激胰岛素样生长因子1、转化生长因子β导致高胰岛素血症、胰岛素抵抗来引发DN[2]。另一方面,脂肪可以渗入肾窦,致肾内静水压明显升高,肾组织局部缺氧而损伤[5]。另外,Vandevijvere等[11]指出由脂肪细胞或浸润巨噬细胞分泌的脂肪细胞因子可致机体轻度炎性状态,在胰岛素抵抗、T2DM及肥胖相关心血管疾病的发生、发展中起关键作用。也有研究发现,减轻体重可改善肥胖相关的高滤过状态、减少蛋白尿[12]。
大多数肥胖者存在入球小血管轻度扩张、系膜基质和系膜细胞增殖、足细胞肥大等肾小球病变[13]。而早期DN无蛋白尿时期也可出现类似的病理变化[14]。Patel等[15]研究证实BMI与eGFR存在密切相关性。Fiseha等[16]研究214例T2DM患者发现,肥胖是CKD的独立危险因素。张颖莹等[17]用BMI评估肥胖,发现肥胖及肥胖相关的脂质紊乱通过影响氧化应激系统引起DN。张翠萍等[18]分别用 BMI、WC、WHR 评估肥胖发现,DN 发生和发展与中心性肥胖独立相关。高飞等[19]根据尿微量排泄率分为DN组与非DN组,比较发现两组间BMI、WHR差异有统计学意义,同样证明中心性肥胖与DN的发病和发展有密切联系。Madero等[20]证实肥胖与肾功能存在密切相关性,认为通过测量人体脂肪可预测肾功能下降风险。Docherty等[21]通过总结多种减重方法对终末期肾病的影响,最终得出结论,减重可延缓CKD的进展。以上研究均提示肥胖是肾脏损伤的危险因素,通过减轻体重部分肾脏损伤可逆转。
综上所述,伴有腹型肥胖的DM患者应重视通过减轻体重、减小腰围来减少VFA。在eGFR增高的早期DN患者中,可以通过降低VFA来防止DN的发展,且eGFR是临床上评判早期DN的指标之一,本研究可能为今后研究通过控制体重、减少VFA来预防和延缓DN进展提供一些依据。
