卵泡输出率与成熟卵子输出率预测卵巢反应性及妊娠结局
2020-11-24周小花游慧娴汪晨曦陈余英尹兰兰梁晓马天仲
周小花,游慧娴,汪晨曦,陈余英,尹兰兰,梁晓,马天仲
(广东医科大学附属医院,湛江 524001)
辅助生殖技术(ART)是治疗不孕症的有效手段,控制性促排卵(COH)获得高质量的卵母细胞是其中非常重要的环节,而卵巢反应性的高低决定了能否募集到足够数量的高质量卵母细胞[1-3]。既往常用于预测卵巢反应性及妊娠结局的指标有:抗苗勒管激素(AMH)、抑制素B、年龄、窦卵泡计数(AFC)、基础性激素、卵巢敏感性(OSI)、卵泡敏感性(FSI)及卵母细胞指数(FOI)等[4-7],而这些指标在预测卵巢对外源性促性腺激素(Gn)的反应存在一定的局限性。Genro等[8]在2011年提出卵泡输出率(FORT)的概念,即在COH过程中,使用外源性促性腺激素释放激素激动剂(GnRH-a)进行垂体降调节,降调达标后使用阴道B超监测AFC,根据个体情况调整Gn用量直至注射人绒毛膜促性腺激素(HCG)日,阴道B超监测成熟卵泡数(PFC,即直径16~22 mm的卵泡个数),两者的比值即为卵泡输出率(FORT=PFC/AFC×100%)[9-10]。最近研究发现,在预测卵巢反应性及妊娠结局时FORT优于其他指标[11]。既往关于FORT对卵巢反应性及妊娠结局的研究中,PFC是取直径14~22 mm或16~22 mm的卵泡个数[8,12-13],由于本中心对于HCG日直径在12~22 mm的卵泡临床医生都会常规穿刺取卵,且这些卵泡基本具备一定的发育潜能[14],因此本研究中PFC为直径12~22 mm的卵泡个数。因B超下监测的成熟卵泡不一定能成功获卵,本研究还对成熟卵母细胞(MⅡ卵数)展开研究。根据FORT的命名依据本研究提出了成熟卵母细胞输出率(MⅡOORT)的概念,即MⅡOORT=MⅡ卵数/AFC×100%。目前国内外较少见FORT与输卵管因素不孕患者的相关研究,本研究就FORT、MIIOORT与输卵管因素不孕患者的卵巢反应性及IVF/ICSI妊娠情况的相关性进行回顾性研究。
资料与方法
一、研究对象
选择2013年1月至2018年8月在广东医科大学附属医院生殖中心因输卵管因素行IVF/ICSI-ET治疗的的患者临床资料。纳入标准:(1)20 岁≤年龄≤38 岁,16 kg/m2≤BMI≤27 kg/m2;(2)卵泡数据收集完整;(3)促排卵方案为长方案的新鲜周期;(4)影像学或其他方法诊断为输卵管因素不孕伴或不伴男方因素,且接受IVF/ICSI-ET助孕的患者。排除标准:(1)宫腔异常;(2)有应用促性腺激素的禁忌症;(3)周期资料不完整;(4)甲状腺功能、泌乳素及抗心磷脂抗体等内分泌、免疫功能异常;(5)两侧卵巢功能异常且有手术史(如巧囊、畸胎瘤等)或影像学提示卵巢形态异常;(6)染色体异常;(7)子宫内膜异位症、多囊卵巢综合征、精卵结合障碍及复发性流产患者。
本研究共纳入397例患者。按FORT值(采用传统阈值分组[1,9,15])分为3组:低FORT组(<42%,n=232)、中FORT组(42%~58%,n=117)及高FORT组(>58%,n=48)。同FORT分组方法将患者按MⅡOORT值(<42%,42%~58%,>58%)分为3组:低MⅡOORT组(n=279)、中MⅡOORT 组(n=80)及高MⅡOORT组(n=38)。根据获卵数不同分为3组:低卵巢反应组(<4个,n=17)、中卵巢反应组(4~15个,n=268)及高卵巢反应组(>15个,n=112)。
二、研究方法
1.促排卵方案:于月经第2~3天抽血检测性激素水平,阴道B超监测卵泡大小并记录直径3~8 mm卵泡数(AFC)。再次月经第2~3天注射促性腺激素释放素激动剂(GnRH-a,达必佳,辉凌,德国)3.75 mg或排卵后第7 天皮下注射GnRH-a 0.8~1.875 mg或排卵后第7天开始每天皮下注射GnRH-a 0.05~0.1 mg降调节。若垂体降调到一定程度(血清LH<5 U/L,E2<183.5 pmol/L,内膜厚度<5 mm),开始使用外源性Gn(普丽康,默沙东,美国;或 果纳芬,默克,德国;或丽申宝,珠海丽珠)起始剂量为75~225 U/d,刺激4~5 d后,每日或隔日阴道B超监测卵泡大小及抽血监测激素水平进而调节Gn剂量。当至少3个卵泡直径≥17 mm或2个卵泡直径≥18 mm时,当晚立即肌肉注射HCG(珠海丽珠)5 000~10 000 U(或艾泽250 μg,默克,德国)扳机,并记录直径≥12 mm卵泡数(PFC)。扳机35~37 h后行B超引导下阴道穿刺取卵。取卵后根据患者具体情况行IVF/ICSI。取卵后第3天移植2~3 枚卵裂期胚胎或第5天移植1~2 枚囊胚,移植后予黄体支持(达芙通,雅培生物,荷兰;或雪诺酮,默克,德国;或妇安酮,柯林斯,英国。剂量根据病人情况而定),直至胚胎移植8周后。
2.受精、卵裂观察及妊娠诊断:取卵4~6 h后进行体外受精,16~20 h后观察受精情况。受精64~68 h后由2 位胚胎学专家参照卵裂期胚胎评分标准[12],评估胚胎质量和卵裂情况,进而评估可移植胚胎数及优胚数。移植后14 d抽血检查β-HCG值确定是否阳性(>5 U/L)妊娠,移植后28 d后阴道B超发现孕囊为临床妊娠。
3.观察指标:一般资料及基础性激素及窦卵泡数;COH过程数据(促排卵及实验室培养胚胎相关数据);胚胎移植及妊娠情况数据。临床妊娠率=临床妊娠数/移植周期数×100%,单囊胚移植比例=单囊胚移植数/移植周期数×100%,早期流产率=早期流产数/妊娠周期数×100%,晚期流产率=晚期流产数/妊娠周期数×100%,活产率=活产数/移植周期数×100%。
三、统计学处理
结 果
一、不同FORT组患者的相关资料分析结果
1.三组FORT患者的临床基线资料:3组患者的年龄、BMI、不孕年限及基础性激素水平(bFSH、bE2、bLH)等基线资料整体比较,均无显著性差异(P>0.05);3组患者的AFC随FORT值的升高而减少,且有显著性差异(P<0.05)(表1)。

表1 不同FORT值的3组患者基线资料比较(-±s)
2.三组FORT患者促排结果:3组患者间的Gn总天数、2PN卵裂率、优胚率及卵巢过度刺激综合征(OHSS)发生率等均无显著性差异(P>0.05),PFC随FORT的升高均显著增加(P<0.05);HCG日E2和P水平、获卵数、MII卵子数、优胚数、囊胚数及冷冻胚胎数随FORT的升高而显著增加,低FORT组显著低于其他两组(P<0.05);与高FORT组相比,低FORT组的HCG日LH显著升高,中FORT组的Gn总量显著降低(P<0.05);中FORT组的预防OHSS胚胎冷冻率显著高于低FORT组(P<0.05)(表2)。
3.三组FORT患者的移植情况及妊娠结局:3组患者进行新鲜周期移植的单囊胚移植比例、流产率、临床妊娠率及活产率均无显著性差异(P>0.05)(表3)。
表2 不同FORT值的3组患者的促排结果[(-±s),%]

表3 不同FORT值的3组患者的胚胎移植及妊娠结局比较(%)
二、不同MⅡOORT组患者的相关资料分析
1.三组MⅡOORT患者的临床基线资料:3组患者间的年龄、BMI、不孕年限及基础性激素水平等均无显著性差异(P>0.05);AFC随MⅡOORT的增高而减少,其中低MⅡOORT组的AFC显著高于其他两组(P<0.05)(表4)。

表4 不同MⅡOORT值的3组患者基线资料比较(-±s)
2.三组MⅡOORT患者的促排结果:3组患者间的Gn总量、Gn总天数、OHSS发生率、2PN卵裂率及优胚率等均无显著性差异(P>0.05);获卵数、MⅡ卵数、囊胚数及预防OHSS胚胎冷冻率随MⅡOORT值的升高,均显著增加(P<0.05);HCG日E2和P水平、PFC及冷冻胚胎数随MⅡOORT值的升高而增加,低MⅡOORT组显著低于其他两组(P<0.05),HCG日LH随MⅡOORT值的升高而降低,高MIIOORT组显著低于其他两组(P<0.05)(表5)。
表5 不同MⅡOORT值的3组患者促排情况比较[(-±s),%]
3.各组患者移植及妊娠情况比较:3组患者的流产率、单囊胚移植比例及活产率分别整体比较,无显著性差异(P>0.05);低MIIOORT组的临床妊娠率明显低于其他两组(P<0.05)(表6)。
三、不同卵巢反应各间组比较
卵巢反应不同的3组患者间的年龄无显著性差异(P>0.05);高卵巢反应组的Gn总量显著低于其他两组(P<0.05);3组患者的AFC、FORT、MIIOORT随卵巢反应性的升高而增加,且均有显著性差异(P<0.05)(表7)。
四、临床妊娠率与各影响因素的相关性分析
多种因素与临床妊娠率的相关性进行Logistic回归分析,结果显示移植胚胎数和单囊胚移植数对妊娠率的影响有统计学意义(P<0.05)。年龄、BMI、AFC、Gn总量、获卵数、FORT及MIIOORT与临床妊娠率无明显相关性(P>0.05)(表8)
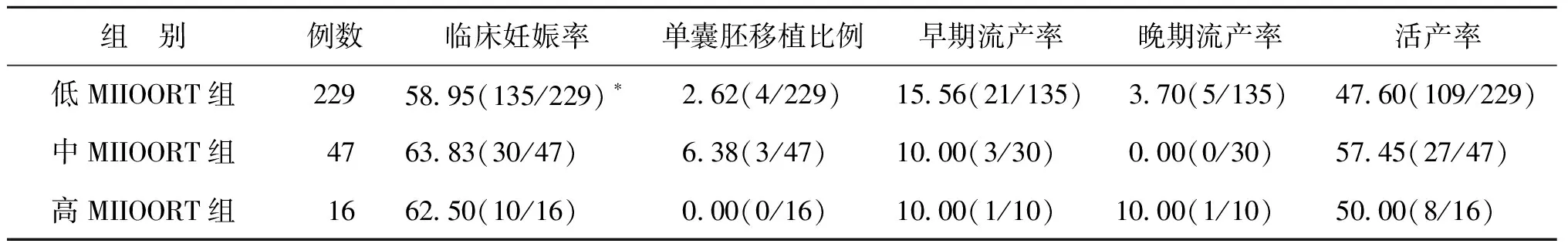
表6 不同MⅡOORT值的3组患者移植情况及妊娠结局比较(%)

表7 不同卵巢反应的3组患者促排情况比较(-±s)

表8 影响不孕患者临床妊娠率因素的logistic回归分析结果
讨 论
随着辅助生殖技术的发展及应用,生殖医师根据不孕症患者的年龄、卵巢储备能力及卵巢反应性等情况制定个体化的助孕治疗方案变的越来越重要[16]。理想的辅助生殖治疗方案可以使不孕症患者在合适的时间里获得更多、更好的可利用卵母细胞及产生理想的妊娠结局,同时能减轻不孕症患者的身体、心理及经济等方面压力。因此,寻找可以客观评估患者的卵巢反应性并能预测妊娠结局的指标,是生殖医学领域的重点研究内容。
一、FORT的价值研究
本研究发现高FORT组AFC最少,但经过Gn治疗后,高FORT组的PFC最高,且与HCG日E2的增长的趋势一致,提示高FORT组的卵巢反应性最好,与王含必等[17]研究结果一致。在注射HCG当天,不孕症患者的PFC及E2随FORT的升高而升高,而LH随之减少,表明提供每个卵泡足够的雌激素并抑制LH早发峰的发生,能获得更多的成熟卵泡。卵泡的成熟度直接影响卵母细胞的质量,成熟卵泡越多,卵母细胞质量越好,进而胚胎质量越好,获得的妊娠率越高[18]。抑制LH早发峰有利于卵巢对Gn的反应及妊娠结局[19-20]。我们的研究表明,随着FORT的增加,获得的卵母细胞数量及优胚数增加,这与邢俊等[13]的研究结果相似。本研究还发现中FORT组的Gn总量显著低于低FORT组(P<0.05),临床妊娠率稍高于低FORT组(63.10% vs.57.06%),但差异无统计学意义(P>0.05),可能与样本量不足有关。不过仍提示中FORT组患者的卵巢对Gn有较好的反应,可获得更好的临床妊娠结果,这一发现与以往研究结果相似[21-22]。本研究中,低FORT组预防OHSS胚胎冷冻率最低,且显著低于中FORT组(P<0.05),随着获卵数增加,预防OHSS而全胚冷冻率也增加,与文献报道的结果类似[22-23]。表明高FORT患者在体外受精周期中具有更好的卵巢储备能力、卵巢反应性及妊娠结局。FORT能被用来预测卵巢反应性和临床妊娠结局,对于卵巢储备能力及卵巢反应性好的患者,生殖医师应提前预防促排卵过程中患者可能发生OHSS。
本研究发现临床妊娠率与移植胚胎数及单囊胚移植数呈正相关,说明移植胚胎数越多,尤其是单囊胚移植,临床妊娠率越高。但移植胚胎数过多易导致多胎妊娠风险。结合不孕症患者的个体情况,本中心一般取卵后第3天移植2~3枚卵裂期胚胎或第5天移植1~2枚囊胚。由于囊胚培养体外培养胚胎的时间更久,进一步淘汰了劣质胚胎,囊胚与子宫内膜更为同步,所以可以获得更高的临床妊娠率。本研究中临床妊娠率与FORT及肥胖无显著关联,与马玲等[12,21]的研究结果不一致,可能与样本量不足有关。
二、MⅡOORT的价值研究
研究MⅡOORT预测卵巢反应性及妊娠结局,能结合COH周期两个关键节点AFC和MⅡ卵数,也能反映出卵巢对外源性FSH的反应及成熟卵母细胞的质量。除获卵数外,卵母细胞的质量和成熟程度也是决定辅助生殖技术成功与否的重要因素[24]。因PFC在临床的测量中存在一定误差且不能明确卵泡中是否含有卵母细胞,更不能确定能否形成受精卵,为更准确预测卵巢反应性及临床妊娠结局,本研究提出了MⅡOORT的概念,希望补充FORT的局限性。
本研究发现高MⅡOORT组具有更高的PFC、获卵数、MⅡ卵数、优胚数、囊胚数及冷冻胚胎数等,而HCG日的LH最低,表明抑制LH早发峰有利于患者的妊娠结局,也验证了MⅡOORT高的患者具有更好的卵巢反应及卵巢储备能力。其发病机制尚不清楚。OHSS通常导致多个卵泡的发育,异常地增加雌激素水平,增加颗粒细胞分泌血管内皮生长因子,从而增加了血管内皮通透性,使血管内液体流出和组织液堆积,导致不孕症患者的组织器官和生理出现一系列严重的病理改变[25]。OHSS是促排卵常见的并发症,低MⅡOORT组的预防OHSS胚胎冷冻率低于其他两组,OHSS发生率最高,但组间差异无统计学意义(P>0.05)。临床上,不孕症患者在胚胎移植前有发生OHSS的倾向或已经出现了OHSS的临床症状时应及时取消周期并建议患者行全胚冷冻。我们的研究表明COH过程中针对卵巢功能及卵巢反应良好的患者,应警惕OHSS的发生,与以往研究结果相似[18],另外本研究中的低MⅡOORT组的临床妊娠率显著低于其他两组(P<0.05)。这些结果表明在输卵管因素伴或不伴男方因素不孕症患者中,通过提前抑制LH早发峰并预防OHSS发生的前提下,高MⅡOORT者有更好的卵巢储备和卵巢反应性,而低MIIOORT者的妊娠结局较差。
三、卵巢反应性与妊娠结局的预测
临床上有效的评估卵巢反应性及预测妊娠结局,可以提高IVF/ICSI-ET的有效性和安全性。目前临床常用的年龄、基础性激素、AMH、AFC等预测卵巢反应性的指标对预测Gn反应性存在一定局限性[4-7]。在预测卵巢反应性及妊娠结局方面,FORT优于其他指标[11]。因本中心在早期病例未检测AMH且选取的研究对象小于38岁,故只能根据获卵数的高低对卵巢反应指标进行研究。本研究中卵巢低反应组患者的年龄与其他组之间没有显著差异(P>0.05),AFC在正常范围内,虽然Gn的使用量最大,但还是出现了卵巢低反应性,即MⅡ卵数显著减少,MIIOORT和FORT都最低,且MIIOORT值明显低于FORT值,提示在低反应人群中MIIOORT较FORT预测卵巢反应性更灵敏。
总之,本研究表明FORT可作为卵巢反应性及妊娠结局的预测指标,而MIIOORT也可作为卵巢反应性及妊娠结局的预测指标,且在低卵巢反应人群中中预测卵巢反应性,MIIOORT较FORT更灵敏。但因本研究样本数较少且为回顾性研究,后续需要增加样本量进一步验证。
