具有α-葡萄糖苷酶抑制活性的益生乳酸菌筛选
2020-11-24陈艳玲陈尚武
曾 珠 陈艳玲 陈尚武
(1.西南大学蚕桑纺织与生物质科学学院, 重庆 400715; 2.农业农村部蚕桑生物学与遗传育种重点实验室, 重庆 400715;3.中国农业大学食品科学与营养工程学院, 北京 100083)
0 引言
Ⅱ型糖尿病(T2DM)是一种发病机制较复杂的慢性代谢紊乱性疾病,以胰岛素抵抗和胰岛细胞损伤导致的慢性高血糖为主要特征[1]。传统的糖尿病药物(如双胍类、磺酰脲类、噻唑烷二酮类等)成本高、副作用大,且治标不治本。因此,寻找新型经济安全的糖尿病药物具有重要意义。
α-葡萄糖苷酶抑制剂是20世纪90年代开发的降糖药物,是目前临床治疗T2DM的一线口服药物。α-葡萄糖苷酶抑制剂主要作用于位于肠系膜刷状缘的α-葡萄糖苷酶,通过抑制α-葡萄糖苷酶分解多糖为葡萄糖的作用,从而减缓葡萄糖的吸收速度和降低血糖水平[2]。常见的α-葡萄糖苷酶抑制剂主要有阿卡波糖(Acarbose)、伏格列波糖(Voglibose)和米格列醇(Miglitol)[3]。阿卡波糖最初是从游动放线菌的次级代谢物中分离而来,因此许多α-葡萄糖苷酶抑制剂的微生物源研究都是从土壤中的放线菌入手[4],目前,已用于临床治疗的α-葡萄糖苷酶抑制剂也主要来源于放线菌(井冈霉素产生菌和野尻霉素产生菌)。
乳酸菌被公认是安全的食品级微生物,广泛应用于发酵食品生产和食品保藏方面,已经有非常悠久的历史[5-6]。乳酸菌中的某些菌株被认为是益生菌,对人体具有多种益生功能[7-11],常见的有乳酸杆菌、双歧杆菌和芽孢杆菌等。由于乳酸菌的天然、安全和益生特性,近年来已成为防治糖尿病的研究热点[12-16]。关于乳酸菌防治糖尿病的研究大多是直接通过动物实验进行验证,具体的调节机理并不清楚,同时也没有初步筛选具有潜在降血糖功能的乳酸菌的方法。抑制α-葡萄糖苷酶的活性是调控糖尿病的主要方法之一,乳酸菌具有的调节血糖的功能有可能通过这种机制发挥作用,因此体外具有α-葡萄糖苷酶抑制活性的乳酸菌将是潜在的辅助抗糖尿病的益生菌株。益生菌对宿主发挥有益作用的前提是能够通过胃肠道的一系列物理和化学障碍到达肠道,并在肠道中定植。因此,一株良好的益生菌必须对模拟的人胃肠道条件具有耐受性,同时要具有较强的黏附肠道上皮细胞的能力。
本文基于对α-葡萄糖苷酶的抑制能力和乳酸菌的基本益生特性,包括对人工模拟胃肠液的耐受性和粘附性的考查,筛选具有潜在降血糖作用的益生菌,以期为开发功能益生菌提供科学依据。
1 材料与方法
1.1 材料与仪器
胃蛋白酶、4-硝基酚-α-D-吡喃葡萄糖苷、Transwell insert小室、碱性磷酸酶试剂盒,美国Sigma公司;Tris(氨基丁三醇)、胰蛋白酶,美国Amresco公司;DMEM(Dulbecco’s modified eagle’s medium)高糖培养基、0.25%胰酶(含0.02% EDTA (乙二胺四乙酸))、双抗(青、链霉素),美国Gibco公司;胎牛血清,杭州四季青公司;细胞培养瓶、96孔酶标板,美国Corning公司;SYBR Green 荧光定量试剂盒,北京Tiangen公司。
TP-2102型电子天平,美国DENVER仪器公司;FA2004B型分析天平,上海越平科学仪器有限公司;90-2型恒温磁力搅拌器,上海振荣科学仪器有限公司;UB-7型 pH计,美国DENVER仪器公司;YX-280D手提式压力蒸汽灭菌器,合肥华泰医疗设备有限公司;酶标仪,美国Thermo Electron公司;SClENTZ-IID型超声破碎仪,宁波新芝生物科技公司;MCO-15AC型二氧化碳培养箱,日本三洋电机株式会社;倒置生物显微镜,北京奥特伟业光学仪器有限公司;LightCycler 96型实时荧光定量PCR(聚合酶链式反应)仪,罗氏诊断产品上海有限公司。
1.2 实验方法
1.2.1猪小肠α-葡萄糖苷酶的提取
新鲜的猪小肠粘膜用磷酸盐缓冲液(PBS,pH值6.8)冲洗干净,然后用载玻片刮取小肠粘膜加入等体积的PBS(pH值6.8)进行低温研磨。研磨充分的混合液在4℃下12 000 r/min离心20 min,收集上清液冻存于-80℃,使用时用PBS(pH值6.8)稀释10倍使用。
1.2.2乳酸菌分泌上清的制备
本实验采用的乳酸菌为实验室前期分离保存的乳酸菌菌株,其中鼠李糖乳杆菌LactobacillusrhamnosusGG(LGG)作为参考菌株。将菌株活化后,12 000 r/min室温(20℃)下离心15 min,PBS(pH值6.8)洗涤3遍。然后用PBS(pH值6.8)将菌体浓度调整为5×1010CFU/mL,37℃孵育6 h(预实验表明在6 h时α-葡萄糖苷酶抑制活性最高),孵育完成后进行离心(12 000 r/min,15 min),取上清液冻存于-80℃待用。
1.2.3乳酸菌α-葡萄糖苷酶抑制活性的测定
参照文献[13]测定α-葡萄糖苷酶抑制活性,反应体系为100 μL。首先将25 μL的底物4-硝基酚-α-D-吡喃葡萄糖苷(PNPG,10 mmol/L)和25 μL的样品混匀后37℃孵育10 min,然后加入50 μL α-葡萄糖苷酶混匀后于37℃反应30 min。随后迅速加入100 μL Na2CO3(0.1 mol/L)终止反应,用酶标仪测定405 nm处的吸光度。每组实验设置3个平行。其中,样品的吸光度用样品空白对照(体系中用50 μL PBS(pH值6.8)代替α-葡萄糖苷酶)的吸光度进行校准。阴性对照(体系中无抑制α-葡萄糖苷酶的样品)用25 μL PBS(pH值6.8)代替样品,阴性空白对照(体系中没有α-葡萄糖苷酶活性)用25 μL PBS(pH值6.8)代替样品,50 μL PBS(pH值6.8)代替α-葡萄糖苷酶。α-葡萄糖苷酶抑制率计算公式为
式中A——样品在405 nm处的吸光度
B——样品空白对照在405 nm处的吸光度
C——阴性对照在405 nm处的吸光度
D——阴性空白对照在405 nm处的吸光度
1.2.4乳酸菌在人工模拟胃肠液中的存活率
方法参照文献[13]。首先是模拟胃肠液的配置。模拟胃液(Gj)的配置方法:将胃蛋白酶用pH值2.5 的PBS 溶解,使其终质量浓度为3 g/L。模拟十二指肠液(Dj)的配置方法:将胆盐和胰蛋白酶用pH值 5.0的PBS溶解,使其终质量浓度分别为3 g/L和1 g/L。模拟肠液(Ij)的配置方法:将胰蛋白酶用pH值8.0的PBS溶解,使其终质量浓度为1 g/L。所有配好的胃肠液经过0.22 μm的滤膜过滤。将活化第2代的乳酸菌于MRS培养基中37℃静止培养18 h,离心收集菌体并用PBS(pH值7.4)洗涤2遍,重悬于同样体积的模拟Gj(pH值2.5)中,37℃静止培养3 h,然后取出1 mL菌液置于9 mL的模拟Dj(pH值5.0)中,37℃静止培养2 h。最后从模拟Dj中取出1 mL菌液置于模拟Ij (pH值8.0)中37℃静止培养8 h。分别于0、2、3、8 h取样进行梯度稀释,于MRS固体培养基中37℃培养48 h计数。乳酸菌在人工模拟胃肠液中存活率计算公式为
式中a——在模拟胃肠液中孵育特定时间后的活菌数
b——每次孵育前乳酸菌总的活菌数
1.2.5乳酸菌对HT-29细胞的黏附性分析
黏附方法参照文献[13]。HT-29细胞(15~20代)用DMEM培养基(含有体积分数10%胎牛血清和1%双抗)于37℃含有5% CO2的培养箱中进行培养。待细胞增殖至90%融合时,用0.25%的胰酶消化后传代。
对于黏附实验,将胰酶消化后的细胞按照105个/孔接种于24孔板中,于37℃培养24 h,然后用PBS(pH值7.4)洗涤2遍。与此同时,将静置培养12 h的乳酸菌6 000 r/min常温离心5 min,并用PBS(pH 值7.4)洗涤2遍,重悬于不含血清和双抗的DMEM培养基中,调整其菌体浓度为109CFU/mL,然后取1 mL菌悬液加入准备好的HT-29细胞中,于37℃细胞培养箱中孵育2 h。孵育完成后,用PBS(pH值7.4)洗涤细胞6遍去掉未黏附的乳酸菌。单层细胞用甲醇固定后进行革兰氏染色。每个样品随机选20个视野计算细胞和乳酸菌数,以平均每个细胞上黏附的乳酸菌数目来评价乳酸菌对肠上皮细胞的黏附能力。
1.2.6乳酸菌在不同生长阶段的α-葡萄糖苷酶抑制活性
将菌株活化2代后按体积分数1%接种到300 mL MRS培养基中,于37℃恒温培养箱中静置培养。每隔2 h测菌株的600 nm处吸光度及pH值,并取出10 mL菌悬液12 000 r/min常温离心15 min,收集菌体,PBS(pH值6.8)洗涤3遍,重悬于200 μL PBS(pH值6.8)中,于37℃继续培养6 h。培养后进行离心,取上清液冻存于-80℃用于测定α-葡萄糖苷酶抑制活性。
1.2.7Transwell细胞模型的建立及评估
Caco-2细胞(10~20代)培养在含10%胎牛血清、1%双抗和1%非必需氨基酸的DMEM培养基中。当细胞贴壁融合率约为80%时,用0.25%的胰酶消化细胞以后,按照密度105个/cm2接种于6孔板的Transwell小室中(膜孔径0.4 μm,直径24 mm,底面积4.67 cm2)。肠腔侧加入1 mL细胞悬液,基底侧加入3 mL细胞培养基,第1~7天隔天换液,从第8天开始每天换液,直到细胞形成单层致密的细胞膜。
Transwell细胞模型的评估:检测细胞的跨膜电阻值,待跨膜电阻达到最大,用试剂盒检测细胞的碱性磷酸酶(AKP)极性,肠腔测得的AKP活性应显著高于基底侧[17]。
1.2.8乳酸菌对Caco-2细胞中α-葡萄糖苷酶的影响
将已培养好的Transwell小室用PBS洗涤3次,去除葡萄糖。加入800 μL含20 mmol/L的麦芽糖作为底物,并加入乳酸杆菌的上清200 μL(共1 mL)到小室的上层,下层加入3 mL PBS,于37℃培养2 h,从上层取10 μL溶液到微孔板中检测葡萄糖含量,以此计算对α-葡萄糖苷酶活性的抑制率,并用试剂盒提取Caco-2的总RNA,反转录成cDNA,然后进行实时荧光定量PCR。用Primer Premier 5软件设计引物,α-葡萄糖苷酶基因扩增引物为:上游引物5′ CGACGGAGAAGCAGTGGAAG 3′;下游引物5′ GGGTTGGTCTCTTGTGAACATTC 3′。β-actin(β肌动蛋白)内参引物:上游引物5′ TGACGTGGACATCCGCAAAG3′;下游引物5′ CTGGAAGGTGGACAGCGAGG3′。采用ΔΔCT法计算基因的表达量[18],每个样品设定3个平行。
1.3 数据处理
所有实验进行3次重复,结果由平均值±标准差表示,用SPSS 20软件分析数据,成对比较采用Student’sT检验进行分析,多组比较采用One-Way ANOVA中Duncan’s多重检验来分析,P<0.05表示有统计学意义。
2 结果与分析
2.1 菌株
所选用的10株乳酸菌(表1)均分离于传统发酵食品,包括新鲜牛乳、奶酪(奶疙瘩)和泡菜。这10株菌中,有5株属于副干酪乳杆菌属,2株属于植物乳杆菌属,3株属于发酵乳杆菌属。乳酸菌中研究最广泛的益生菌株鼠李糖乳杆菌LGG作为参考菌株。
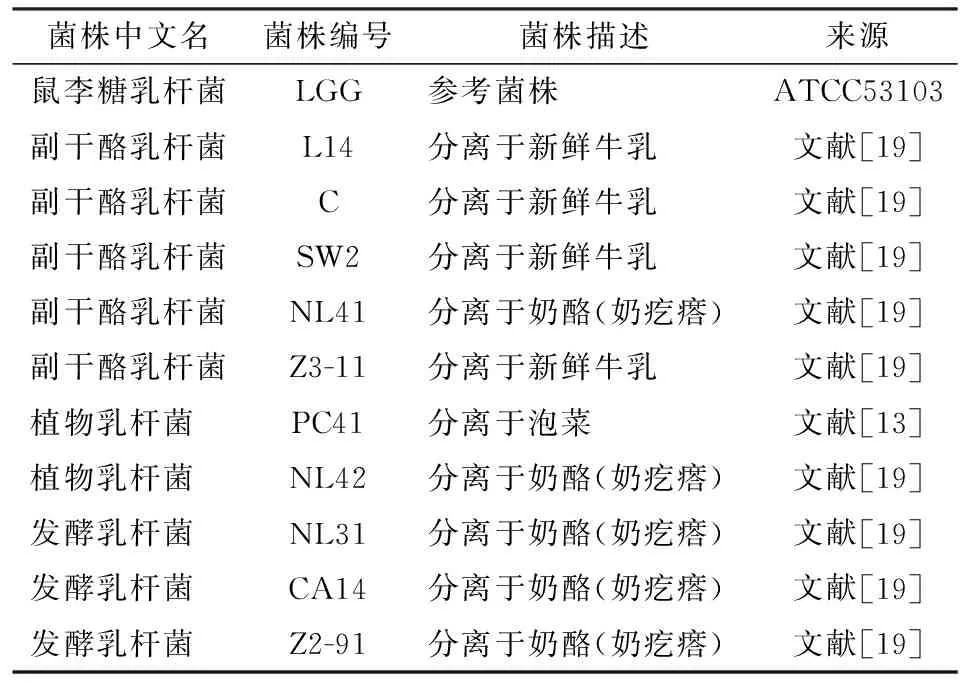
表1 乳酸菌菌株及来源Tab.1 Lactic acid bacteria strains and their sources
2.2 乳酸菌对猪小肠提取的α-葡萄糖苷酶的抑制活性
所有选用菌株的分泌上清均具有α-葡萄糖苷酶抑制活性,抑制率在6%~31%不等,其中副干酪乳杆菌L14的抑制活性最高,为31%,其次是副干酪乳杆菌Z3-11(28%)、植物乳杆菌NL42(27%)和发酵乳杆菌Z2-91(27%),这4株菌的抑制率与参考菌株鼠李糖乳杆菌LGG(28%)相比无显著性差异。已有部分研究报道乳酸菌的发酵上清具有α-葡萄糖苷酶抑制活性[13,20],与本研究结果保持一致。
α-葡萄糖苷酶抑制活性很大程度上受到α-葡萄糖苷酶来源的影响,最常见的来源是哺乳动物和微生物酵母[21-23]。例如,酸奶对来源于哺乳动物的α-葡萄糖苷酶不具有抑制活性但却能抑制来源于酵母的α-葡萄糖苷酶[22];合成的阿卡波糖对来源于酵母的α-葡萄糖苷酶几乎没有抑制活性,却对来源于哺乳动物的α-葡萄糖苷具有很强的抑制活性。这些抑制活性的差别可能归因于不同来源的酶结构不同所导致的抑制剂的结合位点不同[22,24]。因此,本研究中,为了探究与人类健康密切相关的乳酸菌的α-葡萄糖苷酶抑制活性,选取的是来源于哺乳动物的α-葡萄糖苷酶。
2.3 乳酸菌对人工模拟胃肠液的耐受能力
益生菌发挥对人体的有益作用的前提是必须活着通过人体胃肠道环境。因此,进一步研究所选用菌株对人工模拟胃肠液的耐受性。首先,胃液的极低pH值(2.5~3.5)是阻止细菌进入人体肠道的天然屏障,而食物一般需要在胃中停留2~4 h进行消化[25]。由表2可知,LGG、Z3-11和CA14具有较强的抵抗低pH值的能力,在pH值2.5的模拟胃液中存活率超过80%,但是4株菌株(C、SW2、NL31和Z2-91)在模拟胃液中的存活率很低,在同样稀释度的情况下未检测到活菌,说明乳酸菌对人工模拟胃液的耐受性具有菌株差异性。有研究表明菌株的耐酸能力依赖于其H+-ATP酶的活性[26],所以本文中不同菌株的耐酸能力不同可能与它们的H+-ATP 酶的活性有关。

表2 乳酸菌在人工模拟胃肠液中的存活率Tab.2 Tolerance of lactic acid bacteria strains to simulated gastrointestinal conditions %
在模拟十二指肠液中,PC41具有最高的存活率,为84.9%。其次是L14、NL41和NL42,存活率超过60%。胆盐可通过破坏细胞膜的完整性对活细胞造成巨大的损害[27],因此对十二指肠液耐受性高可能是因为菌株对胆盐耐受能力好[27-28]。
在模拟肠液中培养8 h后,菌株的存活率得以提高,Z3-11的存活率最高,为98.5%。在模拟肠液中菌株存活率增加可能是因为肠液的pH值升高和排除了胆盐的胁迫。
2.4 乳酸菌对肠上皮细胞的黏附能力
乳酸菌黏附肠上皮细胞的能力是长期以来用于筛选益生菌的一个非常重要的指标,因为乳酸菌只有黏附于宿主的肠上皮细胞才能够促进其长期定植,发挥免疫功能以及抑制腐败菌的生长[29-30]。HT-29为人结直肠腺癌细胞,是体外检测微生物黏附性常用的一种细胞系。除Z3-11、CA14和Z2-91外,所有被检测菌株黏附肠上皮细胞HT-29的能力均显著高于参考菌株LGG。PC41具有非常强的黏附肠上皮细胞的能力,每个细胞黏附的菌数约为148,其次是SW2、NL42和L14,每个细胞黏附的菌数分别为80、49和37。细菌对肠上皮细胞的黏附能力通常是由细菌表面的成分所介导,包括黏附蛋白、胞外多糖、脂磷壁酸、S层蛋白以及胞外的一些附属物(如菌毛和鞭毛等)[31]。例如,研究发现细胞表面的黏附蛋白SpaCBA、MBF、MabA和SpaFED是介导益生菌L.rhamnosusGG参与黏附肠上皮细胞的主要因子[32-35]。胞外多糖和2个黏附蛋白N506_1778、N506_1709是参与益生菌L.gasseriDSM 14869黏附阴道上皮细胞的主要因子[36]。本研究中黏附能力较强的菌株PC41、SW2、NL42和L14没有菌毛或鞭毛,因此,可能是它们表面的一些黏附因子(如胞外多糖、黏附蛋白)参与对上皮细胞的黏附。下一步可通过对它们进行基因组测序及生物信息学分析深入探讨黏附的分子机理。
结合这10株乳酸菌对猪小肠提取的α-葡萄糖苷酶的抑制能力、人工模拟胃肠液的耐受性及对肠上皮细胞的粘附性,菌株L14、Z3-11和NL42的α-葡萄糖苷酶抑制活性较为突出,且更有可能活着通过肠道并在肠道中定植,可作为潜在的辅助调节糖尿病的益生菌株,因此选择这3株菌作进一步的研究。
2.5 乳酸菌在不同生长阶段的α-葡萄糖苷酶抑制活性
以α-葡萄糖苷酶抑制活性较高且具有较好的益生特性的3株菌(副干酪乳杆菌L14和Z3-11及植物乳杆菌NL42)为例来研究乳酸菌在不同生长阶段分泌上清的α-葡萄糖苷酶抑制率。图1是L14、Z3-11和NL42在生长过程中的600 nm处OD值和α-葡萄糖苷酶抑制率的变化。菌株L14的对数生长期是2~10 h,600 nm处OD值由0.2升到2.2,其分泌上清的α-葡萄糖苷酶抑制率随着时间的变化呈现先上升后下降的趋势,在稳定期(12 h时)达到最大,在接下来的12 h,细胞600 nm处OD值略有降低,α-葡萄糖苷酶抑制率逐渐降低。菌株Z3-11和NL42的生长模式及α-葡萄糖苷酶抑制率的变化趋势与L14几乎相同,其分泌上清的α-葡萄糖苷酶抑制率也呈现先上升后下降的趋势,在稳定期(12 h时)或对数末期(6 h时)达到最大。乳酸菌分泌上清的α-葡萄糖苷酶抑制率呈现先上升后下降的趋势,可能是因为在前期菌体浓度较低导致具有抑制α-葡萄糖苷酶活性的功能成分浓度也较低;随着菌株的生长,菌体浓度逐渐升高,其分泌的功能活性成分浓度也增加,因此α-葡萄糖苷酶抑制活性也逐渐增加;随着培养时间的进一步延长,微生物细胞逐渐老化并出现自溶现象,因此具有α-葡萄糖苷酶抑制活性的成分可能会被菌体裂解产生的酶破坏,加上乳酸菌本身代谢产酸,导致生长后期培养液的pH值极低,而功能活性成分可能在极低pH值中不稳定,因此出现抑制活性下降的趋势。

图1 乳酸菌在不同生长阶段的α-葡萄糖苷酶抑制活性Fig.1 α-glucosidase inhibition during growth of Lactobacillus strains
2.6 乳酸菌对Caco-2细胞中α-葡萄糖苷酶的抑制作用
Caco-2细胞为人的结直肠腺癌细胞,在Transwell小室中,经过标准条件培养能分化出与人体内小肠上皮细胞类似的结构,包括基底层(相当于肠内壁一侧)和细胞绒毛层(相当于肠腔一侧),并且可以合成各种酶类,如α-葡萄糖苷酶。该细胞模型目前已广泛用于研究生化、毒理及药物吸收和跨膜转运。上文发现乳酸菌的分泌上清对猪小肠提取的α-葡萄糖苷酶具有抑制活性,因此需进一步研究乳酸菌是否对来源于人肠道的Caco-2细胞系的α-葡萄糖苷酶活性也具有抑制作用,同时研究乳酸菌对α-葡萄糖苷酶基因表达量的影响。
2.6.1Transwell细胞模型建立
将Caco-2细胞接种到6孔板的Transwell小室中,培养至细胞形成单层致密的细胞膜。在细胞培养的过程中,分别检测细胞跨膜电阻及碱性磷酸酶(AKP)的极性。
如图2所示,在培养期间,细胞的跨膜电阻(TEER值)逐渐增加,从第18天开始已达到最大且基本保持稳定。TEER值是反映细胞单层完整性的重要指标,其与细胞紧密连接的程度有直接关系,随着培养时间的增加,细胞的紧密连接逐渐完善,因此TEER值也逐渐增加,TEER值越大,表明细胞单层越致密越完整[37]。本研究中培养18 d后细胞TEER值达到稳定,说明Caco-2细胞已形成了完整的单层细胞膜。
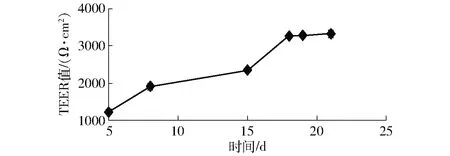
图2 Caco-2细胞培养期间细胞跨膜电阻TEER值的变化曲线Fig.2 TEER values of Caco-2 cell monolayer during process of growth
AKP极性检测结果见图3,在培养过程中,基底侧AKP活性几乎无变化,肠腔侧AKP活性则逐渐增加,在第21天时, 细胞单层肠腔侧的AKP活性显著高于基底侧,约高出2.34倍,表明细胞单层已经形成了极性,标志酶AKP已大部分集中在刷状缘侧。
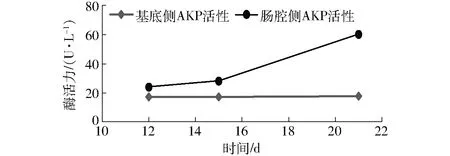
图3 Caco-2单层细胞肠腔侧(AP)和基底侧(BL)的碱性磷酸酶活性(n=3)Fig.3 Alkaline phosphatase activity of Caco-2 monolayer sides of AP and BL (n=3)
综合跨膜电阻值和碱性磷酸酶AKP活性,Caco-2细胞在Transwell小室中培养21 d时已生长和分化成类似于肠上皮细胞的单层细胞,并且具有上皮细胞的极化特征。
2.6.2乳杆菌对Caco-2细胞中α-葡萄糖苷酶的影响
乳杆菌L14、Z3-11和NL42的分泌上清对Caco-2细胞中α-葡萄糖苷酶的酶活性均具有抑制作用,其中L14的抑制率最高,为28%,显著高于Z3-11(22%)和NL42(19%),菌株Z3-11和NL42的抑制率没有显著性差异。3株菌均可显著抑制Caco-2细胞中α-葡萄糖苷酶的mRNA表达量,抑制率分别为58%、21%和38%,表明乳酸菌对α-葡萄糖苷酶的抑制作用是通过抑制α-葡萄糖苷酶的活性及酶的表达量发挥双重作用,从而有效减缓碳水化合物的分解速度,减少单糖的生成。文献[38]报道两歧双歧杆菌F-35对Caco-2细胞中α-葡萄糖苷酶的活性及mRNA表达水平都具有抑制作用,本研究结果与其保持一致。
大部分的α-葡萄糖苷酶抑制剂是糖类或糖的衍生物,通过竞争性抑制α-葡萄糖苷酶的活性,降低多糖分解成葡萄糖的速率,使糖的吸收相应减缓,起到降低血糖的作用。也有少部分非糖类化合物被报道对α-葡萄糖苷酶活性具有抑制作用,如文献[39]报道非糖类化合物如磺胺类药可通过疏水作用直接结合在酶的活性位点上进而发挥抑制作用,另外文献[23,40]发现乳蛋白或鸡蛋蛋白水解产生的多肽也具有较强的α-葡萄糖苷酶抑制活性。关于乳酸菌的α-葡萄糖苷酶抑制活性成分的研究,目前还没有明确的结果,文献[41]报道用产胞外多糖的菌株发酵的酸奶具有更强的α-葡萄糖苷酶抑制活性,推测这种抑制活性可能是由菌株产生的胞外多糖引起的,但是没有进一步纯化出胞外多糖进行验证,因此有关乳酸菌上清液中酶抑制剂的活性成分、抑制机理及影响因素,尚需进一步的研究。
3 结束语
本文将分离于传统乳制品的10株乳杆菌进行了α-葡萄糖苷酶抑制活性的测定,并研究了乳酸菌的基本益生特性,包括耐酸、耐胆盐和对肠上皮细胞的黏附性。结果表明,这10株菌对猪小肠提取的α-葡萄糖苷酶均具有抑制作用,结合乳酸菌的基本益生特性,最终筛选出了3株具有较高α-葡萄糖苷酶抑制活性和优良益生特性的菌株,分别是副干酪乳杆菌L14、Z3-11和植物乳杆菌NL42;这3株菌在Caco-2细胞建立的Transwell模型中也能对α-葡萄糖苷酶发挥抑制活性。本文筛选出的3株乳杆菌可作为潜在的辅助降血糖的益生菌株,为功能益生菌的开发奠定了基础。
