苹果酸-乳酸发酵对美乐低醇桃红葡萄酒香气的影响
2020-11-24赵丹丹韩舜愈杨学山
祝 霞 王 诗 赵丹丹 韩舜愈 杨学山
(1.甘肃农业大学食品科学与工程学院, 兰州 730070; 2.甘肃省葡萄与葡萄酒工程学重点实验室, 兰州 730070)
0 引言
酒精度小于7%vol的低醇葡萄酒具有干型葡萄酒颜色、香气、营养成分等基本性状,而且可有效避免酒精对人体的伤害[1-2]。相对成熟的低醇葡萄酒生产工艺主要包括减少可发酵糖[3]、脱醇[4]以及特种微生物发酵[5]等,这些工艺在降低酒精度的同时,不可避免地造成了葡萄酒香气风味损失,有时甚至还会产生异味[6-7]。文献[8-9]的研究表明,采用产酒精能力较弱的非酿酒酵母与酿酒酵母菌株混菌发酵能明显提升贵人香、美乐低醇葡萄酒的香气品质,在赋予酒体强烈花香、果香的同时,增强了香气的复杂性和层次感。但混菌发酵生产低醇葡萄酒也存在酒体残糖和L-苹果酸含量较高、容易引起二次发酵等问题,限制了其规模化生产。
苹果酸-乳酸发酵(Malolactic fermentation,MLF)是在酒酒球菌(Oenococcusoeni,O.oeni)的主导下,利用苹果酸-乳酸酶将酒体中酸涩感较强、易被微生物利用的L-苹果酸降解为柔顺、稳定的L-乳酸,在提高生物稳定性、降低酸度的同时,进一步改善了口感,突出果香、增加了复杂性[10-13]。文献[14]研究表明, MLF不仅使酒样中的高级醇、高级酯、萜烯等化合物的种类和含量均有增加,而且口感更柔和,提升了复杂性和层次感。文献[15-16]研究显示,MLF后酒体的总酸度和柠檬酸含量降低,pH值和乳酸含量增加,橙花醇、乙酸异戊酯、辛酸乙酯含量分别升高75%、75%、100%。文献[17]将酿酒酵母与O.oeni同时接种进行发酵,发酵后酒样中的挥发酸含量降低,水果香气、黄油和奶油香气突出,酒样香气浓郁、复杂。文献[18]对樱桃酒同时进行酒精发酵和苹果酸-乳酸发酵,酒样颜色红艳,入口柔顺,酒体圆润,果香味馥郁协调。文献[19-20]采用乳酸菌与酵母菌对低醇苹果酒、梨酒进行混合发酵,发现低醇酒的总酸、总糖含量分别下降了约27.51%、36.06%,柔和指数明显升高。目前,MLF对低醇葡萄酒理化和香气品质的影响研究很少。本文以模拟葡萄汁发酵筛选产香性能较好的本土O.oeni和商业酵母菌发酵接种方式为基础,采用甘肃省河西走廊产区的酿酒葡萄主栽品种美乐为原料,通过微酿试验探究MLF对低醇葡萄酒品质的影响,以期为生产代表产区风土特色的高品质低醇葡萄酒提供技术支持。
1 材料与方法
1.1 材料与试剂
酿酒葡萄:美乐,2019年采摘于甘肃武威莫高葡萄酒业有限公司葡萄种植基地,葡萄浆果糖度(以葡萄糖计)为194.75 g/L,总酸质量浓度(以酒石酸计)为6.56 g/L。
商业酿酒酵母ES488(意大利Enartis公司);商业非酿酒酵母MP346(Mstschnikowiapulcherrima346)(法国Lallemand公司);本土酒酒球菌菌株ZX-1,由甘肃省葡萄与葡萄酒工程学重点实验室分离鉴定并保存。
香茅醇、香叶醇、芳樟醇、异戊醇、苯乙醇、乙酸异戊酯、乙酸己酯等香气化合物和内标物 2-辛醇标准品(美国 Sigma 公司);无水葡萄糖、纤维二糖、磷酸氢二铵、酒石酸氢钾、L-苹果酸、柠檬酸、磷酸氢二钾、硫酸镁、偏重亚硫酸钠、酵母浸粉、氢氧化钠等试剂均为国产分析纯(天津市光复精细化工研究所);L-苹果酸检测试剂盒(爱尔兰Megazyme公司)。
1.2 仪器与设备
LRH-150型生化培养箱(上海一恒科学仪器有限公司);722N型可见分光光度计(上海仪电分析仪器有限公司);pHS-3C型pH计(上海雷磁责任有限公司);LDZX型立式压力蒸汽灭菌器(上海申安医疗器械厂);TRACE 1310-ISQ型气相色谱-质谱联用仪、ISQ型单四级杆质谱仪(美国Thermo Scientific公司);50/30 μm DVB/CAR-PDMS型萃取头(上海安谱科学仪器有限公司)。
1.3 方法
1.3.1模拟葡萄汁配制
模拟汁配方[21]:葡萄糖200 g/L、纤维二糖0.2 g/L、磷酸氢二铵1.5 g/L、磷酸氢二钾1.14 g/L、硫酸镁1.23 g/L、酒石酸氢钾2.5 g/L、L-苹果酸3.0 g/L、柠檬酸0.2 g/L、酵母浸粉1.0 g/L。
1.3.2菌株活化
(1)本土O.oeni菌株
将冷冻保存在斜面上的O.oeni菌株于28℃培养箱活化2 h后,用接种环挑取2环至灭菌后的ATB培养基中,于28℃厌氧培养至对数生长期(600 nm处吸光度约1.2),备用。
ATB培养基[17]:葡萄糖10 g/L,蛋白胨10 g/L,酵母浸粉5 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.05 g/L,盐酸半胱氨酸0.5 g/L,番茄汁体积分数25%,121℃灭菌20 min。
(2)非酿酒酵母菌株
称取非酿酒酵母活性干粉,溶于10倍体积的无菌水中,放置在28℃恒温水浴锅中活化15 min,再加入等体积的葡萄汁,于25℃下活化15 min。
(3)酿酒酵母菌株
将称取的酿酒酵母干粉用10倍体积的无菌水溶解,置于28℃下恒温水浴活化10 min后,加入等体积的葡萄汁,在25℃水浴锅中活化10 min。
1.3.3接种方式
本试验在文献[8-9]混菌发酵低醇葡萄酒所采用接种方式的基础上,为消除酿酒葡萄原料自身香气对试验结果的干扰,以模拟葡萄汁为基质,设计5个处理组对接种方式进行评价筛选。其中,ZX-1菌株接种时按照接种量,取100 mL二次扩培菌液,3 000 r/min离心10 min后弃去上清夜,将沉淀用等体积模拟葡萄汁洗入发酵瓶中。
A组:MP346菌粉与ZX-1同时接种;B组:先接种MP346,当L-苹果酸降至0.30 g/L以下时,再接种ES488菌粉;C组:MP346与ZX-1同时接种,发酵至酒精度为3.5%vol时,接种ES488;D组:先接种ZX-1,当L-苹果酸降到0.30 g/L以下时,接种MP346,发酵至酒精度为3.5%vol时接种ES488;E组(对照组):先接种MP346,发酵至酒精度为3.5%vol,接种ES488。处理组中ZX-1菌株接种量体积分数为5%,MP346菌粉、ES488菌粉分别按照推荐用量0.25、0.20 g/L接种。各处理组均发酵至酒精度为6.5%vol时,终止发酵,取样检测。
1.3.4混菌发酵接种工艺优化
根据1.3.3节的研究结果,选择最佳的接种方式,参照文献[9]酿造美乐低醇桃红葡萄酒的工艺流程,进行混菌发酵接种量的优化。
混菌发酵低醇桃红葡萄酒工艺流程:美乐葡萄→除梗破碎,带皮渣浸渍(4℃,48 h;添加30 mg/L SO2、20 mg/L果胶酶)→过滤除皮渣→接种酵母与O.oeni菌株,发酵至酒精度为6.5%vol→恒温静置→取澄清液进行错流过滤→灌装。
1.3.5单因素试验
(1)O.oeni接种量
将60 L浸渍后过滤除皮渣的美乐葡萄汁分装入15个5 L玻璃发酵瓶中,分别按接种量3%、4%、5%、6%、7%接入ZX-1菌株,同时接入MP346(0.25 g/L),20℃恒温发酵至酒精度为3.5%vol,再接入ES488(0.20 g/L),发酵至酒精度为6.5%vol时终止发酵。取样测定总酸含量、单宁含量、酒精度、挥发酸含量。每个酒样重复3次,下同。
(2)非酿酒酵母接种量
将浸渍后过滤除皮渣的美乐葡萄汁等份分装,分别以接种量0.15、0.20、0.25、0.30、0.35 g/L接入MP346,同时接入5%的ZX-1,20℃发酵至酒精度为3.5%vol,再接入ES488(0.20 g/L),酒精度为6.5%vol时终止发酵。发酵结束后取样测定总酸含量、单宁含量、酒精度、挥发酸含量。
(3)酿酒酵母接种量
分别向分装于发酵瓶的葡萄汁中,同时接种0.25 g/L的MP346和5%的ZX-1,20℃恒温发酵至酒精度为3.5%vol,再分别按接菌量0.10、0.15、0.20、0.25、0.30 g/L接种ES488,发酵结束后(酒精度为6.5%vol)分别取样测定总酸含量、单宁含量、酒精度、挥发酸含量。
1.3.6正交试验
根据单因素试验结果,选择O.oeni接种量(即ZX-1接种量)、非酿酒酵母接种量(即MP346接种量)和酿酒酵母接种量(即ES488接种量)进行三因素三水平正交试验,以发酵结束后酒样柔和指数作为评价指标,试验因素水平见表1。重复测定3次。
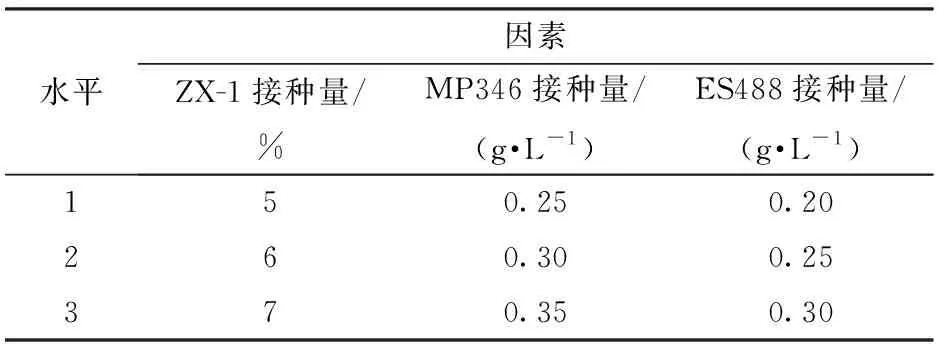
表1 试验因素水平Tab.1 Factors and levels of design
1.3.7微酿试验
参照1.3.4节的发酵工艺,采用正交试验优化结果进行微酿试验。发酵至酒精度为6.5%vol时,分别将酒样澄清液进行错流过滤,灌装即得低醇葡萄酒。取成品酒样测定相关指标。
1.3.8葡萄酒理化指标测定
还原糖含量、总酸含量、挥发酸含量、酒精度、pH值、总酚含量、单宁含量、总硫含量、游离硫含量的测定均参照文献[22]中的方法进行。L-苹果酸含量的测定按照试剂盒说明书方法进行。柔和指数测定参照文献[23]。试验均重复3次,结果以平均值±标准偏差表示。
柔和指数计算公式为
S=A-(T+C)
(1)
式中S——酒样柔和指数
A——酒精度,%vol
T——单宁质量浓度,g/L
C——总酸质量浓度,g/L
1.3.9挥发性香气化合物的测定
参照文献[24]的方法,利用固相微萃取结合气相色谱-质谱技术(Solid phase microextraction combined with gas chromatography mass spectrometry,SPME-GC-MS)对样品中的挥发性香气化合物进行定性定量分析检测,其中SPME主要用于香气成分的萃取,GC-MS用于香气物质的定性定量分析。采用保留指数(Retention index,RI)和 NIST-11、Wiley数据库及香精香料谱库检索比对进行定性分析;对已有标准品的化合物,利用标准曲线(R2>0.995)定量,无标准品的化合物采用化学结构和官能团相似、碳原子数相近的标准物质进行半定量。
1.4 感官评价
参照GB/T 15038—2006及文献[9]的方法,并略作修改。各酒样随机编号后,分别从外观、香气和口感方面(表2)进行3轮盲品。使用10分结构化数值尺度来量化,0~10分表示感觉强烈程度逐渐增大。

表2 美乐低醇桃红葡萄酒感官评价标准Tab.2 Sensory evaluation criteria for Merlot low alcohol rose wine
1.5 数据处理
利用Microsoft Excel 2016对试验所得数据进行分析和制图,使用IBM SPSS Statistics 19.0进行主成分分析及多重比较(Duncan法,P<0.05),试验结果均以平均值±标准偏差表示。
2 结果与分析
2.1 模拟汁发酵酒样理化指标分析
表3为采用不同接种方式发酵处理组的酒样理化指标。由表可知,各理化指标均符合国标GB/T 15038—2006要求。5组酒样酒精度无显著性差异,A、B、C、D 4个处理组的还原糖、总酸、L-苹果酸含量显著低于E组(对照组)(P<0.05),pH值、挥发酸含量显著高于E组(对照组)(P<0.05),这说明MLF不仅能够转化性质活泼、能够被细菌利用的L-苹果酸,而且会消耗酒样中的部分还原糖,降低二次发酵的风险。
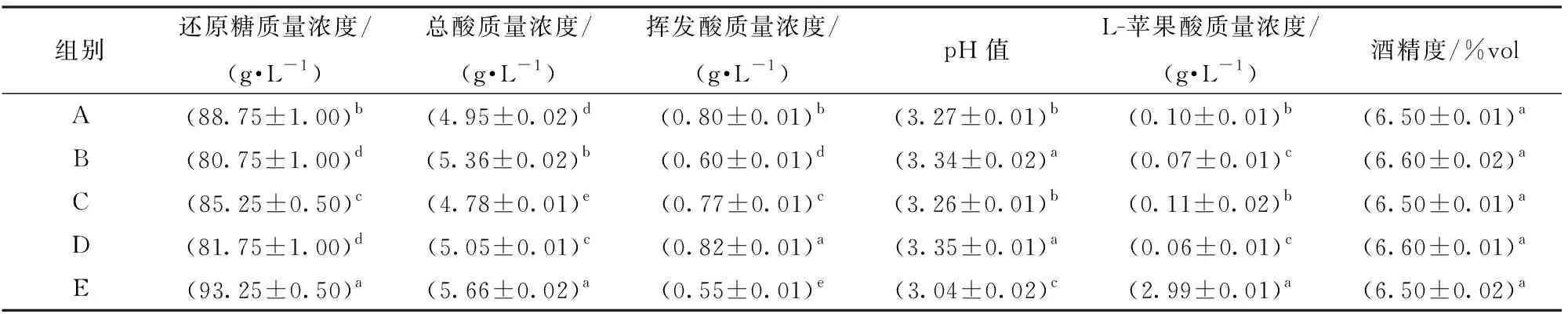
表3 不同接种方式发酵酒样基本理化指标Tab.3 Basic physical and chemical indexes of wine samples fermented with different inoculation methods
2.2 不同接种方式对模拟汁发酵酒样中挥发性香气化合物的影响
不同接种方式下模拟汁发酵酒样中的主要香气物质GC-MS检测结果如图1(图中同种类别香气物质不同字母表示不同处理组差异显著)所示。试验共检测出85种香气化合物,其中酯类33种、醇类18种、酸类15种、萜烯类7种、醛酮类11种以及其他类1种。由图1可知,A~E处理组分别检测出66、63、75、69、69种香气物质,总量依次为4 830.19、5 836.61、5 732.50、5 940.60、6 750.99 μg/L。不同处理组发酵的酒样产生同类香气物质的种类和含量存在差异。C和D处理组产生酯类种类最多,均有28种,并且C组的酯类产量最高(质量浓度3 229.52 μg/L),与其他处理组之间存在显著性差异(P<0.05)。A、C、D 3个处理组醇类最多,分别为15、17、17种,且C组的醇类产量最高(983.44 μg/L),比对照组(E组)高出约24.00%。C组产生的酸类化合物和醛酮类化合物种类相对较多,质量浓度分别为2 383.18、132.53 μg/L,且含量与其他处理组之间差异较显著(P<0.05)。萜烯类化合物感官阈值低,香气浓郁,是葡萄酒的特征香气,与对照组相比,其他4个处理组均具有显著性差异(P<0.05)。其他类化合物检出含量较少,处理组之间差异不大。

图1 不同接种方式处理组的香气物质比较Fig.1 Comparison of aroma compounds in different inoculation treatment groups
由于试验检测到的挥发性香气物质种类繁多、含量差异较大,为综合分析不同接种组合的产香特征,故对本试验检出的香气化合物中气味活性值(Odor activity value,OAV)大于0.1的物质进行主成分分析(Principal component analysis,PCA)[25],并以特征值大于1进行主成分抽提,得到PC1、PC2和PC3贡献率分别为48.549%、22.861%、19.318%,3个主成分累计解释总方差为90.728%,即这3个主成分能基本反映原数据的全部变异,并根据主成分分析结果得到图2和图3。由图2可知,乙酸异戊酯(果香)、芳樟醇(玫瑰香、柑橘果香)、香叶醇(柠檬、天竺葵味)、己酸乙酯(香蕉、青苹果味)等物质在PC1正半轴上的得分较高,即PC1正半轴主要反映了葡萄酒中的花香、果香特征,而PC1负半轴反应的香气信息较少;9-癸烯酸(脂肪味)、癸酸乙酯(果香、脂肪味)、丁酸乙酯(香蕉、草莓味)、正己酸(乳酪味)等物质在PC2正半轴上的得分较高,即PC2正半轴主要反映了果香、脂肪香的香气特征,而化合物壬醛(蜡香、柑桔香)、辛酸(脂肪味)、正戊醇(果香、青草味)、辛酸乙酯(菠萝、梨、果香味)等物质在PC2负半轴上的得分较高,即代表葡萄酒中脂肪味以及淡淡的果香特征。由图3可知,5个处理组酒样的香气特征可在这2个主成分所形成的二维平面上被很好地区分,其中C处理在PC1、PC2正半轴有较高得分,因而其酒样的花香、果香特征突出;A、B、E处理组所在区域信息较少,香气特征不突出;D处理组PC1得分较高,但PC2得分较低,即该组合酒样香气特征单一,香气缺乏复杂性与层次性。综合分析可知,C处理组酒样香气特征明显优于其他4个处理组,所产香气物质可赋予酒样花香、果香味。因此,选择C处理组接菌组合进行后续微酿试验发酵。
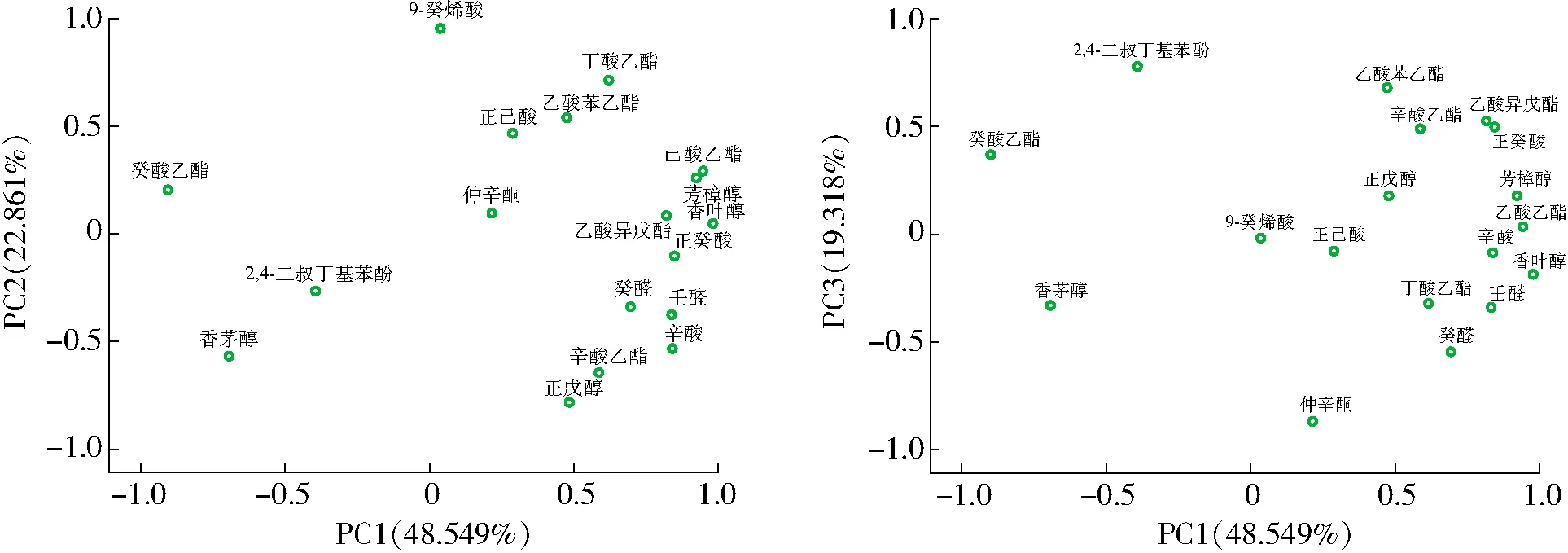
图2 香气化合物PCA因子载荷图Fig.2 Factor loading plot of PCA for aroma compounds

图3 不同接种方式处理组的发酵香气PCA分布图Fig.3 PCA distribution of fermentation aroma in different inoculation treatment groups
2.3 单因素试验分析
2.3.1O.oeni接种量
挥发酸是葡萄酒中以游离状态或以盐的形式存在的所有乙酸系脂肪酸的总和,其中乙酸约占90%,在酒中的最佳质量浓度为0.3~0.8 g/L,过高的挥发酸含量会产生腐败味,严重影响感官品质[26]。此外,酒精度、总酸含量和单宁含量之间的平衡能很好地判断和反映酒体的协调性,而柔和指数则是利用这3个因素构建的综合指标,通过将酒体的风味变化进行量化处理,从而更为直观地判断MLF对于葡萄酒香气的整体贡献[27]。如图4(图中不同字母表示差异显著,下同)所示,随着ZX-1接种量的增加,酒体柔和指数和挥发酸含量均呈升高趋势且差异显著(P<0.05)。当接种量为6%时,柔和指数为1.046,挥发酸质量浓度为0.83 g/L;而O.oeni接种量为7%时,柔和指数虽然最高(1.116),但挥发酸质量浓度高达1.07 g/L。究其原因,挥发酸的产生与柠檬酸代谢相关,而在MLF过程中,O.oeni通过代谢葡萄酒中的柠檬酸而产生乙酸[28],因此,接种量增加后菌株的代谢活动增强,进而导致挥发酸含量升高。综合考虑柔和指数与挥发酸质量浓度,选择接种量6%较佳。

图4 接种量对葡萄酒柔和指数和挥发酸的影响Fig.4 Effect of O. oeni inoculation amounts on soft index and volatile acid of wine samples
2.3.2非酿酒酵母接种量
非酿酒酵母菌株具有独特的代谢通路和较强的风味酶活性,可以在降低酒精生成的同时增加甘油、萜烯和酯类含量,降低乙酸含量,增加葡萄酒的结构、香气、本土特色及复杂感,进而改善葡萄酒整体品质[29]。由图5可知,当MP346接种量为0.30 g/L时,柔和指数达到最大值0.643,挥发酸质量浓度为0.80 g/L,此时葡萄酒中的酸度、单宁含量、酒精度较平衡,葡萄酒的口感最佳。当MP346接种量为0.35 g/L时,酒体柔和指数最低(0.335),而MP346接种量为0.15 g/L时,挥发酸含量最高(质量浓度0.83 g/L),较低的柔和指数表明葡萄酒不太浓厚,酒体不够饱满,而过高的挥发酸含量,不仅掩盖了葡萄酒的香气,还会使葡萄酒失去平衡性[30]。综合考虑柔和指数与挥发酸质量浓度,选择非酿酒酵母接种量0.30 g/L较佳。

图5 非酿酒酵母接种量对葡萄酒柔和指数和挥发酸的影响Fig.5 Effect of non-S. cerevisiae inoculation amounts on soft index and volatile acid of wine samples
2.3.3酿酒酵母接种量
酵母接种量是影响发酵进程的主要因素之一,接种量较少,启酵速度慢;接种量大,启酵速度快,但酒质粗糙,葡萄酒品质较差[31]。由图6可知,随着ES488接种量的增加,柔和指数先升高后下降。ES488接种量为0.25 g/L时,柔和指数最高(0.695),且挥发酸含量较低(质量浓度0.62 g/L),发酵时间短(30 h),当ES488接种量为0.30 g/L时,虽然发酵时间最短(24 h),但酒体柔和指数最低(0.298),挥发酸含量与接种量为0.25 g/L时没有显著性差异(P>0.05),这是由于过大的接种量,导致酒体中的总酸含量过高,酒体柔和指数降低[32]。当ES488接种量为0.10 g/L时,发酵时间长(48 h),同时挥发酸含量高,柔和指数偏低。综合考虑柔和指数与挥发酸质量浓度,选择酿酒酵母接种量0.25 g/L较佳。

图6 酿酒酵母接种量对葡萄酒柔和指数和挥发酸质量浓度的影响Fig.6 Effect of S. cerevisiae inoculation amounts on soft index and volatile acid concentration of wine sample
2.4 正交试验分析
由表4(表中X、Y、Z分别表示O.oeni接种量、非酿酒酵母接种量、酿酒酵母接种量的水平值)中R值可以看出,影响葡萄酒MLF的主次顺序依次为X、Y、Z,即O.oeni接种量是影响美乐低醇葡萄酒MLF的最主要因素,其次为非酿酒酵母接种量,酿酒酵母接种量对美乐低醇葡萄酒MLF的影响最小。由K值可确定最优组合为X3Y3Z2,即:ZX-1接种量7%,MP346接种量0.35 g/L,ES488接种量0.25 g/L,该组合为正交试验中的处理9,其柔和指数为1.229,高于其他8个处理组。由表5可知,ZX-1接种量、MP346接种量对美乐低醇葡萄酒MLF有显著性影响(P<0.05),而ES488接种量对葡萄酒MLF影响不显著。

表4 正交试验结果Tab.4 Results of orthogonal design
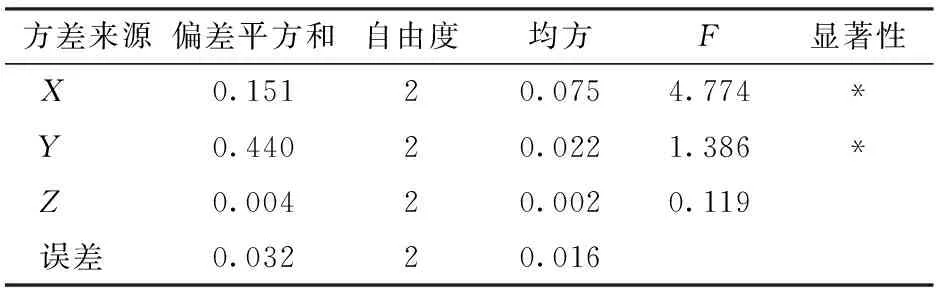
表5 正交试验方差分析Tab.5 Variance analysis of orthogonal test
文献[33]研究发现采用O.oeni、非酿酒酵母和酿酒酵母进行混菌发酵时,酒样挥发性酸度和乙醛降低了60%。在本试验中,当MP346与ES488的接种量一定时,因O.oeni可以分解柠檬酸产生乙酸,所以随着ZX-1接种量的增大,酒样的挥发酸质量浓度升高至1.07 g/L,当MP346接种量增大时,因非酿酒酵母可降低乙酸含量,增加乙酯类等香气物质含量,所以本试验选用ZX-1接种量7%、MP346接种量0.35 g/L、ES488接种量0.25 g/L,即X3Y3Z2是3种发酵菌株的最佳接种比例。
2.5 微酿试验分析
2.5.1美乐低醇桃红葡萄酒基本理化指标
由表6可知,在酒精度基本一致时,F组的残糖质量浓度(81.63 g/L)低于H组(91.00 g/L),说明O.oeni会消耗部分还原糖;与H组相比,F组MLF后酒样的总酸质量浓度降低0.58 g/L,pH值升高0.3,L-苹果酸完全降解(质量浓度小于0.3 g/L);挥发酸是葡萄酒健康状况和腐败情况的评判指标之一[34],微酿试验酒样挥发酸质量浓度为0.51 g/L,符合国标GB/T 15037—2006的要求;酚类物质对葡萄酒的感官品质、抗氧化性及失光沉淀起着关键作用[35],单宁可使酒体保持一定的结构稳定性和口感收敛性[36]。MLF后美乐低醇桃红葡萄酒的总酚质量浓度降低0.01 g/L,单宁质量浓度降低0.02 g/L。柔和指数体现出酒样口感的协调性以及葡萄酒的肥硕、柔和特性[37],MLF后酒样的柔和指数升高0.8,说明MLF可提高葡萄酒样的柔和性,对美乐低醇桃红葡萄酒品质的提升具有积极作用。因此,与对照组(H组)相比,接入O.oeni的低醇葡萄酒不仅酒体饱满,平衡性好,且挥发酸含量低,酒体品质良好。
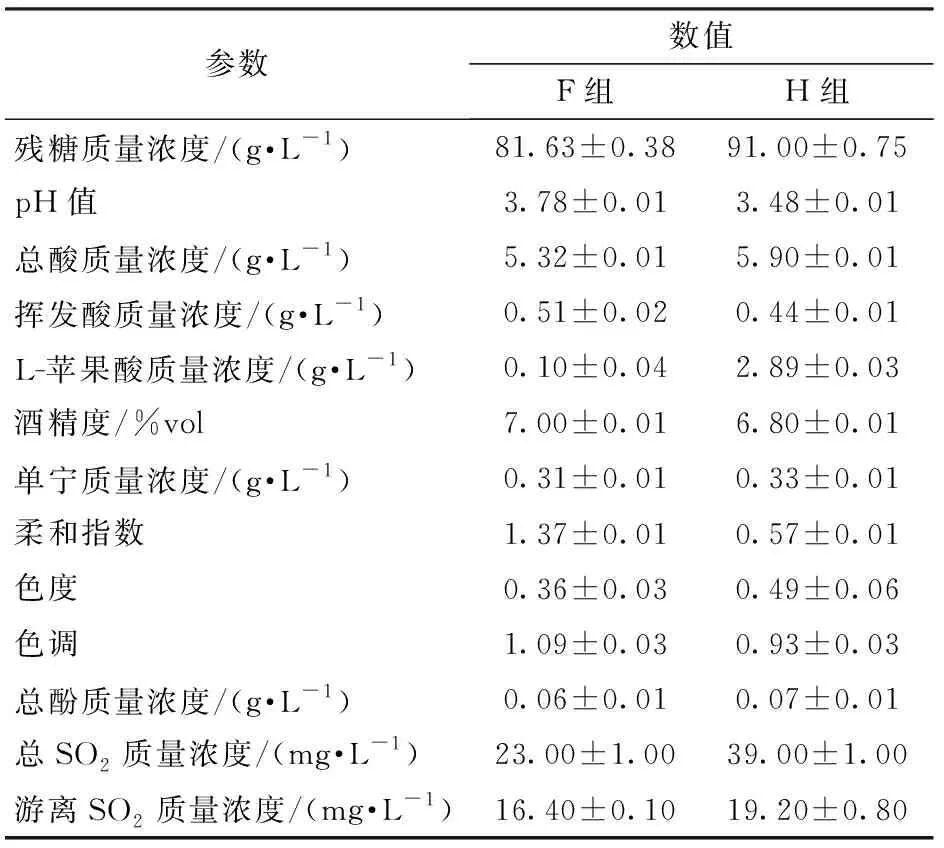
表6 美乐低醇桃红葡萄酒理化指标的变化Tab.6 Changes of physical and chemical indexes of Merlot low alcohol rose wine
2.5.2香气物质分析
对表7[38-43]和图7进行综合分析可知:试验共检测出110种香气化合物(表7中仅列出部分种类),其中酯类42种、醇类26种、酸类14种、萜烯类10种、醛酮类13种以及其他类5种。由图7知,其中酯类香气物质种类最多,质量浓度也最高(6 267.99 μg/L),质量浓度排在前6位的香气物质分别为辛酸(3 916.20 μg/L)、辛酸乙酯(2 023.05 μg/L)、己酸乙酯(1 732.93 μg/L)、乙酸异戊酯(1 261.03 μg/L)和正戊醇(1 114.70 μg/L)。F、H组分别检出105、80种香气物质,其总质量浓度分别为8 111.59、5 957.92 μg/L。O.oeni拥有广泛的代谢途径和多种酶,能赋予葡萄酒复杂的香气,从而改变酒中酯类、高级醇类、酸类和萜烯
类等物质成分的含量及平衡关系[44]。F组的酯类、醇类、酸类香气化合物的含量与种类均高于H组,尤其是辛酸乙酯、乙酸异戊酯、正己醇(表7中未列出)、辛酸的含量比H组分别高出约40.08%、152.00%、8.58%和4.44%,F组的萜烯类质量浓度高于H组。综合分析,经过MLF的葡萄酒样不仅酯类物质尤其是具有果香、花香味的乙酯类化合物含量增多,而且还增加了葡萄酒香气的复杂性,使酒体香气更加浓郁、圆润。即对于美乐低醇桃红葡萄酒而言,采用F组发酵方式更有利于提高香气品质。

表7 美乐低醇桃红葡萄酒挥发性香气化合物Tab.7 Volatile aroma compounds of Merlot low alcohol rose wine

图7 美乐低醇桃红葡萄酒的香气物质比较Fig.7 Comparison of aromacompounds in Merlot low alcohol rose wine
2.5.3感官评价分析

图8 美乐低醇桃红葡萄酒感观分析雷达图Fig.8 Radar map of sensory analysis for Merlot low alcohol rose wine
图8为美乐低醇桃红葡萄酒感官分析雷达图。F组与H组在色泽方面并无较大差异,但F组的花香、果香、余味长短均高于H组,这是由于MLF提高了酒样中的酯类、酸类、醇类化合物含量,与文献[44]的研究结果相一致。从口感方面分析可知,MLF使酒样的口感变得更加柔和圆润。因此,采用MLF后的F组酒样更有利于花果香的形成,使酒体典型性更突出。
3 结论
(1)以不同MLF接种方式进行模拟汁发酵的酒样香气化合物分析表明:本土酒酒球菌ZX-1与非酿酒酵母MP346同时接种,发酵至酒精度3.5%vol时再接种酿酒酵母ES488,发酵产生的酯类种类最多(28种)、含量最高(质量浓度3 229.52 μg/L),并且酯类、酸类、醛酮类化合物含量与其他4个处理组之间存在显著性差异(P<0.05)。
(2)微酿试验表明,ZX-1接种量、MP346接种量对美乐低醇葡萄酒MLF有显著性影响(P<0.05),在O.oeni接种量7%、非酿酒酵母接种量0.35 g/L、酿酒酵母接种量0.25 g/L的混菌发酵条件下,美乐低醇葡萄酒中的酯类、醇类、酸类化合物含量明显升高,在赋予酒样强烈果香、花香的同时还增强了酒体香气的复杂性和层次感,风格典型性突出,与感官评价结果相一致。总体而言,对美乐低醇葡萄酒进行苹果酸-乳酸发酵可明显提升香气品质。
