氯虫苯甲酰胺胁迫下二化螟中肠细菌类微生物的多样性
2020-11-23张珏锋张琴李芳钟海英陈建明
张珏锋 张琴 李芳 钟海英 陈建明,*
(1 浙江省农业科学院 植物保护与微生物研究所, 杭州 310021;2 杭州市林业科学研究院, 杭州 310021;*通信联系人,E-mail:chenjm63@163.com)
昆虫中肠微生物对寄主的繁殖[1]、抵御外来微生物入侵[2]、提高免疫力等均发挥着重要的作用。已有研究表明,除与害虫抗性性增强有关的杀虫剂靶标位点转移、害虫解毒酶的高表达以及药物排泄能力增加之外[3-4],害虫中肠微生物可能与寄主抗药性存在某种关联。张浩等[5]的研究表明,棉铃虫(Helicover pa armigera)肠道菌在苏云金芽孢杆菌(Bt)杀虫过程中对宿主具有保护作用,并检测到一株能有效降低Bt毒素对寄主杀虫活性的菌株;点蜂缘蝽(Riptortus pedestris)中肠存在能降解杀螟硫松(Fenitrothion)的Burkholderia属细菌[6]。去除肠道菌的德国小蠊(Blattella germanica)比敏感品系的抗性水平还低,PCR-DGGE 结果显示敏感品系与抗性品系的德国小蠊肠道图谱电泳条带数量和迁移率存在差异[7-8]。用从小菜蛾(Plutella xylostella)肠道中分离纯化的厚壁菌门细菌肠球菌(Enterococussp)、沙门菌(Serratiasp)以及抗生素分别饲喂小菜蛾,肠球菌显著提高了小菜蛾对毒死蜱的抗性,沙门菌显著降低了小菜蛾对毒死蜱的抗性,抗生素清除肠道细菌后,小菜蛾的抗药性显著增强[9,10]。
二化螟[Chilo suppressalis(Walker)]属鳞翅目(Lepidoptera)螟蛾科(Pyralidae),是我国水稻上的重要害虫。近年,由于耕作制度改变、抗药性产生等影响,越冬代有效虫源面积扩大,加剧了二化螟的危害[11,12]。氯虫苯甲酰胺自2008 年正式注册以来,在我国被大范围应用于二化螟的田间防治[13]。然而近年来的研究发现不同地理种群的二化螟对氯虫苯甲酰胺的抗性水平已经存在显著差异[14-16],如2017 年报道浙江地区二化螟种群已对氯虫苯甲酰胺产生了中高水平的抗性[17]。目前有关二化螟对于氯虫苯甲酰胺抗性产生机制已有较多研究[18-19],我们的研究发现不同抗药性水平的二化螟种群在中肠微生物群落的组成与结构上存在差异,推测可能与二化螟抗药性差异有关[20]。为证实二化螟中肠菌群在寄主对氯虫苯甲酰胺抗性产生过程中的作用,本研究采用宏基因组测序以及传统微生物分离纯培养的方法研究不同浓度氯虫苯甲酰胺处理的二化螟种群中肠细菌类微生物多样性,以期为阐明二化螟对氯虫苯甲酰胺产生抗药性的机理以及预防和治理二化螟的抗药性提供理论依据。
1 材料与方法
1.1 供试昆虫与药剂
供试二化螟虫源采集于浙江海宁田间,对氯虫苯甲酰胺抗性倍数为 52.72,饲养于浙江省农业科学院植物保护与微生物研究所人工气候室内,温度为28℃±0.5℃;光周期为16 h 光照/8 h 黑暗;长期茭白饲喂,4 龄幼虫用于试验。
供试药剂为95%氯虫苯甲酰胺原药。
1.2 实验方法
药剂配置:氯虫苯甲酰胺原药溶于二甲基亚砜,配置成 100 µg/mL、200 µg/mL、400 µg/mL 溶液,0.23 µm 滤头过滤后备用,以二甲基亚砜溶液为对照。
试虫处理:45 日龄水稻苗分株洗净,晾干,对照及上述3 种浓度溶液浸泡30 s 后分别放入罐头瓶中,根部包裹纱布并保湿,每瓶中接入4 龄二化螟幼虫20 头,每浓度处理200 头虫子,24 h、48 h、72 h 后取样,每次取样30 头4 龄二化螟幼虫,其中100 µg/mL 氯虫苯甲酰胺溶液24 h、48 h 和72 h处理命名为 100_24h、100_48h、100_72h;200 µg/mL氯虫苯甲酰胺溶液24 h、48 h 和72 h 处理命名为200_24h、200_48h、200_72h;400 µg/mL 氯虫苯甲酰胺溶液24 h、48 h 和72 h 处理命名为400_24h、400_48h、400_72h;二甲基亚砜溶液24 h、48 h 和72 h 处理命名为 CK_24h、CK_48h、CK_72h,并解剖取中肠用于下一步实验。
中肠细菌 DNA 的提取:二化螟中肠去除内含物之后无菌水漂洗,细菌 DNA 提取试剂盒(OMEGA , USA )提取中肠细菌类微生物DNA。
Illumina PE250 测序:中肠细菌类微生物DNA检测质量稀释后作为模板,根据测序区域的选择,使用带 Barcode 的特异引物,PCR 扩增(表1)之后割胶回收产物。回收 DNA 片段的一端与引物碱基互补,固定在芯片上;另一端随机与附近的另外一个引物互补,形成“桥 (bridge)”产生 DNA 簇;DNA 扩增子线性化成为单链。加入改造过的DNA聚合酶和带有4 种荧光标记的dNTP,每次循环只合成一个碱基;用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”化学切割,恢复3'端黏性,继续聚合第二个核苷酸;统计每轮收集到的荧光信号结果,获知模板DNA 片段的序列。Illumina PE250 测序得到的双末端读长(PE reads)首先进行拼接、质控和过滤,区分样本后进行 OTU 聚类分析和物种分类学分析,对优化序列提取非重复序列,降低分析中间过程冗余计算量,去除没有重复的单序列,按照 97% 相似性对非重复序列(不含单序列) 进行OTU 聚类,基于OTU 聚类分析结果,可以对 OTU 进行多种多样性指数分析,以及对测序深度的检测;基于分类学信息,可以在各个分类水平上进行群落结构的统计分析。在上述分析的基础上,可以进行一系列群落结构和系统发育等深入的统计学和可视化分析。
二化螟中肠分离:供试二化螟4 龄幼虫20 头,分为4 组,分别解取中肠后75%酒精清洗、匀浆后加入10 mL ddH2O 稀释,用于进一步实验。
LB 固体培养基配制:950 mL ddH2O 加入胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,加热融解后分装,调pH 至7.0,ddH2O 定容至1 L,高压蒸汽灭菌21 min 后取出待用。
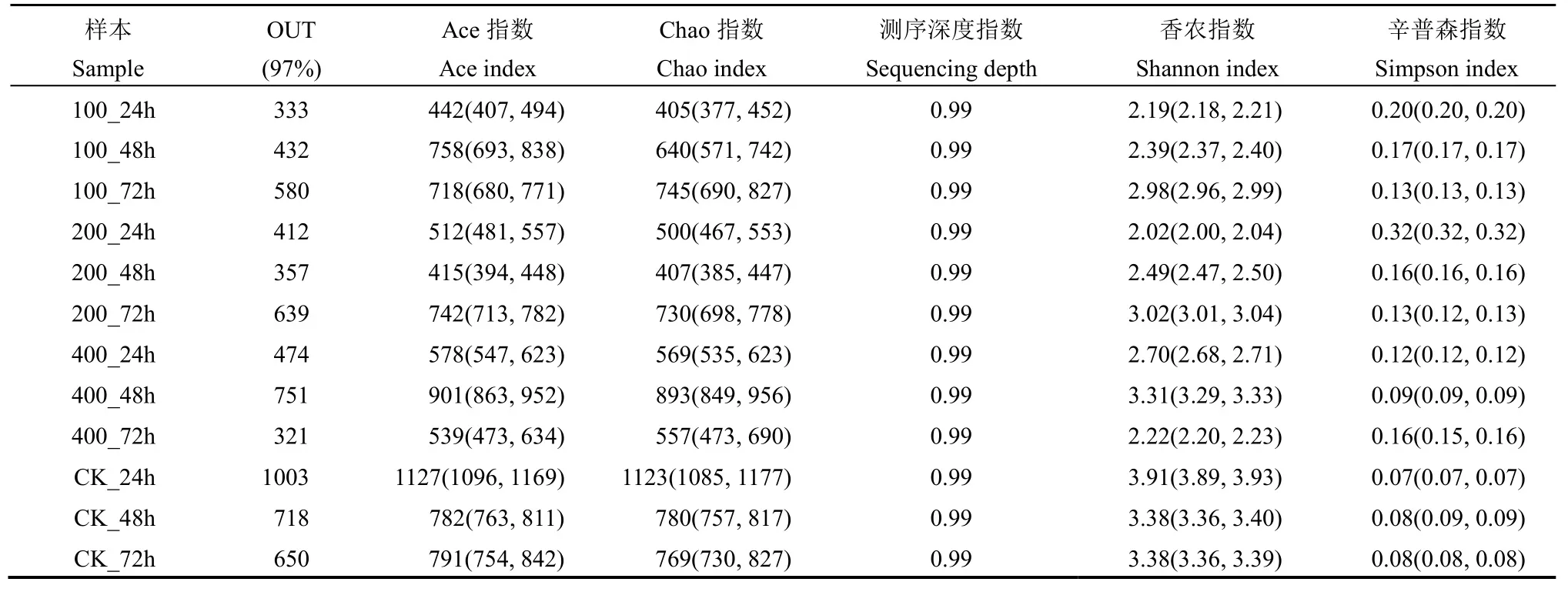
表1 不同处理二化螟试虫中肠细菌群落多样性指数Table 1. Bacterial community richness, diversity indices of midgut in Chilo suppressalis under different treatments.
二化螟中肠细菌类微生物的培养:在1 mL 中肠研磨液中分别加入1 mL 上述3 个浓度氯虫苯甲酰胺溶液和9 mL LB 固体培养基混匀后置于37℃培养箱中培养,每个浓度3 个重复,以ddH2O 为对照处理。48 h 后用牙签挑取培养菌落,每个浓度挑取30 个菌斑,置于5 mL LB 液体培养基中,37℃摇床培养后离心收集菌体提取DNA。
基因组DNA 的提取:细菌DNA 的提取采用细菌DNA 提取试剂盒(OMEGA,USA)进行,提取的DNA 用于进一步 PCR,PCR 参考张珏锋等[20],PCR产物送北京擎科生物科技有限公司测序。
2 结果与分析
2.1 不同处理二化螟体内细菌群落多样性分析
本次测序的二化螟中肠所有 12 个样品,测序深度均在99.00%以上,能够代表各个样本中肠细菌种群的真实情况(表1)。Chao 指数与Ace 指数通常用于描述细菌群落多样性,两者都可用来估计群落中含有OTU 数目的指数,表1 中,对照24 h 处理(CK_24h)的指数(Chao、Ace)平均值最高,为 1123和3.91;200_48h 处理的Ace 平均值为12 个测序样品中最低(415)。辛普森指数与香农指数也用于描述群落多样性,前者指数值越大,说明群落多样性越低,后者值越大,说明群落多样性越高。表1 结果显示,CK_24h 处理辛普森指数最低,同样该处理香农指数最高。
2.2 OTUs 统计及分类学分析
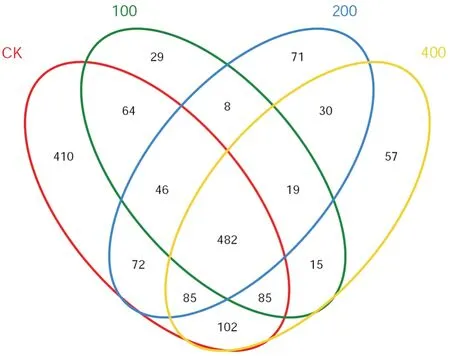
图1 不同处理二化螟试虫中肠细菌类微生物OUT韦恩图分析Fig. 1. Venn analysis of the number and community of intestinal bacteria of Chilo suppressalis under different treatments.
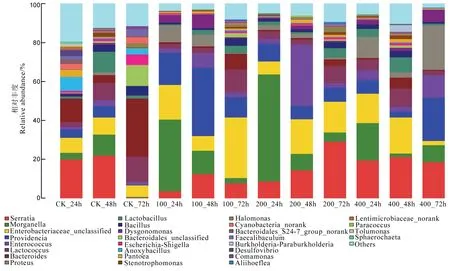
图2 基于属水平不同处理二化螟体内中肠细菌群落结构Fig. 2. Genera of intestinal bacteria found in different treated Chilo suppressalis population.
由韦恩图(图1)分析结果可知:对照二化螟试虫中肠细菌类微生物群落OTUs 为1346 个,多于氯虫苯甲酰胺处理的二化螟试虫,氯虫苯甲酰胺100、200、400 µg/mL 处理种群中肠细菌类微生物群落OTUs 分别为 748 个、813 个、875 个。3 个不同浓度氯虫苯甲酰胺处理的二化螟种群中特有的 OUT数量分别为 29(100 µg/mL)、71(200 µg/mL)、57(400µg/mL),均小于对照处理的410。
2.3 不同处理二化螟中肠细菌群落结构分析
由图2 可知,对相似水平达 97%的OTU 代表序列进行分类学分析,从而得到不同样品中每个OTU 对应的物种分类信息。在属的分类水平上,注释到明确分类地位的有29 个属(图2)。在对照二化螟种群中肠微生物中比例较高的拟杆菌属(Bacteroides)在处理种群中有所降低,在 100_72h中的比例较高但也仅为8.16%;但肠道致病菌摩根氏菌属(Morganella)与普罗威登斯菌属(Providencia)的比例显著升高,前者从CK_24h 的3.48%上升至100_24h 的36.84%,200_24h 的55.10%和400_24h的19.09%;后者在对照种群中的3 个时间段的含量分别为4.40%、5.80%和0.50%,而在处理种群中的最高比例达到 35.16%(100_48h),即使在相对含量较低的400_48h 处理中,比例也达到3.17%,高于对照处理中的0.50%。推测氯虫苯甲酰胺的施用会对二化螟中肠内某些细菌类微生物比例及优势度造成影响。变形菌属(Proteus)在对照种群 3 个时间段内的含量均较低,而在处理种群内含量相对较高。
2.4 COG 数据库对比
16S rRNA 功能预测是通过PICRUSt 对OUT丰度表进行标准化,对应Greengene ID 获得OUT对应的COG 家族信息和KO 信息及其丰度,并预测基因进行COG 功能分类,结果如图3 所示。对照种群24 h 处理 (CK_24h) 染色质结构与动力学相关 (Chromatin structure and dynamics) 基因数为 11 452,高于100 µg/mL、200 µg/mL 及 400 µg/mL氯虫苯甲酰胺 24 h 处理种群(100_24h、200_24h、400_24h)的1274、1355 与1737;同样对照种群24 h处理 (CK_24h) 的防御机制 (Defense mechanisms)相关基因数1 058 083 也高于其余3 个处理种群的872 261、639 857 及732 004。除此之外,4 个种群在其余各功能分类基因数量上并无差异。
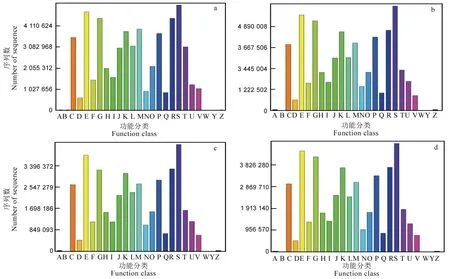
图3 不同处理二化螟试虫COG 功能预测Fig. 3. COG classification of intestinal bacteria of Chilo suppressalis in different treatments.
2.5 KEGG 分析结果
由KEGG 的功能预测结果可见,对照种群各个时间段的结果与处理试虫的结果无明显差异,主要集中于膜转运(membrane transport)、碳代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)、复制与修复(replication and repair),其中膜转运(membrane transport)的相对丰度在氯虫苯甲酰胺处理中均为 0.16,略高于 3 个对照的均值0.1。
2.6 氯虫苯甲酰胺诱导培养二化螟中肠细菌测序结果
由表2 可知,在含有不同浓度氯虫苯甲酰胺溶液的培养基上培养的二化螟中肠细菌类微生物种类存在差异,对照处理测序成功的 19 株菌株,除去Leclercia adecarboxylata,其余均属肠杆菌属(Enterobacter);100 µg/mL 处理测序成功的 26 株菌株中除 3 株无法培养外(uncultured bacterium),18株属肠杆菌属(Enterobacter),另有Lelliottia nimipressuralis、Klebsiellasp.、Enterobacter kobei、Leclercia adecarboxylata、Pantoea agglomerans和Pantoeasp. DAP16 等 5 株菌株;200 µg/mL 处理中除 13 株属肠杆菌属(Enterobacter)外,其余菌株与100 µg/mL 一致;400 µg/mL 中除Enterobacter外,另 检 测 到Leclercia adecarboxylata、Pantoea agglomerans及Pantoeasp. DAP16 三种菌与 100µg/mL 及 200 µg/mL 培养结果略有差异。
3 讨论
本研究中氯虫苯甲酰胺溶液不同浓度处理能降低二化螟中肠细菌类微生物丰度及多样性,处理种群中肠细菌类微生物的OUT 数值、特有OUT 数值均低于未处理种群。推测由于昆虫肠道微生物的群落结构组成易受食物、生存环境、肠道理化因子以及免疫系统等诸多因素的影响[17],因而外源氯虫苯甲酰胺的处理致使二化螟中肠微生物的群落结构发生变化。已有研究表明,昆虫肠道菌群结构丰度与寄主对化学杀虫剂的抗性存在某种关联,如棉铃虫抗性种群的中肠细菌类微生物的丰富度显著高于敏感种群[21];而夏晓峰[10]的研究发现利用抗生素清除肠道细菌后,小菜蛾(Plutella xylostella)的抗药性反而得到显著增强。因而进一步推测,本研究中处理种群细菌类微生物群落结构丰度降低等可能与寄主昆虫对氯虫苯甲酰胺抗性的产生存在关联。而对照处理的3 个时间段之间基于属水平细菌菌群落结构存在一定差异,推测与二化螟龄期转变及增长有关[22]。
昆虫肠道微生物对于宿主有着重要作用,其菌群结构、组成、丰度以及功能的改变均为抵御和消除外源因子对于昆虫生长发育与繁殖等的影响[23,24]。随着化学杀虫剂的广泛应用,相应的害虫对杀虫剂抗性问题也日益严重。多项研究表明,某些昆虫的共生细菌具有降解化学杀虫剂的能力[25,26],这表明昆虫的共生细菌有可能与寄主抗药性的产生有关。果蝇肠道菌(Bactrocera dorsalis)可提高寄主对敌百虫(trichlorphon)的抗性[27];枯草芽孢杆菌(Bacillus subtilis) SWL-19 能明显减轻氟对家蚕的胁迫[28]。刘金萍等[29]通过 KEGG 代谢途径分析,推测高浓度CO2胁迫下,棉铃虫中肠微生物具有降解有毒物质作用。氯虫苯甲酰胺的施用致使宿主通过其菌群结构、组成及功能的改变消除其造成的不良影响,从而导致本研究中摩根氏菌属(Morganella)、普罗威登斯菌属(Providencia)以及变形菌属(Proteus)在处理种群中的比例显著升高;培养结果显示氯虫苯甲酰胺处理获得的培养菌株除肠杆菌属外,还存在Lelliottia nimipressuralis、Klebsiella sp.、Enterobacter kobei、Leclercia adecarboxylata、Pantoea agglomerans等多种其他菌属。由此推测,二化螟肠道内细菌类微生物对氯虫苯甲酰胺的敏感性存在差异;同时离体培养结果也说明氯虫苯甲酰胺胁迫致使二化螟中肠内某些特定功能的细菌类微生物比例及优势度发生改变。
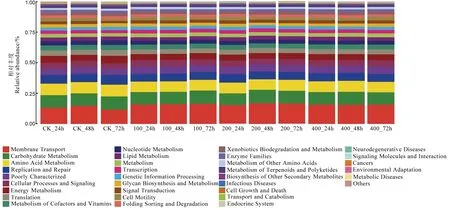
图4 基于宏基因组测序KEGG 功能预测Fig. 4. KEGG function prediction based on macrogenomic sequencing.

表2 二化螟中肠细菌类微生物离体培养测序结果Table 2. Isolation and identification of bacteria from the midgut of Chilo suppressalis.
自然环境中的微生物群落功能组成与环境因子密切相关,相似环境中的微生物群落功能更相似,而行使功能的微生物物种组成可能差异较大[30、31]。因而除了不同环境中的微生物群落结构组成之外,揭示微生物群落功能更为重要。本研究中根据16S测序数据进行基于KEGG和eggNOG数据库的功能预测,结果发现不同浓度氯虫苯甲酰胺处理二化螟种群与对照种群在各功能分类基因数量及丰度上无明显差异,推测由于本研究中氯虫苯甲酰胺处理最长时间仅72 h,外源化学杀虫剂胁迫时间过短,不足以使二化螟中肠微生物群落功能发生改变,处理时间的延长是否会使群落功能发生变化还需进一步实验验证。
总之肠道微生物与寄主昆虫协同发展的过程中,通过何种机制抵御外源不良因子的胁迫,调节维持肠道微生物群落结构、丰度、功能来维持菌群的稳态平衡,维护寄主昆虫的利益目前还不明确,需进一步研究。
