水稻淀粉合成对夜温变化的响应
2020-11-23张玉屏王军可王亚梁陈燕华朱德峰陈惠哲向镜张义凯刘小军朱艳曹卫星
张玉屏 王军可 王亚梁 陈燕华 朱德峰 陈惠哲 向镜 张义凯 刘小军 朱艳 曹卫星,*
(1 南京农业大学 国家信息农业工程技术中心/江苏省信息农业重点实验室, 南京 210095; 2 中国水稻研究所 水稻生物学国家重点实验室, 杭州310006; # 共同第一作者;*通信联系人, E-mail: caow@njau.edu.cn)
随着社会经济的发展,我国人民对稻米品质的要求逐渐提高,水稻生产目标由单一追求高产向高产优质兼顾转变。长江中下游是我国水稻生产的主要产区。近年来,品种更新速度加快,出现了浙禾香2号、南粳46和苏香粳等一批优质的软香米品种,支链淀粉含量较高,而直链淀粉含量较常规粳米低,口感细柔,深受消费者青睐,种植面积及辐射区域逐渐变广,软香米粳稻种植面积逐渐增加[1]。然而长江中下游地域辽阔,不同地域水稻种植品质表现不一,主要原因是不同地域间存在的光温差异,其中温度是影响品质最重要的因子[2]。淀粉约占精米质量的85%~90%,主要由直链淀粉和支链淀粉两部分组成,在稻米中的含量分别为0%~30%和70%~95%,大量研究表明[3-5],温度会影响稻米中直链淀粉和支链淀粉的比例,影响淀粉的特性和稻米的品质。
随着气候变化的加剧,水稻灌浆结实期温度有升高的趋势。白天高温天气对水稻产生胁迫效应,对品质影响的研究也较多。籽粒灌浆依靠光合同化物的积累与转运,极端高温加剧了叶片衰老,导致光合同化物形成受阻,从而导致粒重下降。Zhang等[6]研究指出,白天40℃高温对蔗糖转运没有影响,但抑制蔗糖水解,这是籽粒灌浆受阻的主要原因。前人研究表明[7-9],水稻花后0-15 d 对高温影响最为敏感,35℃以上的高温天气导致水稻高温逼熟,粒重下降,垩白度增加,直链淀粉比例上升,稻米品质变劣,其中,高温下淀粉形成受阻,ADP 葡萄糖焦磷酸化酶、颗粒结合淀粉合酶、可溶性淀粉合酶、淀粉分支酶活性均受到抑制。前人研究结果表明直链淀粉与支链淀粉的比例及支链淀粉结构共同决定了稻米品质[10]。然而,气候变化下,温度升高尤其是夜温升高如何影响两类淀粉形成需进一步探究。
联合国政府间气候变化专门委员会(IPCC)报告曾指出,夜温升高的趋势要大于昼温变化[11]。我国水稻种植区域广阔,不同地域间品种生长发育受到昼夜温差的影响。Peng 等[12]研究指出,夜温升高1℃,水稻产量下降 10%。白天温度胁迫对作物生长的影响多是短暂的、阶段性的,而夜温对作物生长的影响可能是一种长期积累的效应[13]。夜温升高对粒重的影响大于白天温度升高,有研究指出[14],夜温升高促进了呼吸作用进而降低粒重,光合产物的分配与转运多在白天进行。吴自明等[15]研究指出,夜温升高有利于晚稻外观品质形成,同时降低直链淀粉含量。籽粒碳水化合物积累主要依赖于叶片的光合作用以及碳水化合物的转运,不同地区昼夜温度的变化对稻米品质造成了较大的影响[16],水稻生长存在昼夜节律特性[17],夜温变化对籽粒灌浆及淀粉积累的生理研究较少,特别是夜温变化下,影响籽粒淀粉形成的生理特性并不清楚。
为此,本研究选择软香米浙禾香2 号为供试品种,研究夜温变化对淀粉形成的影响及其生理机制,完善夜温变化影响稻米品质的理论依据,并为稻米品质的调优栽培提供参考。
1 材料与方法
1.1 供试品种与种植方法
在2018 年的预备试验基础上,试验于2019 年在中国水稻研究所人工气候箱群试验场进行。选择优质软香米品种浙禾香2 号为试验材料。于5 月25日播种,大棚基质育秧,6 月10 日选生长一致的秧苗移栽到塑料种植盆(长×宽×高:24 cm×22.5 cm×21.5 cm)中,每盆2 穴,每穴2 苗。每个处理种植100 盆,塑料盆每盆装过筛土10 kg。施肥方式为每盆施复合肥(氮磷钾比例为1∶1∶1) 4.0 g 作基肥,移栽后施尿素0.5 g 作为分蘖肥,穗分化开始时施复合肥2.25 g 作为穗肥。其余管理措施与一般高产栽培一致。

表1 人工气候箱温度设置Table 1. Temperature setting of different treatments in climate chambers. ℃
1.2 夜温处理
试验设计分夜间适温(NT,24℃)、夜间低温(LT,21℃)和夜间高温(HT,28℃)三个温度处理,均利用人工气候箱进行。白天最高温度保持31℃,具体温度设置如表 1。处理期间,人工气候箱湿度维持在70%~80%。穗顶抽出剑叶鞘5 cm 左右时选择大小基本一致的单穗(包括主茎穗和部分分蘖穗)挂牌标记,每处理标记 100~150 穗,供取样分析。水稻齐穗期移入人工气候箱处理15 d,之后移出人工气候箱直到成熟。
1.3 测定项目与方法
1.3.1 粒重
在不同温度处理后5 d、10 d、15 d 及成熟期,中午12 点进行取样,取挂牌稻穗10~15 个,选取中部1/3 段籽粒,置于70℃烘箱中烘干至恒重后测定粒重。
1.3.2 米粉糊化温度
用快速黏度分析仪(RVA-Tec master,Newport scientific,澳大利亚)测定,含水量为14%时样品量为3.0 g,蒸馏水25 mL。测定过程中灌内温度变化如下:50℃下保持1 min,以12℃/min 上升至95℃(3.75 min),保持 205 min,以 12℃/min 下降到 50℃(3.75 min),50℃保持1.4 min。搅拌器在起始10 s内转动速度为960 r/min,以后保持在160 r/min。用配套的TCW(Thermal Cycle For Windows)分析,计算糊化温度。
1.3.3 支链淀粉链长的测定
利用毛细管电泳色谱仪(P/ACE MDQ Capillary Electrophoresis System, Beckman) 测定支链淀粉链长。具体步骤如下:配置0.05 mol/L、pH 值3.5 的NaAc 缓冲液,并用1.4 mL 冰乙酸定容至400 mL。用4 mol/L NaOH 溶液调pH 值3.5,定容至500 mL;称50 mg 样品放入25 mL 容量瓶中,加5 mL NaAc缓冲液,140℃下煮沸30 min;冷却至室温,加入25 μL 异淀粉酶(1000 μmol/mL);40℃下恒温振荡48 h(200 r/min),取1 mL 沸水浴灭活15 min,1200 r/min 离心10 min,取上清液50 μL 凝缩干;加入5 μL 麦芽糖,彻底浓缩干,加3.5 μL 氰基硼氢化钠,加 3.5 μL APTS(8-氨基芘-1, 3, 6-三磺酸三钠盐),混匀,37℃下标记过夜;标记好的样品加入43 μL水,混匀,10 000 r/min 离心 10 min,取上清液 5 μL,加入ddH2O 195 μL,然后上机检测分析。
1.3.4 剑叶净光合速率
在不同温度处理的第5 天、第10 天和第15 天,上午 9:00-11:00 利用 Li-6400 便携式光合作用仪(LI-COR, Lincoln, NE, 美国)测量叶片净光合速率,光合仪设置参数如下:光量子通量设置为 1000 μmol/(m2·s), CO2浓度为 450 μmol/m2,叶面积为 6 cm2,流速500 μmol/s, 温度设置31℃。每重复测定10 个主茎。
1.3.5 非结构性碳水化合物含量测定
非结构性碳水化合物含量是可溶性糖和淀粉含量的总和。在不同温度处理后5 d、10 d、15 d 及成熟期,在中午12 点和夜晚24 点挂牌穗取样,选择20~30 个穗中部籽粒,取1/3 样品用于测定可溶性糖和淀粉含量。为了测定可溶性糖含量,将冷冻的籽粒研磨成细粉并在 100℃的蒸馏水中提取,然后将混合物在10 000g下离心10 min。沉淀物干燥后用于淀粉测定。将0.1 mL 上清液与0.5 mL 蒽酮/乙酸乙酯溶液(1 g 蒽酮溶于50 mL 乙酸乙酯)和5 mL H2SO4混合。煮沸1 min 后,监测反应混合物在630 nm 处的吸光度变化。从使用标准蔗糖溶液制备的标准曲线测定可溶性糖含量。上述离心后的沉淀,加入80%乙醇,80℃恒温水浴20 min,期间不断搅拌,冷却后加入2 mL 9.2 mol/L 高氯酸,震荡10 min,加 6 mL 蒸馏水,10 000×g下离心 20 min,收集上清液的同时在残渣内加入2 mL 4.6 mol/L 高氯酸并震荡10 min,加入6 mL 蒸馏水后10 000×g下离心10 min,收集上清液,弃去残渣,上清液合并定容后即为淀粉提取液。并根据可溶性糖浓度的测定方法测定淀粉含量。

表2 实时荧光定量PCR 引物序列Table 2. Primers used for quantitative real-time PCR.
1.3.6 淀粉积累相关酶活性测定
采用1.3.4 方法取的1/3 中部籽粒样品用液氮固定,用于生理指标测定。利用蔗糖合酶、可溶性酸性转化酶、腺苷二磷葡萄糖、ADP-葡萄糖焦磷酸化酶、颗粒结合淀粉合酶、可溶性淀粉合酶、淀粉分支酶、淀粉脱分支酶、ɑ-淀粉酶、β-淀粉酶活性测定试剂盒(苏州科铭有限公司提供)进行淀粉积累相关酶活性测定。
1.3.7 籽粒RNA 提取和实时荧光定量
采用1.3.4 方法取的1/3 中部籽粒样品,−80℃保存待测。每重复取冷冻保存的籽粒样品0.1 g,用于蔗糖转运蛋白相关基因OsSUT1、OsSUT2、OsSUT4和支链形成相关基因OsSSI、OsSSIIa、OsSSIIIa和OsBEIIb等相对表达量测定。 籽粒RNA提取时先除去淀粉,利用陈香嵩等的方法进行RNA提取。RNA 反转录用ToYoBo 公司的NA 反转录试剂盒[ReverTra Ace quantitative PCR RT Master Mix(Toyobo, Osaka, Japan]进行。取 20 μL 产物中加入140 μL 的双蒸水稀释,实时荧光定量PCR 利用7500实时 PCR system (Applied Biosystems System) 进行。基因表达分析所用引物序列如表2 所示。基因表达的参照基因为OsUBQ,并用采用2–ΔΔCT方法[18]进行标准化计算基因相对表达量。
1.4 数据统计与分析
采用Excel 2016 进行数据统计,用SAS 9.4 软件进行方差分析,Duncan 新复极差法检验处理间差异。
2 结果与分析
2.1 夜温变化对籽粒淀粉形成的影响
夜温变化对籽粒形成造成显著影响。如图1 所示,与适温相比,夜温降低或升高 4℃导致粒重下降6.0%(P<0.05)和16.3%(P<0.05),处理期间夜间低温(LT)处理糙米粒重增幅小于夜间常温(NT)和夜间高温(HT) (图1-A)。LT 和HT 成熟期淀粉含量比NT低2.6% (P<0.05)和10.9% (P<0.05),其中主要表现为支链淀粉显著下降,然而直链淀粉含量相对于LT和HT 含量显著增加 (图1-B)。LT 增加了支链长聚合度6-15 的支链淀粉链长数量,而HT 增加了支链聚合度 12-18 的链长数量,两个处理均降低聚合度大于18 的链长数量(图1-C)。淀粉结构的变化改变了稻米的蒸煮特性,LT 和HT 糊化温度分别比NT 降低 1.1℃ (P<0.05)和 1.3℃ (P<0.05)(图 1-D),同时胶稠度降低1.4%(P>0.05)和8.1%(P<0.05)(图1-E)。
2.2 夜温变化对碳水化合物转运的影响
籽粒形成最直接来源于叶片的净光合作用,随着处理时间的延长,LT 净光合速率与NT 相比差异不明显,然而HT 处理净光合速率随着处理时间延长有下降的趋势(表3)。对处理过程中碳水化合物含量进行分析(图 2),发现随着处理时间的延长,LT和HT 促进了可溶性糖含量的增加,降低了淀粉和非结构性碳水化合物含量,白天和夜晚表现趋势一致。籽粒淀粉的积累来自于碳水化合物的转运,对蔗糖转运基因进行分析,发现除OsSUT1基因表达量在夜晚有所下降之外,OsSUT1、OsSUT2及OsSUT43 个基因的表达量在LT 和HT 下均呈现降低的趋势(图3),结果说明,在NT 和HT 条件下,碳水化合物的转运受到抑制。同时随着处理时间的延长,蔗糖水解酶活性在LT 和HT 条件下受到抑制,白天和夜晚变化的趋势一致(图4)。以上说明,夜温降低或升高抑制碳水化合物的转运,不仅仅抑制了夜间碳水化合物的积累,同时抑制了白天碳水化合物的运输。
2.3 夜温变化对淀粉合成相关酶活性的影响
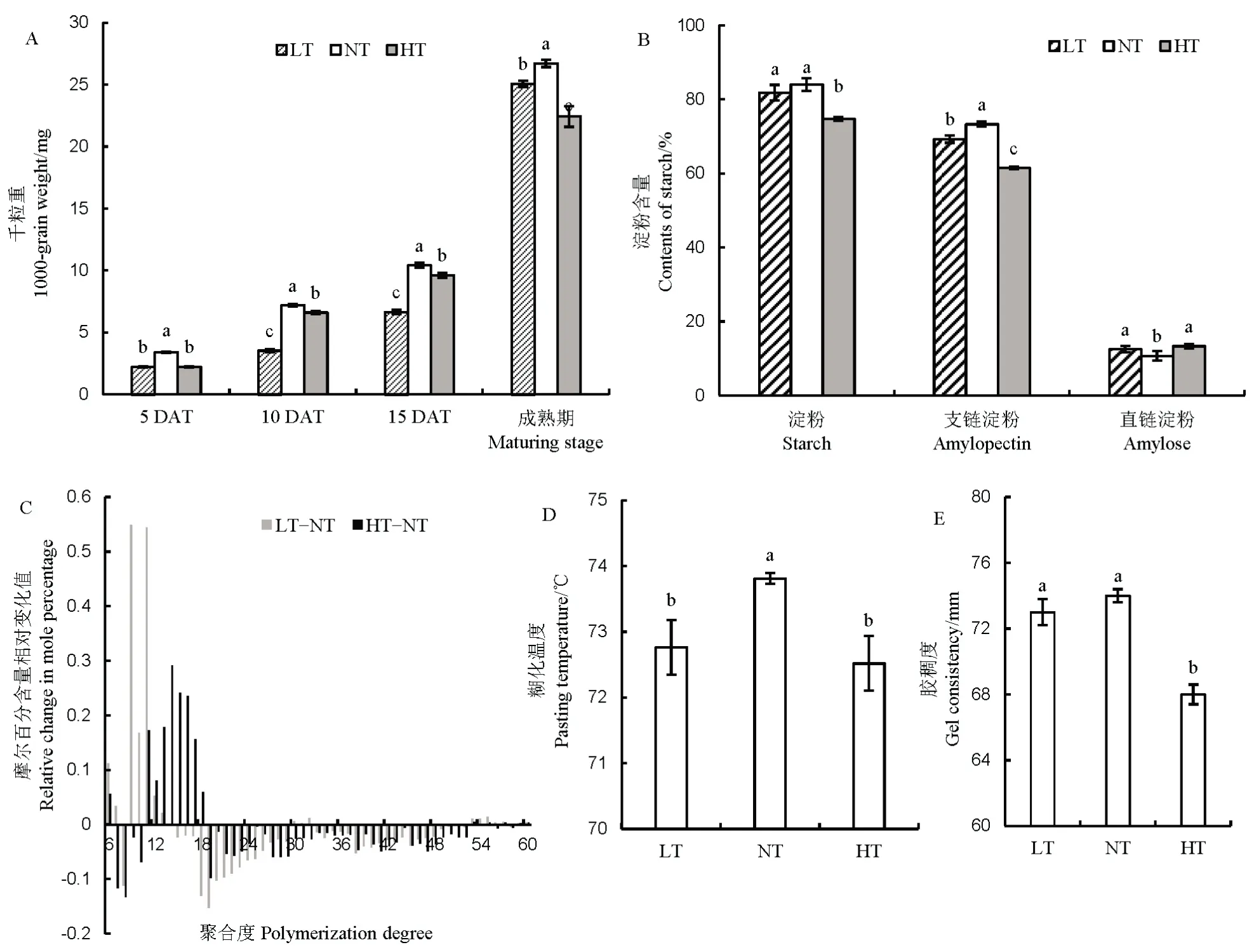
图1 不同夜温处理籽粒千粒重、淀粉含量、不同链长支链淀粉含量、糊化温度及胶稠度的比较Fig. 1. Comparison of 1000-grain weight, starch contents, amylopectin contents of different chain lengths, pasting temperature, and gel consistency of rice grain at different night temperatures.

表3 夜温处理对叶片净光合速率的影响Table 3. Comparison of leaf net photosynthetic rate under different night temperature treatments. μmol/(m2·s)
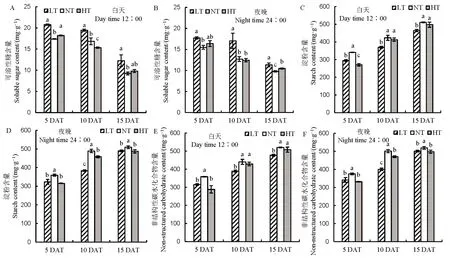
图2 不同夜温处理籽粒白天和夜间碳水化合物含量的比较Fig. 2. Comparison of carbohydrate accumulation in grain under different night temperature treatments.
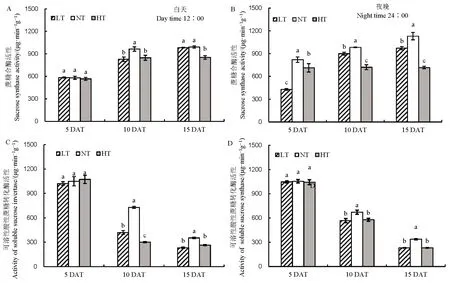
图4 不同夜温处理下蔗糖水解相关酶活性的比较Fig. 4. Comparison of sucrose hydrolysis-related enzymes under different night temperature treatments.
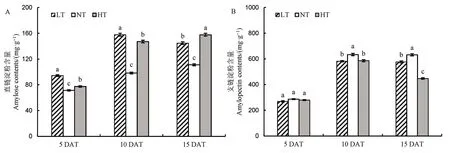
图5 不同夜温处理下直链淀粉和支链淀粉含量的比较Fig. 5. Comparison of amylose and amylopectin contents under different night temperature treatments.
随着处理时间的延长,与NT 相比,LT 和HT处理下直链淀粉含量显著增加,同时降低了支链淀粉含量,相对于NT,HT 处理下支链淀粉含量下降幅度大于LT(图5)。对直链淀粉形成关键酶活性进行分析,相对于NT 处理,白天 ADPG 含量在LT和HT 处理下呈现下降的趋势,然而夜温呈现的趋势相反,ADPG 含量相对于NT 显著增加。随着处理时间的延长,LT 和HT 处理ADP-葡萄糖焦磷酸化酶活性呈现下降的趋势,但3 个处理下ADP-葡萄糖焦磷酸化酶无显著差异。对颗粒结合淀粉合成酶进行分析,随着处理时间的延长,LT 和HT 处理的活性呈现下降的趋势,其中在夜间表现尤为明显(图 6)。对参与支链淀粉形成的关键酶可溶性淀粉合成酶、淀粉分支酶及淀粉脱分支酶活性进行分析(图7),发现夜温变化主要影响了夜间酶活,白天3种酶活性变化的趋势不明显,与NT 相比,随着处理时间的延长,3 种酶活性均呈显著降低的趋势。
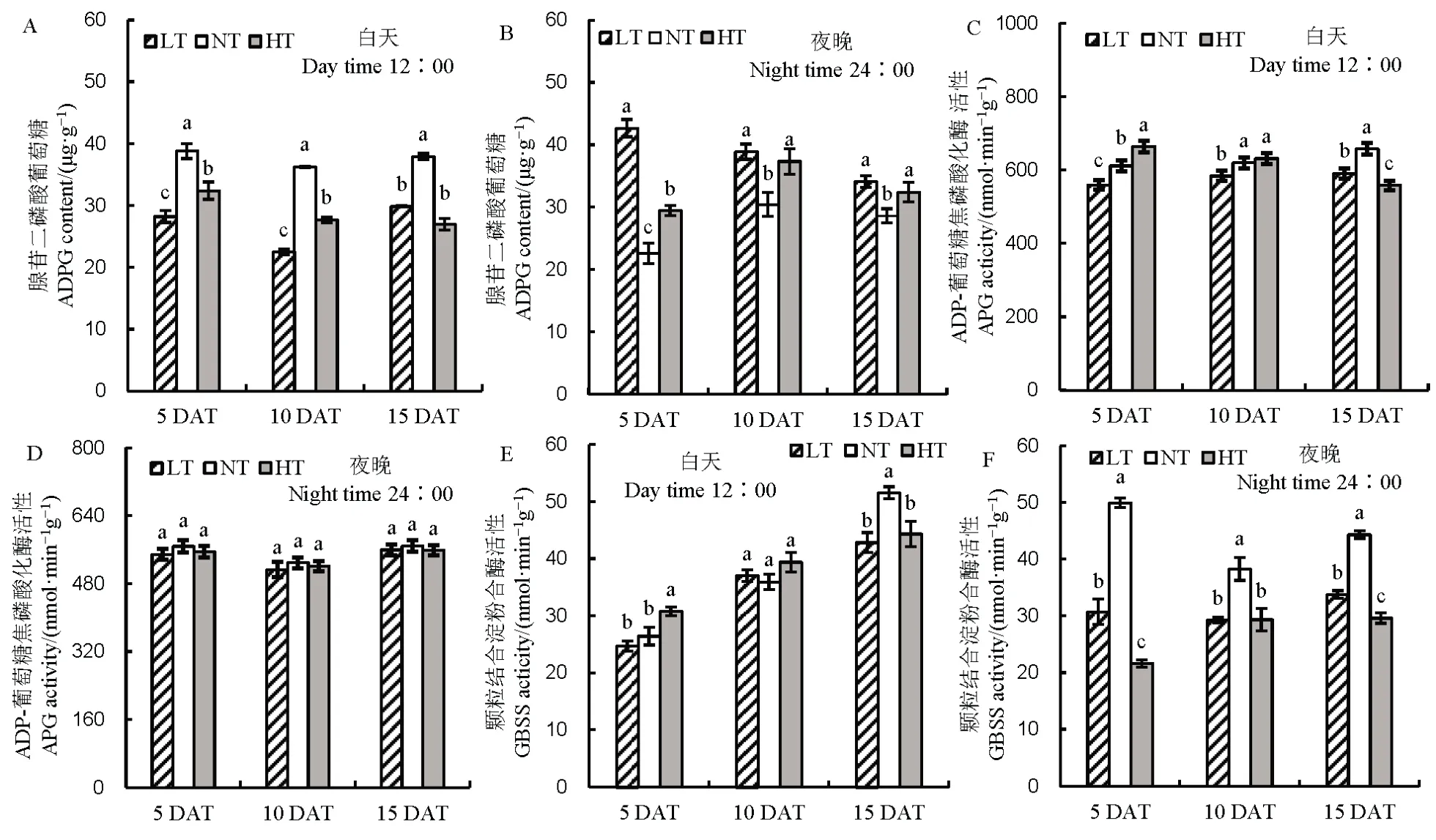
图6 不同夜温处理下直链淀粉合成相关酶活性的比较Fig. 6. Comparison of amylose synthase activity under different night temperature treatments.
2.4 夜温变化对淀粉水解的影响
籽粒碳水化合物含量也受到淀粉水解的影响。与NT 相比,无论白天还是夜晚,随着处理时间的延长,LT 和 HT 下淀粉水解酶活性增强,其中 ɑ-淀粉酶表现尤为明显。说明夜温降低或升高 4℃均会促进淀粉水解(图8)。
2.5 夜温变化对支链淀粉合成相关基因表达的影响
由图9 可知,对几个影响支链长度的关键基因进行表达量分析,夜温变化下,相关基因在白天表达量变化差异不明显,而在晚上基因表达量差异显著。随着处理时间的延长,与NT 相比,LT 和HT下OsSSI、OsSSIIa、OsSSIIIa和OsBEIIb的基因表达量呈下降的趋势。
3 讨论
3.1 夜温升高对粒重及淀粉结构的影响
本研究发现,夜温升高和降低均导致粒重降低。处理期间,夜温降低处理粒重显著低于适温和夜温升高处理(图 1-A),说明籽粒灌浆结实受到抑制,昼夜温差 7℃左右最有利于籽粒灌浆结实。在本研究条件下,夜间温度偏低或偏高出现胁迫现象,然而在成熟期HT 处理下粒重下降幅度最大,这可能与灌浆成熟期高温逼熟[19],以及低温抑制水稻籽粒灌浆有关[20],低温解除后,水稻籽粒灌浆有所恢复,这可能是成熟期HT 处理后粒重下降幅度较LT 处理低的重要原因。
然而,淀粉结构受LT 和HT 的影响没有恢复,处理后直链淀粉含量上升,导致糊化温度降低,这和前人的研究结果是一致的[21],同时糊化温度与支链淀粉短链数量(DP<12)负相关,与支链淀粉较长链数量(12
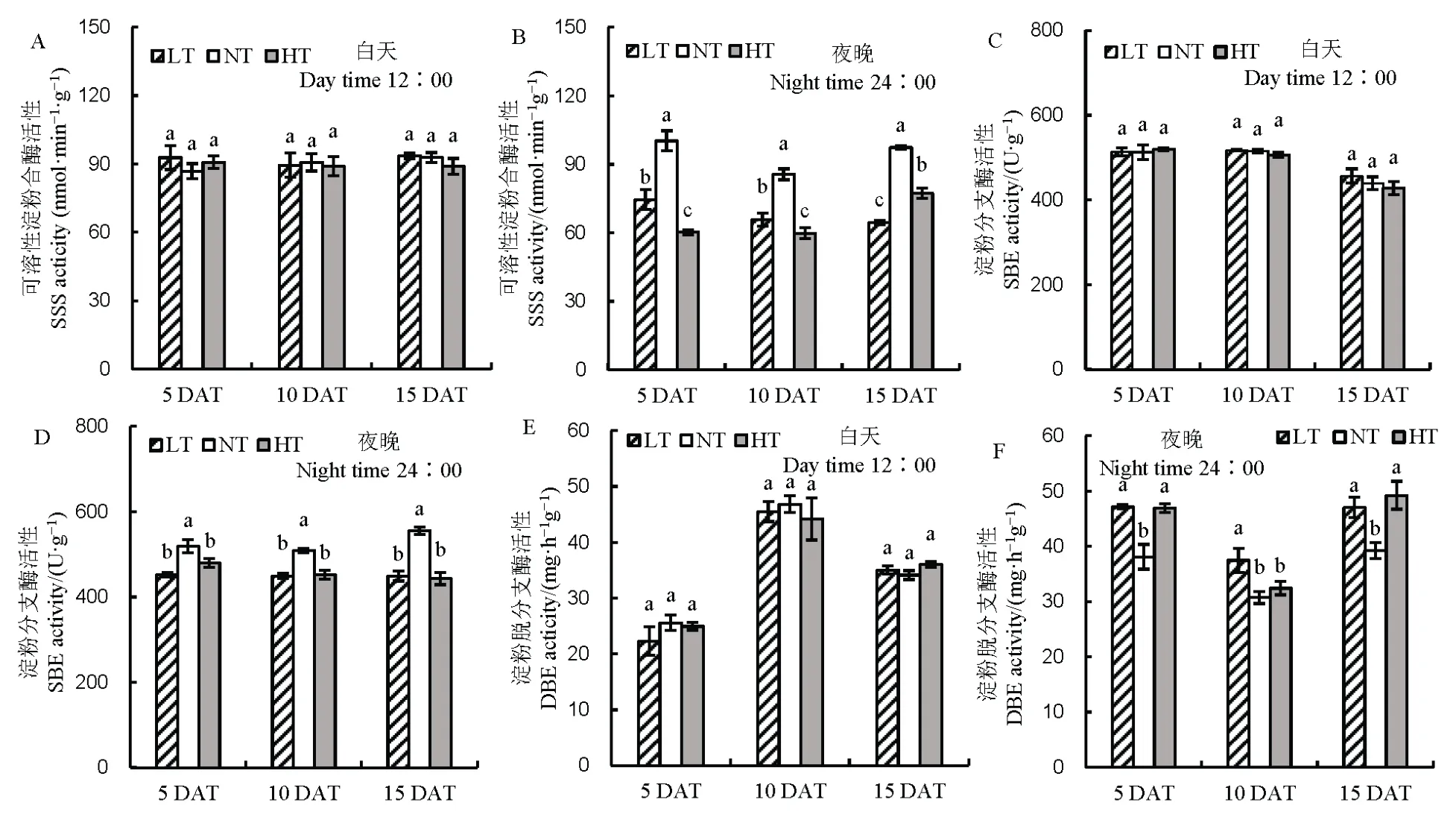
图7 不同夜温处理下支链淀粉形成相关酶活性的比较Fig. 7. Comparison of amylopectin formation-related enzyme activities under different night temperature treatments.
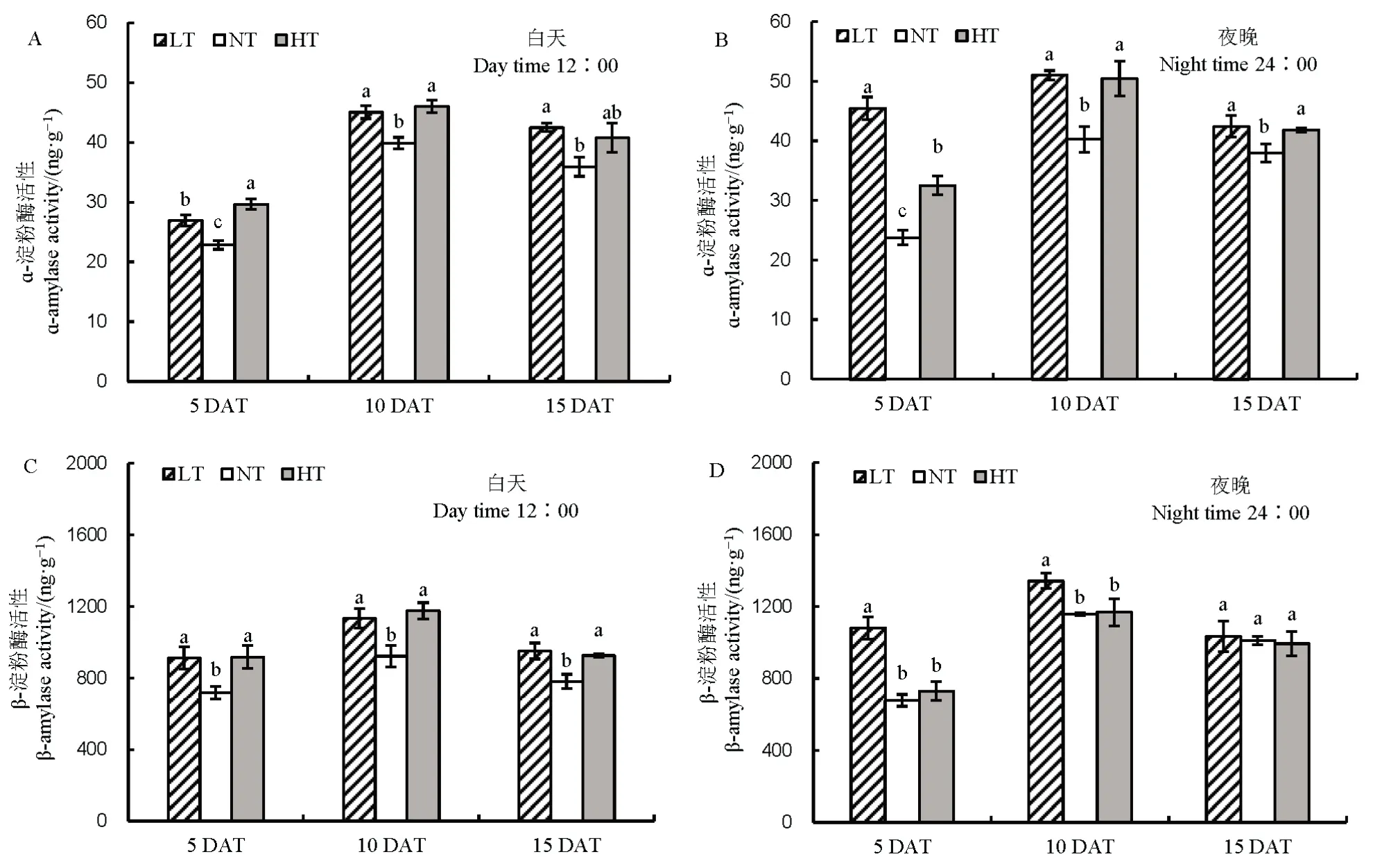
图8 不同夜温处理下淀粉水解相关酶活性的比较Fig. 8. Comparison of starch hydrolase-related enzyme activities under different night temperature treatments.
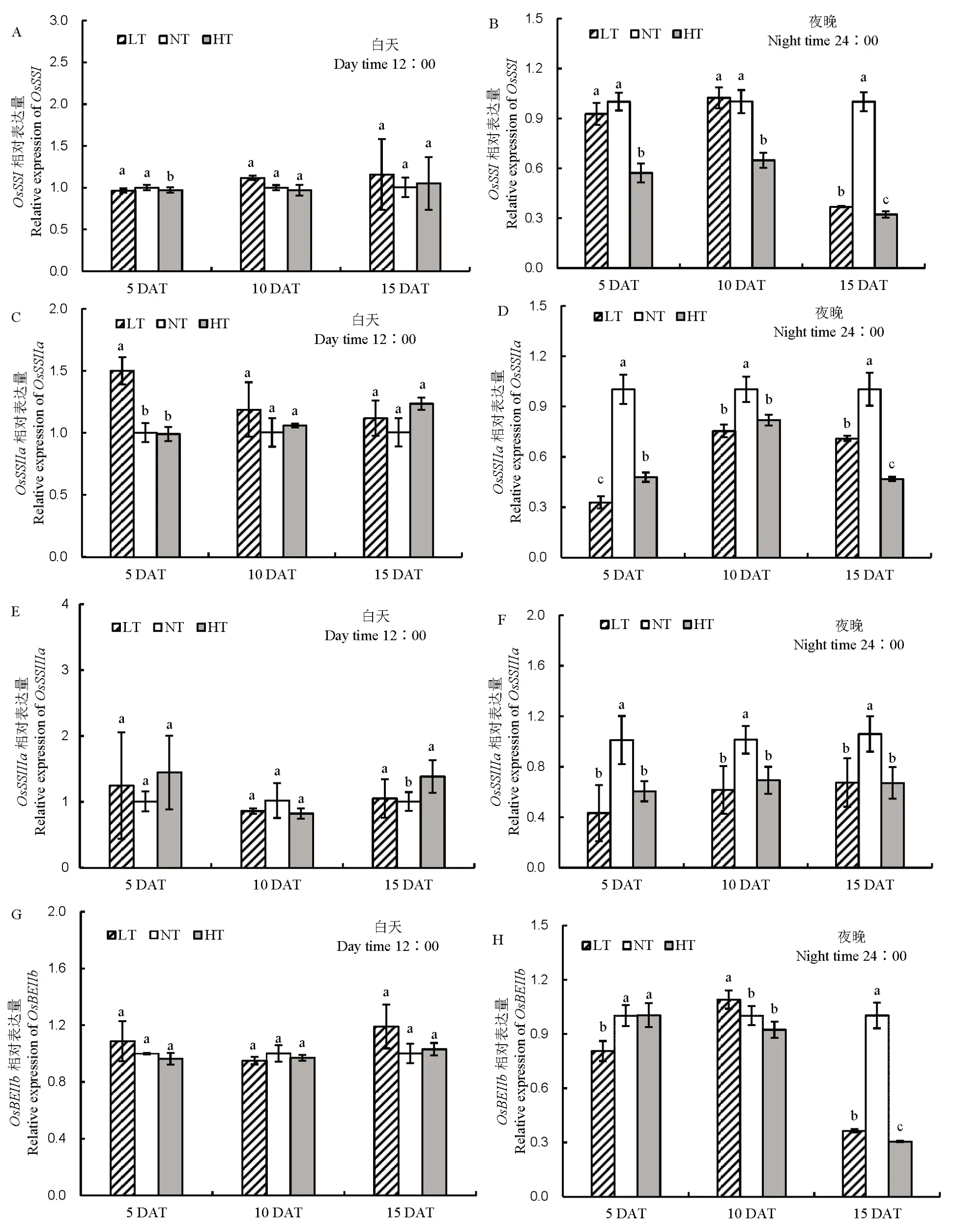
图9 不同夜温处理籽粒蔗糖转运基因表达量的比较Fig. 9. Comparison of sucrose transporter gene expression under different night temperatures.
3.2 夜温对淀粉积累昼夜变化的影响机理
籽粒积累主要来自于碳水化合物,依靠于光合同化,前期的研究发现,在灌浆初期,叶片光合作用主要受到温湿度的调控,并且由于蒸腾作用的存在,叶片的光合作用并不会受到胁迫作用,在本研究中,白天叶片光合作用所处温度是一致的,光合作用并没有受到大的影响,然而,随着处理时间的延长,夜间高温处理导致叶片净光合速率下降,叶片衰老加快[27],LT 和HT 处理籽粒非结构性碳水化合物含量在处理过程中要低于NT 处理,说明籽粒碳水化合物的积累受到抑制,对蔗糖转运的3 个基因OsSUT1、OsSUT2、OsSUT4进行分析发现,LT和HT 处理均抑制了基因的表达,且白天和夜晚的趋势是一致的,同时研究发现夜间低温和高温处理均降低了蔗糖卸载关键酶活性,说明蔗糖利用受阻,夜间高温和低温处理对蔗糖转运的抑制作用是不可逆的,可能是韧皮部结构受到了温度胁迫的伤害[28]。
张彩霞等[29]研究表明,白天高温处理籽粒淀粉积累受到抑制的主要原因是蔗糖分解受阻,外源蔗糖可以促进淀粉积累,夜温变化也抑制了淀粉形成相关酶活性,蔗糖是否能够调控淀粉合成相关酶活性有待深入研究。
分析发现,相对于NT 处理,LT 和HT 处理下可溶性糖含量有增加的趋势,一方面是由于蔗糖利用受阻,另一方面的原因可能与淀粉水解有关,LT和HT 处理导致白天和夜晚ɑ-淀粉酶和β-淀粉酶活性显著增加,促进淀粉水解,淀粉水解增加可溶性糖含量,可以增强抵御胁迫的能力[30],另一方面淀粉水解可能和呼吸作用增强有关[16]。
淀粉总量的积累依赖于碳水化合物的代谢,夜温的变化同时影响白天碳水化合物转运与卸载,产生的胁迫作用是不可逆的。然而,对淀粉合成相关酶进行分析发现,夜间温度升高或降低对直链淀粉和支链淀粉形成相关酶活性的改变主要在夜间产生作用,而在白天,几个淀粉合成相关酶活性变化并不明显,这可能是由于淀粉合成与积累主要在夜间进行有关,同时也间接说明,稻米品质的影响受夜温的影响要大于白天温度的升高。在直链淀粉形成过程中,NT 处理下,腺苷二磷酸葡萄糖的积累白天含量要高于夜晚,说明腺苷二磷酸葡萄糖的积累多在白天,研究发现LT 和HT 处理腺苷二磷酸葡萄糖含量在白天有降低的趋势,而在夜晚却显著升高,说明蔗糖利用受阻导致腺苷二磷酸葡萄糖含量下降,然而由于颗粒结合淀粉合酶活性受到显著抑制,导致腺苷二磷酸葡萄糖利用受阻,含量升高,但是,我们发现LT 和HT 处理导致直链淀粉含量升高,这和支链淀粉合成受到抑制有关,LT 和HT处理导致夜间可溶性淀粉合酶、淀粉分支酶和淀粉脱分支酶活性显著降低,而LT 和HT 处理对白天的酶活并没有显著的影响。前人研究指出,昼夜高温处理导致支链淀粉合成酶活降低[31-32],结合本研究的结果说明支链淀粉形成相关酶活性受温度的即时调控,即温度直接影响支链淀粉形成,尤其是夜间温度变化对其影响较大。前人研究指出,高直链淀粉含量的品种一般在高温下直链淀粉含量升高,低直链淀粉含量的品种则表现相反[33],而本研究选用软米为低直链淀粉品种,夜温升高或降低均导致直链淀粉含量增加,这可能与品种本身的直链淀粉合成特性有关,软米相对于常规品种的直链淀粉合成的差异需要进一步研究。
综上所述,夜温降低和升高抑制蔗糖转运与卸载,导致非结构性碳水化合物含量下降,同时促进淀粉水解,导致粒重和淀粉总积累量降低,且夜温升高对粒重和淀粉总量的影响大于夜温降低。直链淀粉含量升高的原因是支链淀粉形成受阻,支链淀粉合成相关酶活性在夜间受到抑制,酶活性在白天并没有受到影响,同时夜间低温和高温抑制链长相关基因表达。本研究条件下,夜温在24℃左右,平均温度在28℃左右最有利于淀粉积累,淀粉理化特性最佳,在实际生产过程中,根据水稻种植的不同区域,通过合理调整播期,使灌浆期处于上述气象条件,最有利于淀粉形成,提升稻米品质。
