CEA-TCB双特异性抗体cibisatamab增强T细胞对胃癌类器官的免疫杀伤作用*
2020-11-21胡艺冰米昱龙
颜 畅, 胡艺冰, 赵 晖, 米昱龙△
北京大学深圳医院 1胃肠外科 3甲乳外科,深圳 518036 2华中科技大学同济医学院附属同济医院分子医学中心,武汉 430030
胃癌是全球发病率第5和死亡率第3的恶性肿瘤[1]。血清癌胚抗原(carcinoembryonic antigen,CEA)是广泛应用于胃癌诊断、预后评估及胃癌复发和转移检测的重要肿瘤标志物[2-3]。T细胞CEA-TCB双特异性抗体cibisatamab是一种新型的免疫治疗药物,因其具有1个与T细胞上CD3结合的位点和2个与CEA结合的位点,使得cibisatamab可同时结合表达CEA的癌细胞和T细胞,增强效应T细胞对癌细胞的免疫杀伤[4]。有研究证实,cibisatamab是最有希望用于微卫星稳定的结直肠癌的免疫治疗药物之一[5],但关于cibisatamab在胃癌免疫治疗中的应用尚少见报道。与胃癌细胞株相比,胃癌来源的类器官(PDOs)更能代表患者肿瘤的异质性和生物学特性,且能在体外模拟与微环境组分间的相互作用[6-7]。本研究利用类器官模型观察cibisatamab在胃癌免疫治疗中的作用,并进一步探讨了胃癌对cibisatamab耐药的可能机制。
1 材料与方法
1.1 材料
胃癌标本取自华中科技大学同济医学院附属同济医院胃肠外科2018年1月~2018年5月收治的胃癌手术患者。术前均未进行放、化疗,术后病理诊断均为腺癌。实验动物为非肥胖性糖尿病联合免疫缺陷(non-obese diabetic/severe combined immunodeficiency,NOD/SCID)小鼠,4周龄,雌性,体重18~20 g,购自北京华阜康生物科技股份有限公司,于华中科技大学同济医学院实验动物学部SPF级动物中心饲养。类器官基础培养液为DMEM/F12培养液(美国Gibco公司)添加Wnt3a(100 ng/mL,美国Biotechne公司)、R-Sponding(1 μg/mL,美国Peprotech公司)、青链霉素(100 U/mL)、B27(美国Gibco公司)、N2(美国Gibco公司)、人表皮生长因子(EGF,50 ng/mL,美国Sigma公司)、胃泌素(Gastrin,10 nmol/L,美国Sigma公司)、A83-01(500 nmol/L,英国Tocris Bioscience公司)。干细胞培养液为DMEM/F12培养液添加青链霉素(100 U/mL)、人表皮生长因子(EGF,10 ng/mL)、B27和基础成纤维细胞生长因子(bFGF,10 ng/mL,美国Sigma公司)。CD8+T细胞培养液为RPMI 1640培养液(美国Gibco公司)添加青链霉素(100 U/mL)、胎牛血清(FBS,10%,美国Gibco公司)、IL-2(30 U/mL,美国Peprotech公司)和抗人CD3/CD28磁珠(美国Thermo公司)。基质胶(Matrigel,美国BD公司)。FITC标记的癌胚抗原抗体(CEA-FITC)及其同型对照(德国MiltenyiBiotec公司);APC标记的上皮特异性粘附分子(epithelial cell adhesion molecule,EpCAM)抗体(EpCAM-APC)及其同型对照(德国MiltenyiBiotec公司);FITC标记的CD8抗体(CD8-FITC)及其同型对照(德国MiltenyiBiotec公司);靶向抗体CEA-TCB(cibisatamab)和非靶向对照抗体DP47-TCB均购于罗氏制药公司(瑞士)。Annexin Ⅴ/7AAD细胞凋亡检测试剂盒(美国BD公司)。pLV-H2B-mCherry慢病毒由上海吉凯基因有限公司提供。PCR引物由本实验室设计,武汉擎科生物有限公司合成:GAPDH(正向5′-TCGTGGAAGGACTCATGACC-3′,反向5′-TCCACCACCCTTGTTGGCTGTA-3′);CD133(正向5′-GCCACCGCTCTAGA-TACTGC-3′,反向5′-TGTTGGTGATGGGGCTTGTCAT-3′);CD44(正向5′-AGCAACCAAGAGG-CAAGAAA-3′,反向5′-GTGTGGTTGAAATGGTGCTG-3′);Lgr5(正向5′-CTCCCAGGTCTGGGTGTGTTG-3′,反向5′-GAGGTCTAGGTT-AGGAGGTGAAG-3′)。流式细胞仪BD FACSAriaⅡ(美国BD公司)。
1.2 pLV-H2B-mCherry人胃癌类器官的建立
取新鲜胃癌手术标本,用含透明质酸酶(20 μg/mL)和Ⅳ型胶原酶(200~250 U/mL)的DMEM/F12培养液在37℃温箱内消化1 h,每10 min吹打1次;用红细胞裂解液裂解并去除红细胞后,细胞筛网(40 μm)过滤,收集细胞悬液以1200 r/min,离心5 min获得单细胞。将细胞用类器官基础培养液重悬并接种至6孔板,并加入海地美溴铵聚凝胺溶液(polybrene,美国Sigma公司)至终浓度为10 μg/mL,用感染复数(multiplicity of infection,MOI)为25的pLV-H2B-mCherry病毒感染细胞72 h。流式细胞仪分选出红色荧光阳性的细胞,并用基质胶(低生长因子无酚红型,1000细胞/30 μL)包被后接种至24孔培养板中(30 μL/孔),在37℃含5%CO2培养箱中放置10 min,待基质胶成形后,每孔加入500 μL类器官培养液,于37℃含5%CO2培养箱中培养7~14 d,苏木精-伊红染色和免疫荧光鉴定类器官的形态和来源。类器官的传代和扩增:加入0.25%的胰蛋白酶/EDTA在37℃下孵育15~20 min,并适当吹打,得到类器官单细胞悬液,PBS溶液稀释和洗涤后,重新接种至基质胶中进行类器官培养。待类器官连续传代2个月,明确其长期生存能力后,予以正式类器官编号(PDOx,x代表编号数),并进行后续实验。
1.3 流式细胞术检测及细胞分选
取健康供体外周血30 mL,经红细胞裂解液裂解并去除红细胞后,用PBS溶液洗涤重悬,加入CD8抗体孵育15 min,用流式细胞仪分离出CD8+T细胞,流式细胞仪检测CD8阳性细胞纯度大于99.5%。分离出的CD8+T细胞,体外扩增7 d后用于后续实验[8-9]。
取新鲜胃癌手术标本制成单细胞悬液(1×107/mL),取200 μL单细胞悬液加入2 μL CEA-FITC抗体,4℃避光孵育15 min,洗涤并重悬于200 μL PBS溶液,加入2 μL EpCAM-APC抗体,4℃避光孵育15 min,PBS洗涤、重悬后上流式检测EpCAM+细胞中CEA+和CEA-/lo细胞的比例[10]。
收集人胃癌类器官,消化为单细胞悬液后。用CEA抗体标记,同时设同型对照组,4℃避光孵育15 min,用PBS溶液洗3次后上机检测CEA表达情况。用流式分选出表达CEA的细胞(CEA+细胞)和不表达CEA的细胞(CEA-/lo细胞),流式细胞仪检测分选后细胞纯度大于99.5%[10]。
1.4 胃癌类器官细胞与CD8+T细胞共培养
人胃癌类器官消化成单细胞后,重悬于含10% FBS的RPMI培养液中,5000细胞/孔接种于96孔板中(Day 0),次日(Day 1)加入T细胞共培养(T细胞∶类器官细胞=2∶1),并分别给予不同处理[PBS,20 nmol/L非靶向对照抗体DP47-TCB或20 nmol/L靶向抗体CEA-TCB(cibisatamab)]。
1.5 胃癌类器官细胞增殖检测
感染H2B-mCherry慢病毒的肿瘤细胞,细胞核被标记红色荧光。类器官细胞与CD8+T细胞共培养后,通过计数带有红色荧光细胞的数量,评估类器官的增殖情况,从而避免CD8+T细胞的错误计入。类器官的生长评估为共培养后每2天以荧光显微镜拍照,通过Image Pro Plus软件分析红色荧光融合度,并通过Graphpad Prism软件绘制生长曲线。
1.6 细胞凋亡检测
用流式细胞术分选出表达CEA(CEA+细胞)和不表达CEA的胃癌类器官细胞(CEA-/lo细胞)后接种于6孔板中,加入T细胞(T细胞∶类器官细胞=2∶1)、20 nmol/L CEA-TCB双特异性抗体共培养48 h,收集细胞,用预冷的PBS洗细胞2遍;实验分为不染组、单染Annexin Ⅴ组、单染7AAD组以及7AAD和Annexin Ⅴ双染组;用PBS把4×结合缓冲液稀释到1×缓冲液,吸净离心管残余的PBS后,每管加入100 μL的1×结合缓冲液,用移液枪吹打细胞使细胞充分重悬,避光条件下加入染料。不染组不加,单染组加Annexin Ⅴ或7AAD 5 μL,Annexin Ⅴ和7AAD双染组加入Annexin Ⅴ和7AAD各5 μL,并用移液枪轻轻混匀;室温避光孵育15 min后,加入1×结合缓冲液300 μL,混匀后避光将细胞悬液转移到5 mL流式管中,1 h内在流式细胞仪上机检测。Annexin Ⅴ+/7AAD+与Annexin Ⅴ+/7AAD-两组相加即为凋亡细胞数。
1.7 成球实验及体内有限稀释实验
将2000个细胞接种于2 mL干细胞培养液,在超低吸附6孔板内,37℃、5%CO2培养箱中培养,9 d后计数细胞球体的数量。将细胞按数量梯度(10000、1000、100)分别重悬至50 μL PBS中,与基质胶1∶1混匀后,注射至NOD/SCID小鼠背部。接种6周后计数成瘤数量,并利用ELDA软件(http://bioinf.wehi.edu.au/software/elda/index.html)分析细胞亚群中可成瘤细胞数[6]。
1.8 荧光定量PCR(qPCR)
用Trizol一步法提取细胞RNA,经逆转录合成cDNA,加入前述设计合成的CD133、CD44、Lgr5和GAPDH引物,以荧光染料掺入法(SYBRgreen)进行PCR扩增,ABI7300检测各细胞亚群中CD133、CD44、Lgr5和GAPDH的Ct值,根据公式计算目的基因表达量。计算方式:改变的倍数(Fold Change)=2-ΔΔCt,ΔΔCt=(CEA-/lo细胞中目的基因Ct值-实验组GAPDH的Ct值)-(CEA+细胞目的基因Ct值-对照组GAPDH的Ct值)。
1.9 统计学方法
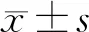
2 结果
2.1 人胃癌类器官中CEA表达的异质性
将人原代胃癌组织及其体外3D培养形成的类器官消化为单细胞悬液,采用流式细胞仪检测癌上皮细胞中CEA的表达,结果显示PDOs具有和亲代胃癌相似的CEA表达率,不同患者胃癌组织及其PDOs中CEA表达具有异质性(表1)。根据CEA的表达率和平均荧光强度,我们将PDOs分为低表达CEA组、高表达CEA组和中等CEA表达组。
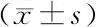
表1 人胃癌类器官及临床标本信息及CEA表达率Table 1 Clinical information and CEA expression rate of
2.2 不同人胃癌类器官对T细胞联合cibisatamab治疗的敏感性不同
分别用T细胞(PDO+T cells)、DP47-TCB联合T细胞(PDO+T cells+DP47-TCB)和cibisatamab联合T细胞(PDO+T cells+CEA-TCB)处理PDOs,用荧光显微镜定期监测红色荧光融合度(mCherry confluence)分析人胃癌类器官细胞的生长情况。结果显示,cibisatamab联合T细胞治疗能显著抑制CEA高表达的人胃癌类器官(PDO2、PDO4)生长,对CEA低表达的人胃癌类器官(PDO1)抑制能力弱,提示CEA表达率不同的胃癌类器官对T细胞联合cibisatamab治疗的敏感性不同(图1)。
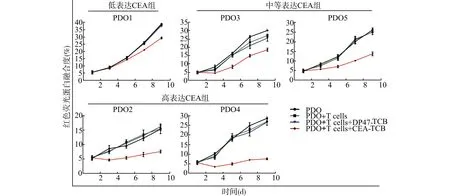
图1 人胃癌类器官细胞生长曲线Fig.1 Growth curves for all PDOs of gastric cancer
2.3 CEA-/lo细胞介导了T细胞联合cibisatamab治疗抵抗
将处理后残留的PDOs消化为单细胞悬液,用流式细胞仪检测PDOs中CEA的表达。结果显示,与其他各组相比,T细胞联合cibisatamab(PDO+T cells+CEA-TCB)作用后,PDOs中的CEA-/lo细胞比例均明显上升[PDO1:PDO+T cells(77.20±3.10)%,PDO+T cells+CEA-TCB(93.61±1.67)%;PDO3:PDO+T cells(57.51±4.59)%,PDO+T cells+CEA-TCB(91.43±1.09)%],差异均有统计学意义(均P<0.05),提示CEA-/lo细胞是导致治疗失败的细胞亚群(图2A)。通过流式细胞仪从PDO3和PDO5中分选出CEA-/lo及CEA+细胞,我们进一步分析了分选的CEA-/lo和CEA+细胞对T细胞和cibisatamab联合作用的敏感性。生长曲线显示,与CEA+细胞相比,CEA-/lo对T细胞联合cibisatamab作用敏感性更低(图2B)。此外,分选的CEA-/lo和CEA+细胞经T细胞和cibisatamab联合处理48 h后,流式细胞仪检测凋亡细胞显示,与CEA-/lo细胞相比[PDO3:PDO(4.98±0.66)%,PDO+T cells+CEA-TCB(6.22±0.70)%;PDO5:PDO(5.14±0.84)%,PDO+T cells+CEA-TCB(6.15±0.96)%],CEA+细胞经T细胞和cibisatamab联合处理后凋亡细胞比例更高[PDO3:PDO(5.11±0.87)%,PDO+T cells+CEA-TCB(24.53±1.99)%;PDO5:PDO(5.56±0.49)%,PDO+T cells+CEA-TCB(25.89±2.33)%],差异具有统计学意义(均P<0.01)(图2C)。进一步提示CEA-/lo细胞是对T细胞联合cibisatamab治疗耐药的细胞。
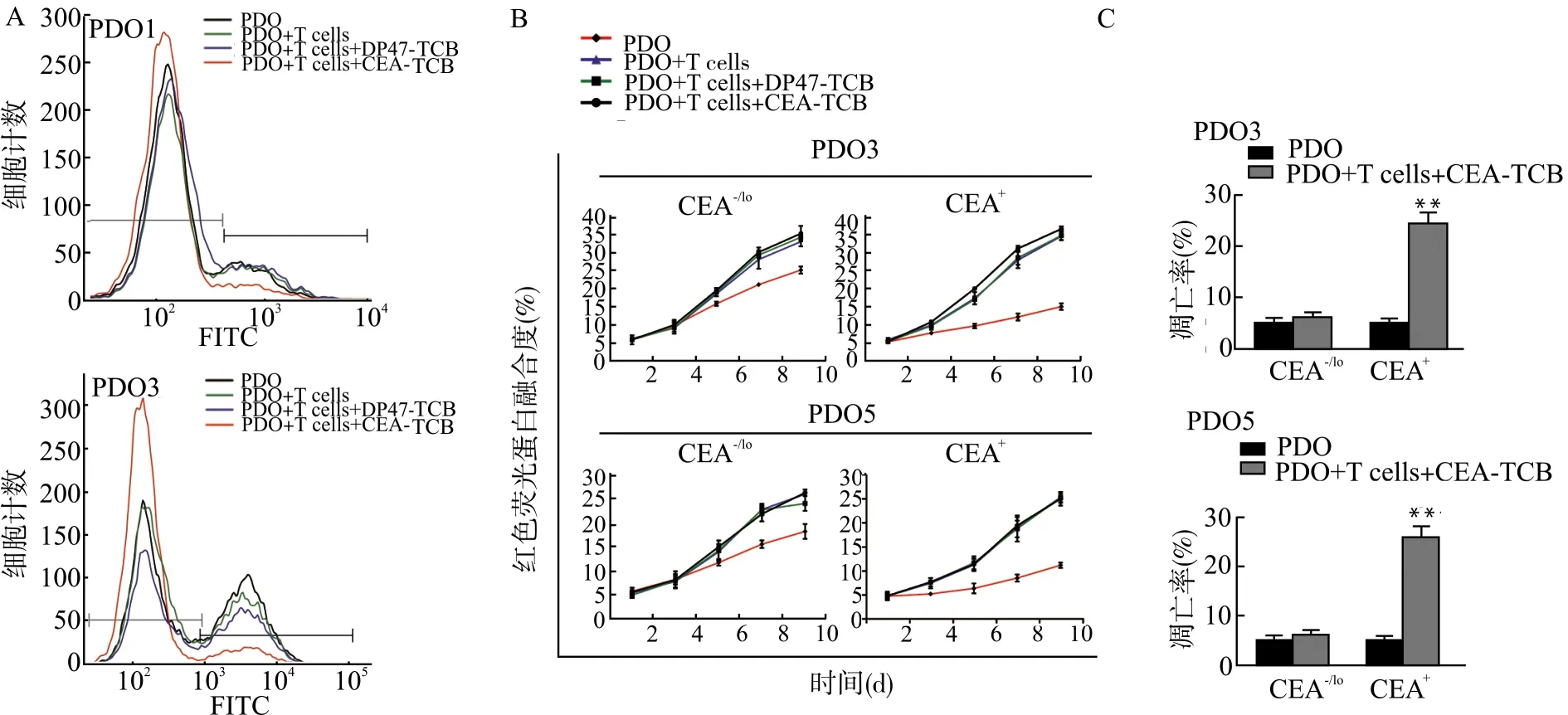
A:流式细胞术检测处理后残留的PDOs中CEA的表达;B:分选后PDOs细胞生长曲线;C:分选后PDOs细胞凋亡情况;与PDO组比较,**P<0.01图2 CEA-/lo细胞介导了T细胞联合cibisatamab治疗抵抗Fig.2 CEA-/lo cancer cells mediate the resistance to T cells plus cibisatamab
2.4 CEA-/lo细胞富集干细胞
选取CEA中等表达水平的人胃癌类器官(PDO3和PDO5),采用流式细胞仪分选出CEA-/lo和CEA+细胞。qPCR显示,CEA-/lo中CD133、CD44和Lgr5 mRNA的表达量均较CEA+显著升高,差异有统计学意义(均P<0.05,图3A),提示CEA-/lo较CEA+表达更高水平的CD133、CD44和Lgr5等肿瘤干细胞相关标记物。体外成球实验显示,CEA-/lo和CEA+细胞的成球率分别是(2.47±0.42)%、(1.93±0.31)%和(0.60±0.20)%,(0.50±0.10)%,差异有统计学意义(均P<0.01)(图3B),提示与CEA+细胞相比,CEA-/lo细胞有更强的自我更新能力。体内有限稀释成瘤实验显示,CEA-/lo富集更多可成瘤细胞(表2),以上证据显示,CEA-/lo胃癌细胞富集肿瘤干细胞。
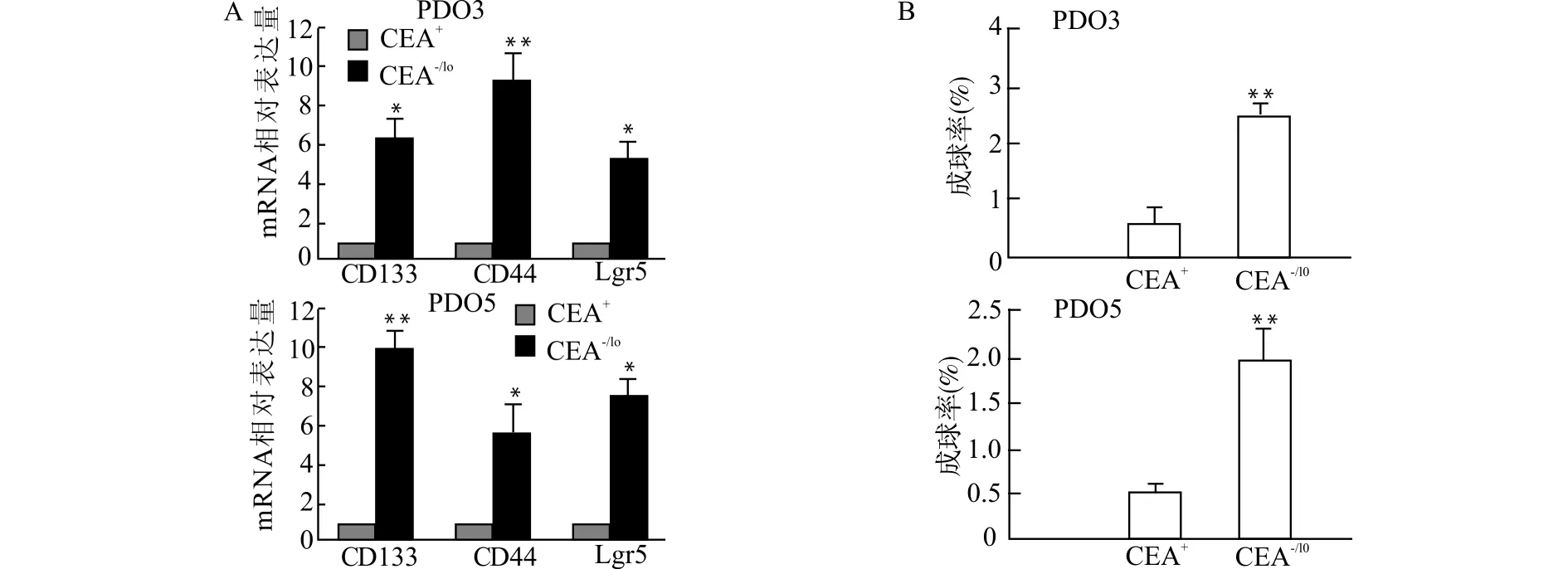
A:荧光定量PCR检测CEA+和CEA-/lo细胞中CD133、CD44和Lgr5的表达水平;B:体外成球实验检测CEA+和CEA-/lo细胞的自我更新能力;与CEA+比较,*P<0.05 **P<0.01图3 CEA-/lo细胞高表达肿瘤干细胞相关标记物并具有更强成球能力Fig.3 CEA-/lo cancer cells have higher expression of cancer stem cell related markers and higher capacity of sphere formation

表2 CEA-/lo和CEA+细胞体内有限稀释成瘤实验Table 2 Limiting dilution assays estimating tumor incidence of CEA-/lo and CEA+ cells
3 讨论
有研究报道,免疫检查点抑制疗法可提高某些肿瘤患者的存活率,其中包括高微卫星不稳定的胃癌。但是,免疫检查点抑制治疗的效果尚不佳,应答率仅10%至30%[11]。因此,开发新的免疫治疗方法或者综合治疗方法是非常重要的。
通过针对肿瘤细胞的双特异性抗体来重新定位并激活T细胞,而不依赖于它们的T细胞受体的特异性,是一种有效的治疗癌症的方法[12]。这一治疗方式是基于双特异性抗体可与肿瘤细胞表面的肿瘤抗原结合,并同时与T细胞上T细胞受体复合物内的CD3结合。这一过程可触发T细胞的激活,包括促进T细胞释放细胞毒性分子、细胞因子和趋化因子,以及诱导T细胞增殖[4-5,11-12]。cibisatamab具有1个与T细胞上CD3结合的位点和2个与CEA结合的位点,这使得cibisatamab可同时结合表达CEA的癌细胞和T细胞,增强效应T细胞对癌细胞的免疫杀伤作用,被用于治疗表达CEA的实体肿瘤,目前正处于Ⅰ期临床试验[4-5]。
胃癌也是可表达CEA的实体肿瘤,但CEA-TCB双抗体在胃癌中作用的研究尚未见报道。因此,本研究聚焦于T细胞联合CEA-TCB双特异性抗体cibisatamab对胃癌的作用。相比于肿瘤细胞株,肿瘤患者来源的类器官更能反映患者间的异质性和肿瘤内异质性,是新型的具备临床前(preclinic)应用探索和药物筛选前景的体外研究模型[6]。本研究建立人胃癌类器官,通过流式细胞仪分析,证实类器官培养条件下,不同胃癌样本的CEA表达存在异质性且与其亲代胃癌组织具有相似的CEA表达率。因此人胃癌类器官是研究T细胞联合CEA-TCB双抗联合治疗效果的有效体外模型。
通过分析CD8+T细胞联合cibisatamab对不同人胃癌类器官的效果,我们发现CEA低表达的人胃癌类器官细胞对这一作用反应更差,且联合治疗后,残留类器官肿瘤细胞中CEA-/lo细胞比例明显上升。进一步通过流式细胞仪分选出CEA-/lo和CEA+两群细胞,经耐药性检测、细胞凋亡检测、肿瘤干细胞标记物检测、体外成球实验及体内有限稀释实验,我们证实CEA-/lo细胞亚群对CD8+T细胞联合cibisatamab治疗抵抗且富集肿瘤干细胞。上述研究结果提示,在应用CEA-TCB双抗体对胃癌免疫治疗的同时,需开发可以有效靶向杀伤CEA-/lo细胞或促进其分化为CEA+细胞的手段,从而降低胃癌对CEA-TCB免疫治疗的抵抗,改善预后。
