结直肠癌中miR-330-3p-RUVBL1信号轴肿瘤细胞增殖、凋亡的影响*
2020-11-21黄开禹王向阳
黄开禹, 穆 磊, 王向阳, 王 辉△
1华中科技大学同济医学院附属武汉市中心医院胃肠外科,武汉 430014 2华中科技大学同济医学院附属同济医院胃肠外科,武汉 430030
结直肠癌(colorectal cancer,CRC)也称为结肠癌或肠癌,是一种由直肠或结肠发展而来的恶性肿瘤,是最常见的消化道恶性肿瘤之一,是世界上第3高发恶性肿瘤[1]。据GLOBOCAN估计,2020年结直肠癌新发病例将超过180万,死亡人数将超过1000万[2]。近10年来,随着科学技术和医疗水平的不断进步,全球范围内结直肠癌的发病率和死亡率基本稳定,但是在全球恶性肿瘤发病及死亡人数中所占的比例却有所增加。结直肠癌发病的地域分布差异较大,其中发达地区结直肠癌发病率与死亡率均较高,我国是结直肠癌的低发区,但其发病率呈现逐年上升的趋势[3],结直肠癌已然成为我国重要的公共卫生问题之一。在过去的10年中,由于新的化疗药物和靶向治疗的发展,转移性结直肠癌患者的临床结果有所改善,患者的中位总生存期约为30个月[4]。但是化疗依然存在较明显的不良反应,且仍有大量患者出现治疗失败、复发和远端转移等情况[5],因此,有必要寻找更好的生物学标志物以利于结直肠癌的早期诊断和预测患者的预后。RUVBL1蛋白是一种AAA+ATP酶,研究表明,该蛋白参与DNA修复、基因转录调控等过程,与肿瘤的进展和转移密切相关[6-8]。但RUVBL1在结直肠癌的发生、发展中起何种作用,尚未完全阐明。Oncomine数据库是当前世界上最大的肿瘤基因芯片数据库和整合数据提取平台,本研究利用Oncomine数据库分析CRC中RUVBL1的表达情况,利用在线Starbase数据库预测出miR-330-3p与下游RUVBL1 mRNA存在明显偶联结合,采用双荧光素酶基因法验证RUVBL1与miR-330-3p的靶向关系,进而研究miR-330-3p-RUVBL1信号轴对CRC细胞增殖、凋亡的影响,以期在CRC的综合治疗方面提供一些思路。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂 人结直肠癌HT-29细胞购自中国科学院细胞库。胎牛血清购自北京百奥莱博科技有限公司;RPMI-1640培养液及青霉素-链霉素双抗试剂购自杭州吉诺生物医药技术有限公司;小鼠单克隆抗体Bcl-2、Bax、cleaved-Caspase-3、β-actin、GAPDH均购自美国Cell Signaling Technology公司;逆转录试剂盒购自TransGen公司;RT-PCR试剂盒、Western blot试剂盒以及LipofectamineTM2000转染试剂均购自赛默飞世尔科技(中国)有限公司;其他试剂均为化学分析纯。
1.1.2 实验仪器 细胞计数器(美国Nexcelom Bioscience LLC公司);紫外分光光度计(美国NanoDrop公司);倒置显微镜(日本OLYMPUS公司,型号IX81);流式细胞仪(美国Beckman Coulter公司);往复式水浴摇床(上海智诚分析仪器制造公司,型号ZHEY-110X30);图像分析仪(以色列Dinco公司);化学发光仪(上海天能科技有限公司)。
1.2 实验方法
1.2.1 Oncomine数据库提取数据 Oncomine是一个癌症微阵列数据库和基于网络的数据挖掘平台,旨在激发全基因组表达分析的新发现,并将大多数癌症类型的转录组数据与各自的正常组织进行比较。Oncomine数据库(http://www.oncomine.org)包含35种癌症类型的264个独立数据集,并支持各种分析方法,包括分子概念分析、相互作用组分析和荟萃分析[6]。我们采用Oncomine数据库分析RUVBL1 mRNA在CRC患者中的表达,设定的筛选条件为,Gene:RUVBL1;Analysis Type:Differential Analysis,Cancervs.Cancer Analysis,Cancervs.Normal Analysis;Cancer Type:Colorectal Adenocarcinoma;Sample Type:Clinical Specimen;Data Type:mRNA。在候选结果中根据需要选择呈现形式,显示RUVBL1 mRNA在CRC组织和正常组织之间表达的倍数关系、P值等。根据纳入样本RUVBL1的表达水平的(中位数)进行分组,高于该中位数的为高表达,低于该数值的为低表达。
1.2.2 Starbase数据库提取数据 从Starbase数据库(http://starbase.sysu.edu.cn)中的Pan-Cancer模块分析中选择“Gene Differential Expression”,以“RUVBL1”为关键词进行检索,得到RUVBL1在结直肠癌中的表达数据。
1.2.3 临床标本收集 收集武汉市中心医院从2018年1月至2019年1月的CRC患者资料,纳入56名没有其他影响实验结果疾病的CRC患者。在手术过程中收集肿瘤标本和邻近正常组织。组织样本由经验丰富的病理医生根据世界卫生组织制定的分类指南进行定义。所有参与者均签署知情同意书,本研究得到武汉市中心医院伦理委员会的批准。收集的临床标本一部分制备冰冻切片行免疫组化检查;余下标本液氮冻存后,留作荧光定量聚合酶链式反应用。
1.2.4 HT-29细胞培养 采用RPMI-1640培养液(含10%灭活的新生牛血清、100 U/mL青霉素和100 μg/mL链霉素)在37℃、5% CO2、饱和湿度的条件下培养HT-29细胞,每隔2天换培养液,再用含EDTA的0.25%胰蛋白酶溶液进行常规消化和传代,选取对数生长期细胞进行后续实验。
1.2.5 miR-330-3p过表达或沉默 根据说明书构建miR-330-3p过表达载体(miR-330-3p mimic)。选取对数生长期的人结直肠癌HT-29细胞,采用胰酶消化后,将2 mL细胞悬液接种到6孔板(细胞密度为1×105个/mL),于37℃、5% CO2培养箱培养24 h,将细胞分为3组:Control组(转染空载体)、miR-330-3p mimic组(转染miR-330-3p过表达载体)、miR-330-3p inhibitor组(转染miR-330-3p沉默载体)。相关序列,miR-330-3p inhibitor sence:5′-UCUCUGCAGGCCGUGUGCUUUGC-3′;miR-330-3p mimic sence:5′-GCAAAGCACACGGCCUGCA-GAGA-3′;control sence:5′-GAGUACUUUUGUGUAGUACAA-3′。按照LipofectamineTM2000转染试剂说明书方法进行转染,转染48 h后置于荧光显微镜下观察转染效果。
1.2.6 双荧光素酶报告基因检测验证RUVBL1与miR-330-3p间的关联 以U6作为内参,根据说明书构建含有人野生型RUVBL1 mRNA 3′非编码区(3′UTR)序列和突变型RUVBL1 mRNA 3′UTR序列的双荧光素酶报告基因质粒:RUVBL1 mRNA 3′UTR wild和RUVBL1 mRNA 3′UTR mut。利用LipofectamineTM2000将miR-330-3p inhibitor及miR-330-3p mimic和2种质粒分别共转染细胞,转染后48 h采用双荧光素酶报告基因检测试剂盒检测萤火虫荧光素酶和海肾荧光素酶活性。结果用萤火虫荧光素酶活性/海肾荧光素酶活性比值表示,实验重复3次。
1.2.7 CCK-8试剂盒检测细胞增殖 将各组HT-29细胞调整为1×106个/mL,于96孔板中每孔添加100 μL细胞悬液,同一标本做3个重复,37℃培养箱中静置4 h,每孔加入10 μL CCK8后混匀,培养4 h,用酶标仪测定450 nm处吸光度值(A450 nm),按照公式细胞活力(%)=(实验孔A450 nm-空白孔A450 nm)/(对照孔A450 nm-空白孔A450 nm)100%计算细胞活力。
1.2.8 流式细胞术检测细胞凋亡 取对数期生长的HT-29细胞,用胰蛋白酶消化细胞,500×g离心5 min,弃去上清液,收集细胞沉淀。细胞沉淀用冰冷的PBS洗涤3次。离心弃去上清,细胞沉淀用75%乙醇4℃固定4 h,弃去固定液,用Annexin缓冲液重悬细胞。用400目的筛网过滤1次,500×g离心5 min,弃去上清,细胞沉淀加入5 μL稀释的AnnexinⅤ-APC工作液在冰上孵育15~18 min,再加入5 μL稀释的7AAD工作液对细胞进行复染,上流式细胞仪检测细胞凋亡。
1.2.9 免疫组化法检测RUVBL1蛋白表达 将手术采集的CRC患者组织标本以10%中性甲醛溶液固定,石蜡包埋,4 μm连续切片。将组织切片放置在显微镜载玻片上,在二甲苯中脱脂并在梯度乙醇和蒸馏水中再水合,用100 μg/mL蛋白酶K在0.6 mol/L Tris(pH 7.5)/0.1% CaCl2中处理切片15 min,用3%的过氧化氢酶在甲醇和PowerBlock溶液分别封闭内源性过氧化物酶活性和非特异性抗原10 min。以兔抗人RUVBL1单克隆抗体为一抗,采用Envision法进行免疫组化检测,严格按照试剂盒步骤进行检测,经高压锅高温修复抗原,DAB显色,苏木精复染,随后进行中性树胶封片处理。
1.2.10 荧光定量聚合酶链式反应(qRT-PCR)检测miR-330-3p 将对数生长期的HT-29细胞接种于孔板中,细胞密度为2.5×104/mL,500×g离心5 min收集细胞沉淀,用Trizol试剂盒提取细胞总RNA,采用紫外分光光度计在260 nm处检测RNA的纯度。按照逆转录以及PCR试剂盒的操作步骤进行反转录及实时荧光定量PCR反应。PCR反应条件为:94℃预变性5 min,40次扩增(96℃变性30 s,60℃退火40 s,72℃延伸1 min),72℃延伸10 min。以β-actin为内部参照,用Opticon Monitor 3软件对PCR结果进行分析。实验重复3次后计算平均值。
1.2.11 Western blot检测 收集对数生长期的HT-29细胞于EP管中,500×g离心5 min收集细胞沉淀,然后用RIPA裂解缓冲液裂解,用BCA蛋白检测试剂盒测定裂解物中的蛋白质浓度,采用10% SDS-PAGE电泳分离100 μg总蛋白,并将其转移到PVDF膜上。在室温下将膜在5%的牛奶中封闭1 h,加入下列抗体在4℃的TBST中孵育过夜:抗Bcl-2(1∶1000),抗Bax(1∶1000),抗cleaved-Caspase-3(1∶500),抗β-actin(1∶500)和抗GAPDH(1∶500)。用PBST洗涤3次后,用荧光标记的二级抗体(1∶200)孵育膜,化学发光法检测,并用Quantity one软件进行图像分析。
1.3 统计学分析
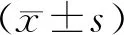
2 结果
2.1 Oncomine数据库显示RUVBL1在肿瘤中的表达情况
从Oncomine数据库中共收集到397项关于RUVBL1在不同类型肿瘤中表达情况的研究结果(图1),其中结果有统计学差异的研究有32项,RUVBL1表达增高的研究有24项,表达降低的研究有8项。

图1 RUVBL1在所有肿瘤中的表达Fig.1 Expression of RUVBL1 in all tumors
2.2 RUVBL1在结直肠癌中高表达
在Oncomine数据库中,自2004年起共有16项含458例结直肠腺癌(colorectal adenocarcinoma,COAD)患者的研究涉及RUVBL1在结直肠癌组织和正常组织中的表达,其中有mRNA测量数据的450例为癌组织,8例为正常结肠组织。荟萃16项研究结果发现,与正常组织相比,RUVBL1在结直肠癌组织中的表达明显升高(图2)。
对收集的人CRC临床标本进行Western blot检测,结果显示,相对正常结直肠组织,RUVBL1在CRC中呈明显的高表达(P<0.01,图3A,3B)。免疫组化染色发现,CRC组织呈明显RUVBL1强阳性染色,而且在结肠低级别上皮内瘤变、高级别上皮内瘤变组织中也呈RUVBL1阳性染色,表达强度低于CRC组,说明RUVBL1在结直肠癌前病变中即出现表达升高的趋势,与肿瘤的进展存在明显的相关性(P<0.05,图3C、3D)。

图2 Oncomine数据库中RUVBL1在结直肠腺癌中的表达Fig.2 Expression of RUVBL1 in colorectal adenocarcinoma in Oncomine database
A、B:Western blot分析RUVBL1在CRC患者癌组织和正常组织中的表达,N:正常组织,T:CRC患者癌组织,1~4为患者编号;C:免疫组化分析RUVBL1在结肠癌前病变、癌组织中的差异表达(×400),LGIN:低级别上皮内瘤变(low grade intraepithelial neoplasia),HGIN:高级别上皮内瘤变(high grade intraepithelial neoplasia);D:免疫组化结果统计,*P<0.05 **P<0.01图3 RUVBL1在结肠癌中表达分析Fig.3 Expression analysis of RUVBL1 in colorectal cancer
2.3 RUVBL1基因的表达水平与结直肠癌患者生存预后的关系
通过Oncomine数据库挖掘的信息,我们发现RUVBL1在CRC中表达升高,为了进一步明确RUVBL1表达与结直肠癌预后之间的关系,在458例COAD患者临床资料中,剔除手术后生存时间未知的6例、术后0生存时间的2例以及只有mRNA测序而临床资料不全的3例,最终纳入447例COAD患者,利用Kaplan-Meier分析进行生存分析。结果发现RUVBL1基因的表达水平与结直肠癌患者生存预后之间存在相关性,低表达RUVBL1的患者预后较好(P=0.0077,图4)。
2.4 RUVBL1与miR-330-3p的靶向关系
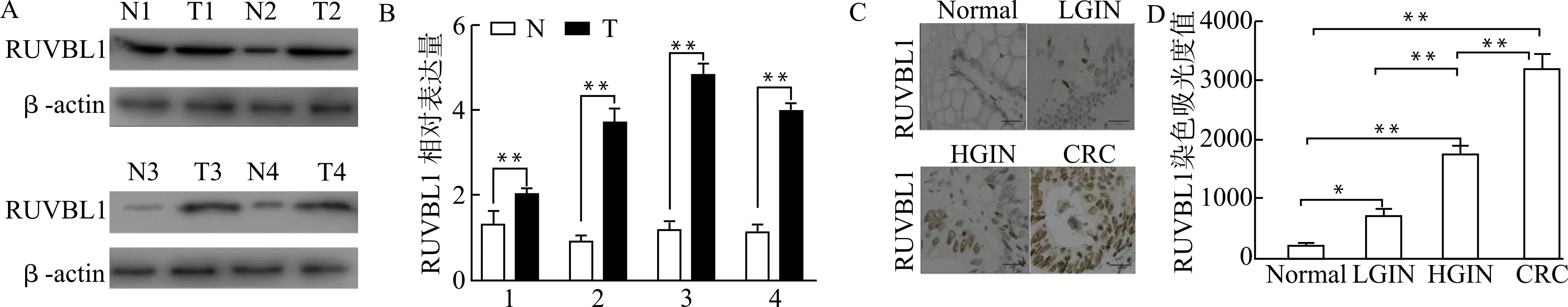
通过在线Starbase数据库分析TCGA来源的结直肠癌中miR-330-3p的表达,预测出miR-330-3p与下游RUVBL1 mRNA存在明显偶联结合位点。我们通过Oncomine数据库挖掘的CRC患者数据,对其癌组织和正常组织进行分析,结果发现miR-330-3p在CRC组织中的表达水平明显低于正常结直肠组织(图5A)。在我们收集的临床标本中,miR-330-3p在癌组织中也呈现低表达(P<0.01,图5B)。利用双荧光素酶报告基因实验证实了miR-330-3p与RUVBL1的靶向调控关系(图5C、5D)。在结直肠癌细胞HT-29中转染miR-330-3p mimics能够明显抑制细胞RUVBL1蛋白的表达,而miR-330-3p inhibitor能够促进RUVBL1表达(图5E)。

图4 不同RUVBL1表达水平COAD患者的生存分析Fig.4 Survival analysis of COAD patients with different RUVBL1 expression levels
A:Starbase数据库在线分析COAD与正常结直肠组织中miR-33-3p表达差异(n=458);B:qRT-PCR分析临床CRC与正常结直肠组织标本中miR-330-3p的表达差异(n=56);C:Starbase在线预测miR-330-3p与RUVBL1偶联位点;D:荧光素酶报告基因实验结果;E:HT-29细胞转染miR-330-3p mimics、miR-330-3p inhibitor,Western blot分析RUVBL1蛋白表达;**P<0.01图5 RUVBL1与miR-330-3p的靶向关系Fig.5 Targeting relationship between RUVBL1 and miR-330-3p
2.5 miR-330-3p促进结直肠癌细胞HT-29的凋亡,增加其对顺铂的化疗敏感性
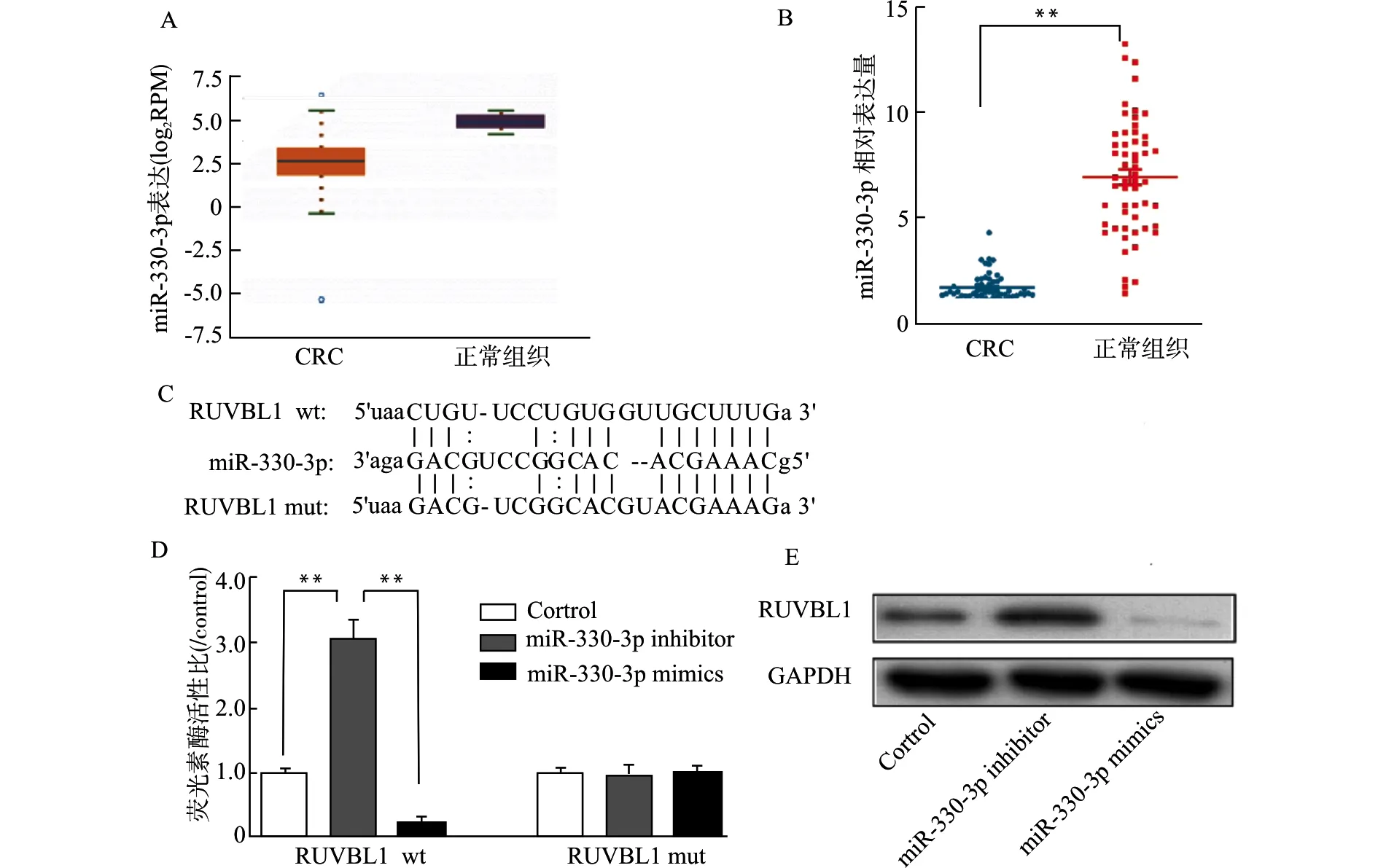
我们进一步观察miR-330-3p是否能够影响HT-29细胞对顺铂的化疗敏感性。在HT-29细胞中转染miR-330-3p mimics,对照组为对照载体转染,转染24 h后给予细胞不同浓度的顺铂处理,继续培养72 h后通过CCK-8测定细胞活力。我们发现miR-330-3p mimics转染能够显著上调HT-29细胞对顺铂的化疗敏感性(P<0.01,图6A)。
进一步观察miR-330-3p是否参与结肠癌细胞的凋亡调控,图6B流式凋亡分析证实miR-330-3p mimics转染能够促进HT-29细胞凋亡,在转染24 h后即出现明显的细胞凋亡。而Western blot分析凋亡相关蛋白发现,miR-330-3p mimics转染后HT-29细胞内Bax、cleaved-Caspase-3的蛋白表达水平均上调,而Bcl-2表达水平下降(图6C)。
A:CCK-8测定HT-29细胞活力;B:流式细胞术测定HT-29细胞凋亡结果统计;C.Western blot分析细胞凋亡相关蛋白表达;*P<0.05,**P<0.01图6 miR-330-3p促进HT-29细胞的凋亡及对顺铂的敏感性Fig.6 miR-330-3p promotes apoptosis of colorectal HT-29 cells and sensitivity to cisplatinum
3 讨论
RUVBL1是一种高度保守的AAA+ATPase,主要负责ATP结合和水解[9],在细胞的代谢、组蛋白乙酰化以及DNA损伤修复等方面起重要作用。研究显示,RUVBL1是Tcf/Lef的协同激活因子,多数与RUVBL2组成复合物拮抗β-catenin的信号传导。此外,RUVBL1还是多种基因转录的协同激活因子,包括抑制肿瘤转移的肿瘤抑制基因KAI1[10]。它在促进肿瘤抑制基因转录的同时,促进β-catenin介导的肿瘤转化,从而促进ITF2基因启动子区域的组蛋白H4乙酰化,并增强TCF4的转录活性[11]。Haurie等[12]研究发现ShRUVBL1可减弱骨肉瘤细胞系中MYO10诱导的表型,而RUVBL1作为广泛报道的癌基因,被发现能在骨肉瘤细胞系SAOS-2中促进突变型p53的功能获得。综上表明RUVBL1在肿瘤的进展中起着重要作用,与癌症患者的预后密切相关[12-13]。尽管RUVBL1在CRC中的研究较少,但根据其在骨肉瘤细胞系SAOS-2中能促进突变型p53功能的作用,推测其在CRC发生中也可能起到类似作用[14],RUVBL1能否成为结直肠癌的诊断标志物和治疗靶点值得进一步研究。
microRNAs(miRNAs)是一类内源性的、短链(19~22个核苷酸)、非编码的单链RNA,是基因表达的负性调节因子,已有的研究显示,其调控关键的生物过程,如细胞增殖、凋亡、分化以及血管生成,还通过作为癌基因或肿瘤抑制基因而参与各种癌症的发病过程[15]。越来越多的研究表明miRNAs与各种形式的肿瘤发生有关[16]。miR-330-3p是miR-330的主要亚型之一,有研究表明miR-330-3p在多种肿瘤的发生发展中起重要作用,如Arora等[17]发现在非小细胞肺癌(NSCLC)患者中miR-330-3p的表达在脑转移患者明显高于无脑转移的患者;Liu等[18]证实miR-330-3p在NSCLC组织和脑转移组织中表达上调,miR-330-3p过表达可通过靶向EGR2促进NSCLC细胞周期分布和增殖;Meng等[19]发现miR-330-3p在食管鳞状细胞癌(ESCC)肿瘤组织和ESCC细胞系中高表达,过度表达miR-330-3p在体外可显著增强ESCC细胞的增殖、存活、迁移和侵袭。然而,miR-330-3p在CRC中的作用仍然未知。
本研究中,我们利用Oncomine在线数据库的mRNA表达数据进行在线分析,以P<0.0001,表达异常的倍数大2倍的限定条件,选择正常组织与结直肠癌组织的对比数据,发现与正常组织相比,RUVBL1在CRC呈现高表达,临床CRC标本免疫组化结果亦证实该结论,而高表达RUVBL1的患者术后总体生存率低于低表达RUVBL1的患者,这些均提示RUVBL1在CRC的发展中起重要作用。考虑到miR-330-3p在多种肿瘤的发生发展中起着重要作用,那么RUVBL1与miR-330-3p之间有无上下游靶向关系?随后我们利用Starbase数据库,发现RUVBL1是miR-330-3p的潜在靶点,双荧光素酶报告基因检测验证了RUVBL1与miR-330-3p的靶向关系。随后利用miR-330-3p mimic和inhibitor转染HT-29细胞发现,当过表达miR-330-3p时,RUVBL1蛋白表达水平降低;沉默miR-330-3p时,RUVBL1和蛋白表达水平明显升高,这些结果提示,RUVBL1是miR-330-3p的直接靶标。而且,与正常结直肠组织比较,miR-330-3p在结直肠癌组织中的表达明显下调,与上述实验结果一致。在后续的凋亡增殖实验中,我们又发现,过表达miR-330-3p HT-29细胞增殖受抑制,细胞凋亡增加,细胞内促凋亡蛋白Bax、cleaved-Caspase-3的蛋白表达水平均上调,而Bcl-2表达水平下调,提示miR-330-3p可通过增加CRC细胞的凋亡、抑制增殖来影响肿瘤的生长。但miR-330-3p-RUVBL1信号轴是通过哪条信号通路影响肿瘤发生发展的,尚需要进一步研究。
