缬沙坦通过TGF-β1/Smad3信号通路调控足细胞血管生成素样蛋白4的表达*
2020-11-21肖红波郭岩岩
肖红波, 郭岩岩, 杨 波
1北京大学深圳医院肾内科,深圳 5180362深圳北京大学香港科技大学医学中心泌尿外科研究所,深圳 518036
糖尿病肾病(diabetic kidney disease,DKD)临床特征包括早期持续增加的微量白蛋白尿和晚期进行性肾功能下降,足细胞损伤在其发生发展中起着关键作用。血管生成素样蛋白4(angiopoietin-like protein 4,ANGPTL4)是血管生成素样蛋白超家族的一种分泌型糖蛋白,在糖脂代谢、调节血管发生、细胞分化及肿瘤转移等方面发挥重要作用[1]。相关研究提示ANGPTL4可能参与肾脏足细胞受损(包括DKD)及蛋白尿的产生[2-4]。转化生长因子-β1(transforming growth factor-β1,TGF-β1)是DKD等足细胞病中导致足细胞损伤的重要因子[5-6],其能否促进肾小球足细胞ANGPTL4的分泌,从而加重肾脏病理损伤,目前尚未见报道。缬沙坦作为一种血管紧张素Ⅱ受体拮抗剂,是目前临床上治疗早期DKD的首选药物,研究报道其对糖尿病动物模型中足细胞损伤有保护作用[7],但其不依赖于降压的肾脏保护作用的具体机制尚未完全阐明。因此,我们研究了TGF-β1是否可调控足细胞ANGPTL4表达及其相关信号通路,以及缬沙坦是否可通过抑制TGF-β1诱导的足细胞ANGPTL4表达而发挥肾脏保护作用。
1 材料与方法
1.1 主要材料
1.1.1 人足细胞系 人肾脏足细胞系由美国哈佛大学麻省总医院Peter Mundel教授惠赠,北京大学第一医院张宏教授转送。根据文献报道的方法进行培养[8]:人肾足细胞置于完全培养液(含10%胎牛血清RPMI-1640)中33℃、5%CO2贴壁培养,保持上皮细胞形态增殖5 d后转入37℃、5%CO2条件下开始向足细胞分化。分化14 d后显微镜下即可观察到足细胞形态呈长梭型,末端有少量分支,符合文献报道的足细胞形态特征。本实验所用细胞均为分化成熟后的足细胞。
1.1.2 主要试剂 RPMI-1640细胞培养液(美国Gibco),胎牛血清(美国Gibco),ANGPTL4抗体(美国Abcam),Smad3抗体(美国Abcam),磷酸化Smad3(p-Smad3)抗体(美国Abcam),Smad3抑制剂SIS3(美国Med Chem Express),β-actin抗体(美国Abcam),辣根过氧化物酶(HRP)标记的二抗(美国Cell Signaling Technology),RT-PCR试剂盒(日本TaKaRa),PMSF(美国Sigma),Bradford蛋白浓度测定试剂盒(美国Thermo Fisher Scientific),ECL化学发光剂(上海碧云天)。
1.2 实验方法
1.2.1 分组和干预 不同浓度TGF-β1(0、1、2.5、10 ng/mL)刺激足细胞24 h,检测ANGPTL4的mRNA及蛋白表达水平。TGF-β1(10 ng/mL)刺激足细胞不同时间(0、12、24、48 h)后收集细胞,检测ANGPTL4的mRNA及蛋白表达水平。缬沙坦或SIS3干预:根据文献报道,选取20 μmol/L缬沙坦[9]或5 μmol/L SIS3[10]与不同浓度TGF-β1(2.5、10 ng/mL)同时加入足细胞完全培养液中,培养24 h后收集细胞进行ANGPTL4 mRNA以及相关蛋白表达水平的检测。具体分组为对照组、1 ng/mL TGF-β1组、2.5 ng/mL TGF-β1组、10 ng/mL TGF-β1组、缬沙坦+2.5 ng /mL TGF-β1组、缬沙坦+10 ng /mL TGF-β1组、SIS3+2.5 ng/mL TGF-β1组、SIS3+10 ng /mL TGF-β1组。
1.2.2 Western blot检测ANGPTL4、Smad3及p-Smad3的表达 将培养的上述各组细胞洗去培养液,细胞培养板置于冰上,用4℃预冷的PBS清洗2次,加入细胞裂解液(含1∶100 PMSF)在冰上裂解30 min,用细胞刮刮下细胞转入干净预冷的1.5 mL EP管中,4℃、12000×g离心15 min,将所得上清移入新的1.5 mL EP管中,用Bradford蛋白浓度测定试剂盒测定蛋白浓度。电泳、转膜和封闭后,加一抗ANGPTL4(1∶1000)、Smad3(1∶1000)、p-Smad3(1∶1000)和ACTB(β-actin)(1∶2500),4℃过夜。加入HRP标记的羊抗兔IgG(以5%脱脂奶粉稀释为1∶5000)室温反应90 min,用ECL化学发光剂(上海碧云天)在化学发光成像系统中曝光成像,采用Tanon Image图像分析软件进行吸光度值分析,以所测得的各指标的吸光度与内参照β-actin吸光度的比值代表蛋白表达定量值。
1.2.3 RT-PCR检测足细胞各因子的mRNA表达用Trizol一步法进行总RNA的抽提。RT-PCR试剂盒行反转录PCR,20 μL反应体系中,用ANGPTL4、ACTB mRNA的特异性引物行PCR扩增,PCR产物经6%聚丙烯酰胺凝胶电泳,并用计算机处理图像进行吸光度扫描。以ACTB产物吸光度为参照对目的基因表达量进行半定量分析。PCR条件为95℃预变性5 min,95℃变性30 s,56℃退火30 s,72℃延伸50 s,35个循环,结束循环后72℃再延伸10 min,4℃终止。引物由上海生工生物工程有限公司合成,序列如下,ANGPTL4正向:5′-GGCTCAGTGGACTTCAACCG-3′,反向:5′-CC-GTGATGCTATGCACCTTCT-3′;ACTB正向:5′-CCACTGGCATCGTGATGGACTCC-3′,反向:5′-GCCGTGGTGGTGAAGCTGTAGC-3′。
1.3 统计学方法
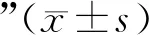
2 结果
2.1 不同浓度TGF-β1刺激人足细胞ANGPTL4 mRNA和蛋白表达
TGF-β1刺激足细胞24 h,RT-PCR结果显示ANGPTL4 mRNA水平升高,且呈剂量依赖性,与对照组比较,2.5 ng/mL和10 ng/mL TGF-β1刺激组ANGPTL4 mRNA水平升高,差异有统计学意义(均P<0.05);Western blot结果和RT-PCR结果一致,与对照组比较,2.5 ng/mL和10 ng/mL TGF-β1刺激组ANGPTL4蛋白水平显著升高(均P<0.05)。见图1。
A:RT-PCR;B:Western blot;与对照组(0 ng/mL TGF-β1)比较,*P<0.05图1 不同浓度TGF-β1刺激人足细胞ANGPTL4 mRNA及蛋白表达情况Fig.1 mRNA and protein levels of ANGPTL4 in human podocytes stimulated with TGF-β1 of various doses
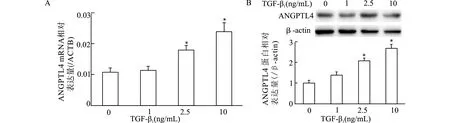
2.2 TGF-β1刺激人足细胞不同时间ANGPTL4 mRNA和蛋白表达情况
以10 ng/mL TGF-β1作用人足细胞不同时间,RT-PCR结果显示,随着刺激时间增加,ANGPTL4 mRNA水平逐渐升高,呈时间依赖性,与对照组比较,10 ng/mL TGF-β1刺激24 h和48 h组ANGPTL4 mRNA水平升高有统计学意义(均P<0.05);Western blot结果和RT-PCR一致,与对照组比较,TGF-β1刺激12、24和48 h后ANGPTL4蛋白表达水平显著升高(均P<0.05)。见图2。
A:RT-PCR;B:Western blot;与对照组(0 h)比较,*P<0.05图2 10 ng/mL TGF-β1刺激人足细胞不同时间ANGPTL4 mRNA及蛋白表达情况Fig.2 mRNA and protein levels of ANGPTL4 in human podocytes stimulated with TGF-β1 at a dose of 10 ng/mL for different time lengths
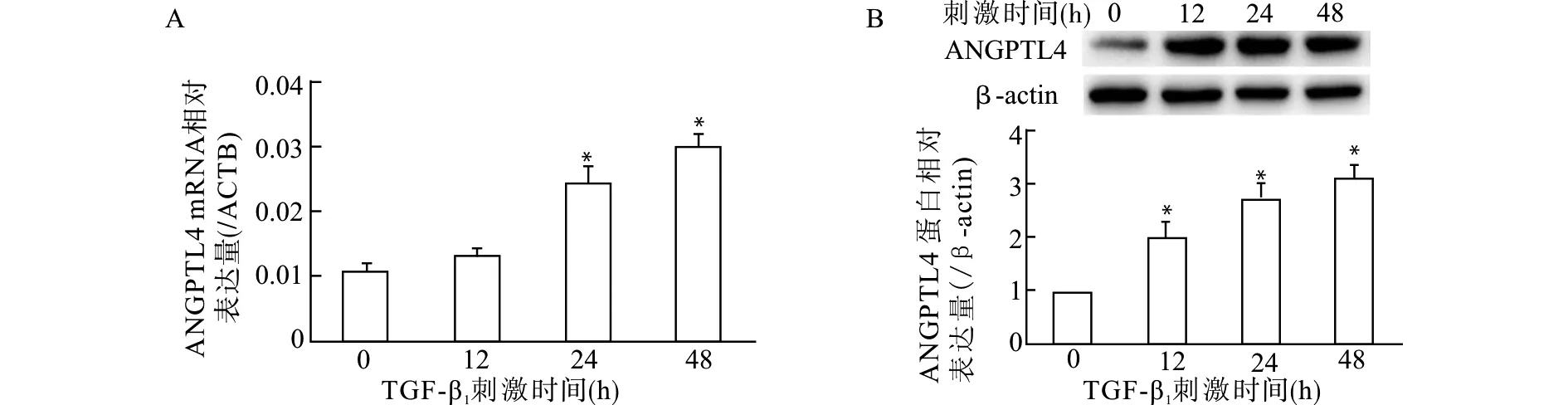
2.3 TGF-β1对足细胞Smad3信号通路的作用
Western blot结果显示,10 ng/mL TGF-β1刺激足细胞后,Smad3和p-Smad3蛋白表达增加,且p-Smad3/Smad3比值增加,在刺激1 h后Smad3和p-Smad3蛋白表达达峰值(图3A);2.5 ng/mL TGF-β1刺激足细胞,未见明显p-Smad3/Smad3增加(图3B);予以Smad3抑制剂SIS3处理后,可显著抑制10 ng/mL TGF-β1诱导的p-Smad3/Smad3增加(图3B)。提示TGF-β1刺激足细胞后Smad3通路激活。
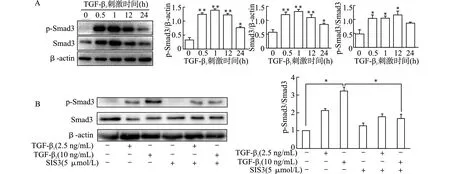
2.4 SIS3对TGF-β1诱导的人足细胞ANGPTL4 mRNA和蛋白的影响
用Smad3抑制剂SIS3处理足细胞发现,与10 ng/mL TGF-β1单独刺激组比较,SIS3+10 ng/mL TGF-β1组ANGPTL4 mRNA(图4A)和蛋白水平显著降低(均P<0.01),提示Smad3抑制剂SIS3可显著抑制TGF-β1诱导的ANGPTL4 mRNA和蛋白表达的增加,TGF-β1/SMAD3通路对人足细胞系ANGPTL4表达有调节作用。
2.5 缬沙坦对TGF-β1诱导的人足细胞ANGPTL4 mRNA和蛋白表达的影响
RT-PCR和Western blot结果显示,与10 ng/mL TGF-β1单独刺激组比较,缬沙坦处理可显著抑制TGF-β1诱导的ANGPTL4 mRNA(图4B)和蛋白(图4C)表达增加(均P<0.01)。
A:10 ng/mL TGF-β1刺激不同时间,与对照组比较,*P<0.05 **P<0.01;B:不同浓度TGF-β1刺激细胞1 h,*P<0.05图3 TGF-β1刺激人足细胞Smad3和p-Smad3蛋白表达情况及SIS3的作用Fig.3 Protein expression of Smad3 and p-Smad3 of human podocytes stimulated with TGF-β1 and the effect of SIS3 intervention
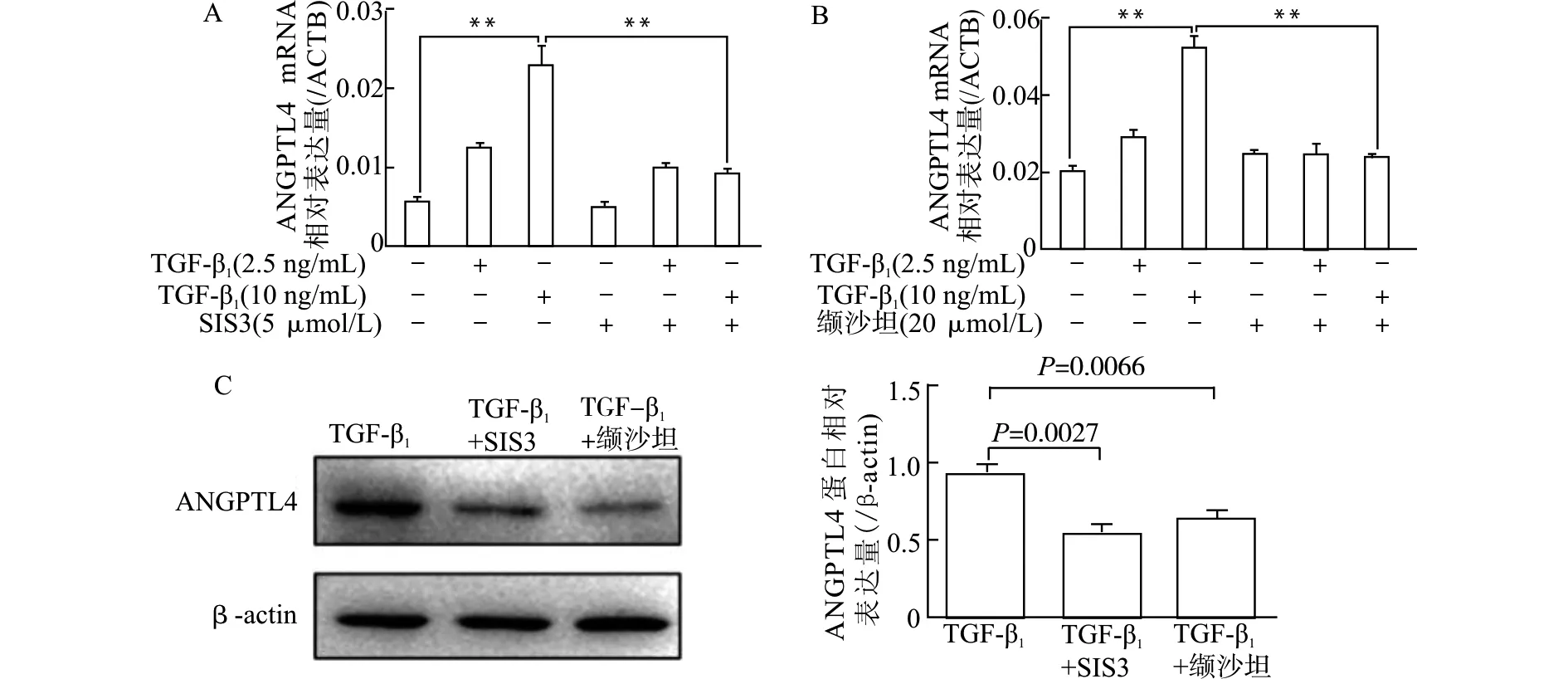
A、B:RT-PCR检测mRNA表达水平,**P<0.01;C:10 ng/ml TGF-β1刺激24 h Western blot检测蛋白表达图4 SIS3及缬沙坦对TGF-β1诱导的ANGPTL4 mRNA及蛋白表达的影响Fig.4 Effect of SIS3 and valsartan on the elevated mRNA and protein levels of ANGPTL4 induced by TGF-β1
2.6 缬沙坦对TGF-β1刺激的人足细胞系p-Smad3/Smad3蛋白表达情况的影响
Western blot结果显示,与TGF-β1单独刺激组比较,缬沙坦处理可显著抑制TGF-β1刺激诱导的p-Smad3/Smad3蛋白表达增加(P<0.05),见图5。
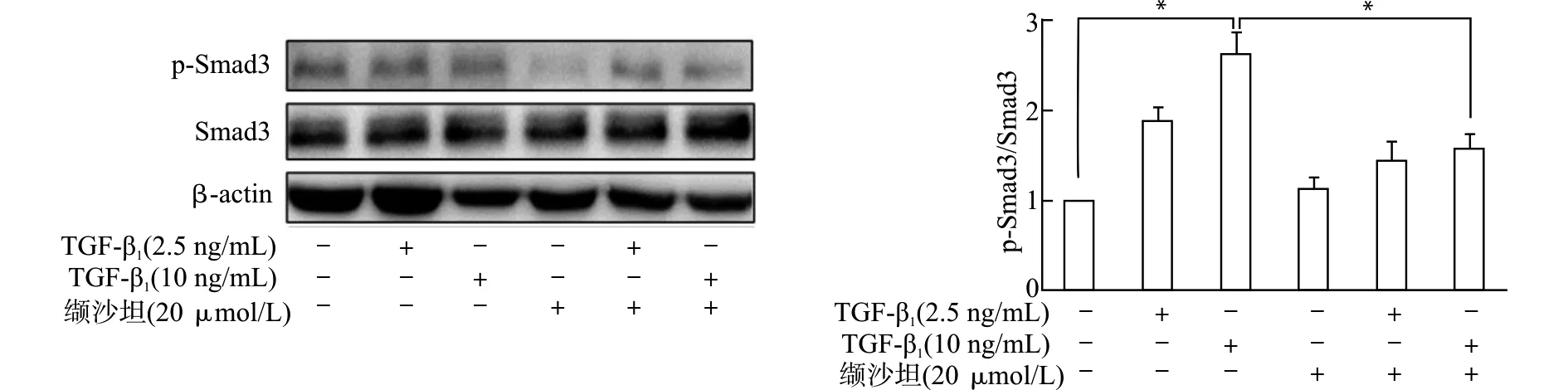
TGF-β1刺激1 h,*P<0.05图5 缬沙坦对TGF-β1诱导的Smad3和p-Smad3蛋白表达的影响Fig.5 Effect of valsartan on the protein expression of Smad3 and p-Smad3 induced by TGF-β1
3 讨论
DKD是糖尿病患者常见并发症[11],是中国终末期肾脏病(end stage renal disease,ESRD)的主要原因[12]。其发病机制是以高血糖为启动因素诱导的各种生长因子、血管活性物质综合作用的结果,其中TGF-β1的作用尤为突出,大量实验表明,TGF-β1/Smad通路的激活是DKD发病和发展的关键环节[13]。本研究发现TGF-β1/Smad3通路对人足细胞系ANGPTL4 mRNA和蛋白水平有调节作用,且缬沙坦可调控该信号通路及ANGPTL4表达。
高血糖可通过TGF-β1介导引起肾脏损伤,所以也可以用TGF-β1直接作为研究DKD肾脏损伤的细胞因子[14]。其作用机制包括:活化下游Smad3信号通路引起糖尿病肾病足细胞凋亡[15];促进足细胞分泌胶原蛋白Ⅳ、纤维连接蛋白等肾小球基底膜成分,从而促进肾小球基底膜增厚等。近年来研究提示足细胞特异性分泌的ANGPTL4可能参与足细胞受损及蛋白尿的形成。在微小病变肾病(MCD)和膜性肾病动物模型中,足细胞分泌ANGPTL4增加,而足细胞特异性ANGPTL4转基因大鼠则表现出MCD病理改变和肾病综合征,进一步研究提示足细胞分泌低唾液酸化的ANGPTL4损害肾小球基底膜的电荷屏障,是MCD蛋白尿发生的重要机制[2,16]。N-乙酰-D-甘露糖胺(ManNAc)是唾液酸的前体,其可使低唾液酸化的ANGPTL4转变为唾液酸化的ANGPTL4,从而显著减轻MCD蛋白尿。ManNAc还可以明显降低DKD大鼠蛋白尿程度,因此认为小剂量ManNAc可以用于DKD的治疗[3]。在DKD大鼠模型中,肾组织和尿中ANGPTL4表达水平都增加,且ANGPTL4定位在足细胞[17];在体外高糖培养条件下足细胞低唾液酸化的ANGPTL4表达增加,且可通过整联蛋白/FAK途径诱导足细胞凋亡和肌动蛋白细胞骨架紊乱[18]。这些研究提示ANGPTL4在DKD足细胞损伤中发挥了重要作用,然而肾小球足细胞ANGPTL4表达的上游调控机制尚不清楚。文献报道TGF-β1可通过Smad信号通路增加乳腺癌ANGPTL4表达,并促进ANGPTL4释放入血液,转移至肺部[19]。那么足细胞中ANGPTL4表达增高是否也与TGF-β1/Smad3通路有关呢?本研究发现,TGF-β1呈剂量和时间依赖方式上调足细胞ANGPTL4表达,而予以Smad3抑制剂则可抑制TGF-β1诱导的ANGPTL4表达上调,提示TGF-β1可能是病理条件下上调ANGPTL4的细胞因子之一,为干预ANGPTL4表达治疗DKD提供了可能的靶点。
缬沙坦作为血管紧张素受体阻断剂(angiotensin receptor blocker,ARB)的代表性药物,可选择性与AT1受体结合,阻断DKD时异常激活的肾素血管紧张素(RAS)系统,是目前临床上治疗早期DKD的首选药物之一[20],然而其不依赖于降压的肾脏保护作用的具体机制尚未完全阐明。本研究发现,缬沙坦可能通过抑制TGF-β1/Smad3通路而抑制病理条件下足细胞ANGPTL4的表达,提示缬沙坦发挥降低蛋白尿程度的作用机制可能部分通过降低ANGPTL4表达来实现。然而本研究为体外实验,仍存在一定局限性,如需确证缬沙坦通过调控足细胞ANGPTL4表达而发挥肾脏保护作用,还需进一步的动物实验验证。
综上,本研究初步证实了TGF-β1/Smad3通路参与调控足细胞ANGPTL4表达,为DKD中ANGPTL4表达上调的机制提供了研究方向,有助于发现ANGPTL4调控的靶点;且发现缬沙坦可抑制TGF-β1诱导的足细胞ANGPTL4表达,为缬沙坦的肾脏保护作用提供了新的分子生物学依据。另外,由于目前ANGPTL4的作用主要在MCD及DKD中相对明确,而本研究主要探讨了缬沙坦在DKD中的作用可能是通过抑制TGF-β1诱导的足细胞ANGPTL4表达,但不排除其在其他足细胞病中也有此类作用。
