Crk1/2与CrkL缺失导致足细胞损伤的蛋白质组学分析*
2020-11-18杜佳琳黄海明黄辰炜李海霞
杜佳琳,段 楠,逄 璐,黄海明,黄辰炜,李海霞
(北京大学第一医院检验科,北京 100034)
足细胞是锚定在肾小球基底膜的高度分化终末细胞,具有复杂的骨架结构,是肾小球滤过屏障的重要组成部分,其损伤是导致肾小球蛋白尿的主要机制,并且与各类肾小球疾病的发生和发展密切相关[1]。在足细胞损伤模型中,足细胞内某些蛋白的表达水平会发生明显变化,特定基因的缺失会导致足细胞结构与功能受损,因此,明确导致足细胞损伤的特定分子,对于治疗肾小球疾病至关重要[2-3]。Crk家族蛋白Crk1/2与CrkL是重要的信号转导蛋白,二者结构相似,功能互补,参与细胞黏附、迁移、增殖、凋亡及免疫等多个生物过程,在许多肿瘤疾病中呈高表达,并且对维持正常细胞的形态和功能至关重要[4]。既往研究表明,足细胞Crk1/2与CrkL缺失会导致板状伪足形成异常,细胞骨架重排及细胞黏附、迁移与活力受损[5-6]。尽管Crk1/2与CrkL在足细胞中发挥了重要生物作用,但此过程中涉及的上、下游分子机制尚不明确。为进一步了解Crk1/2与CrkL在足细胞中的作用,本研究采用非标记定量蛋白质组学方法对Crk1/2与CrkL单敲降及双敲降的足细胞和正常足细胞中的蛋白质谱进行比较,根据所得信息分析由Crk家族蛋白缺失介导的复杂蛋白网络,进一步探索肾小球疾病的病理生理机制。
1 材料与方法
1.1材料 条件永生化人足细胞(HPCs)由美国安德森癌症中心龙慧茵教授馈赠;Opti-MEM低血清培养基(美国Gibco公司);小干扰RNA(siRNA,中国生工生物工程股份有限公司);转染试剂Lipofectamine RNAiMAX(美国Invitrogen公司);抗Crk1/2抗体(美国BD公司,1∶2 000)、抗CrkL抗体(英国Abcam公司,1∶500)、抗LRP1抗体(英国Abcam公司,1∶2 000)、抗超氧化物歧化酶2(SOD2)抗体(英国Abcam公司,1∶2 000)、抗TPM4抗体(英国Abcam公司,1∶3 000)、抗c-Jun抗体(英国Abcam公司,1∶3 000)、抗Cdc42EP1抗体(英国Abcam公司,1∶4 000)、抗GAPDH抗体(英国Abcam公司,1∶2 000)。
1.2方法
1.2.1细胞培养 HPCs于含有10%胎牛血清、1%青霉素/链霉素和1×胰岛素-转铁蛋白-硒(ITS)的RPMI1640培养基中传代培养。增殖条件为33 ℃,当细胞密度达到70%~80%时,转入37 ℃,培养基去除ITS,培养10~14 d诱导分化,之后用于试验。
1.2.2试验分组及siRNA转染 试验分为4组:空白对照组(转染阴性对照siRNA,siCtrl)、Crk1/2单敲降组(转染Crk1/2 siRNA,siCrk1/2)、CrkL单敲降组(转染CrkL siRNA,siCrkL)、Crk1/2与CrkL双敲降组(共转染Crk1/2 siRNA与CrkL siRNA,siCrk1/2+siCrkL)。当分化好的HPCs细胞密度达到70%~80%时,利用Opti-MEM低血清培养基稀释siRNA与Lipofectamine RNAiMAX,二者混合均匀,室温孵育10 min后,滴加至细胞培养基中。转染72 h后,收集细胞提取蛋白,采用Western blot试验进行沉默效率验证。
1.2.3Western blot分析 转染72 h后,采用RIPA裂解液提取细胞总蛋白,4 ℃条件下以1 200 r/min离心15 min后取上清液用于Western blot试验。Western blot试验过程如下:将20 μg蛋白上样至浓度为10%的分离胶中进行电泳分离,然后转移至聚偏氟乙烯膜。转膜完毕后用5%脱脂奶粉室温孵育1 h,之后加入一抗,4 ℃过夜。第2天复温后用Western blot试验洗涤液洗膜,5 min×3次,然后加入辣根过氧化物酶标记的二抗室温孵育1 h,再次用Western blot试验洗涤液洗膜,5 min×3次。采用凝胶成像分析系统进行显影,采用Image J软件对各条带进行灰度扫描。各试验独立重复3次。
1.2.4液相色谱串联质谱(LC-MS/MS)分析 采用Bradford方法对细胞总蛋白进行定量,60 μg蛋白中加入5 μL二硫苏糖醇(1 mol/L)室温孵育1 h,然后加入20 μL吲哚乙酸(1 mol/L)避光室温孵育1 h,采用离心法和超滤法去除DTT、IAA和低分子物质,按照50∶1的比例在37 ℃下孵育12~16 h进行胰蛋白酶消化。LC-MS/MS系统包括Agilent 1100 quaternary高效液相色谱仪和Q-Exactive Fusion Lumos质谱仪。样本由自动进样器上样到C18反向柱(C18 3 μm 100 μm×2 cm),再经分析柱(C18 1.9 μm 150 μm×12 cm)分离,洗脱液A为0.1% 甲酸/H2O,洗脱液B为0.08%甲酸/乙腈,流速为300 nL/min,洗脱时间为75 min。采用数据依赖采集模式进行质谱分析,相关参数设置如下:质谱扫描离子质荷比为350~1 550 m/z,扫描分辨率为6 000,自动增益控制系数(AGC)为400 000,最大离子时间为50 ms。二级质谱相关参数设置如下:扫描分辨率为15 000,AGC为20 000,最大离子时间为35 ms。所得质谱数据采用Proteome Discoverer软件在Uniprot数据库中进行蛋白质检索鉴定。肽段和蛋白质鉴定错误发现率均小于0.01,允许最小肽段数目为1个。当上调蛋白差异倍数为1.5、下调蛋白差异倍数为0.67时,视为明显差异蛋白。采用DAVID数据库(https://david.ncifcrf.gov/)进行基因本体(GO)分析和京都基因和基因组百科全书(KEGG)分析,采用STRING数据库(http://www.string-db.org/)进行蛋白相互作用分析。
1.3统计学处理 采用SPSS19.0统计软件进行数据分析处理。采用GraphPad Prism 6.0软件制作统计图。采用t检验、Mann-WhitneyU检验和ANOVA检验进行比较。以P<0.05为差异有统计学意义。
2 结 果
2.1Crk1/2与CrkL单敲降及双敲降足细胞蛋白质组学分析及差异蛋白筛选 为了探究Crk1/2与CrkL在足细胞中的调节作用,本研究通过转染siCrk1/2、siCrkL及siCrk1/2+siCrkL的方法实现足细胞内Crk1/2与CrkL的单敲降及双敲降。如图1A所示,siRNAs转染足细胞后,Crk1/2与CrkL的表达水平与空白对照组比较明显降低。为了探讨Crk1/2与CrkL缺失对胞内蛋白表达的改变,本研究对3次独立试验的特异性敲降足细胞进行了蛋白质组学分析,相关工作流程如图1B所示。利用蛋白质组学分析平台对质谱数据进行处理和数据库检索。与siCtrl组比较,siCrk1/2组有291个差异蛋白,siCrkL组有315个差异蛋白,siCrk1/2+siCrkL组有576个差异蛋白。在这些差异蛋白中,有46个蛋白在3个试验组中均表达上调,有52个蛋白在3个试验组中均表达下调,如图1C所示。下一步将对这98个差异蛋白进行进一步分析。

注:A为siRNA转染后足细胞Crk1/2与CrkL的表达情况;B为定量蛋白质组学工作流程图;C为差异蛋白筛选。
2.2Crk1/2与CrkL单敲降及双敲降足细胞中差异蛋白通路分析 为了探究Crk1/2与CrkL基因敲降相关的生物学功能和途径,本研究对98个差异蛋白进行了GO分析和KEGG分析。如图2、图3所示,生物过程分析提示大多数上调和下调蛋白质涉及以下3个过程:(1)细胞进程,包括肌动蛋白细胞骨架调节、信号转导等;(2)生物调节过程,包括细胞形态调节和细胞凋亡过程调控等;(3)代谢过程,包括脂质代谢过程和氧化还原过程等。分子功能分析显示,上调和下调的蛋白质主要富集在结合作用、蛋白结合、催化活性和水解酶活性等方面。此外,细胞组分分析提示,上调和下调蛋白质主要为细胞质成分。如图4所示,对上调差异蛋白进行KEGG分析显示,多数蛋白参与代谢途径,包括果糖和甘露糖代谢、淀粉和蔗糖代谢、半乳糖代谢等。图5对下调差异蛋白进行KEGG分析显示,Crk1/2与CrkL缺失会影响足细胞内多种信号通路,包括抑制和激活蛋白1、磷脂酰肌醇三激酶-丝氨酸/苏氨酸激酶和环磷酸腺苷等信号通路。这些差异蛋白的分布和功能为寻找与Crk1/2、CrkL的异常表达引起足细胞功能障碍有关的分子成分和信号通路提供了线索。

图2 上调差异蛋白的GO分析
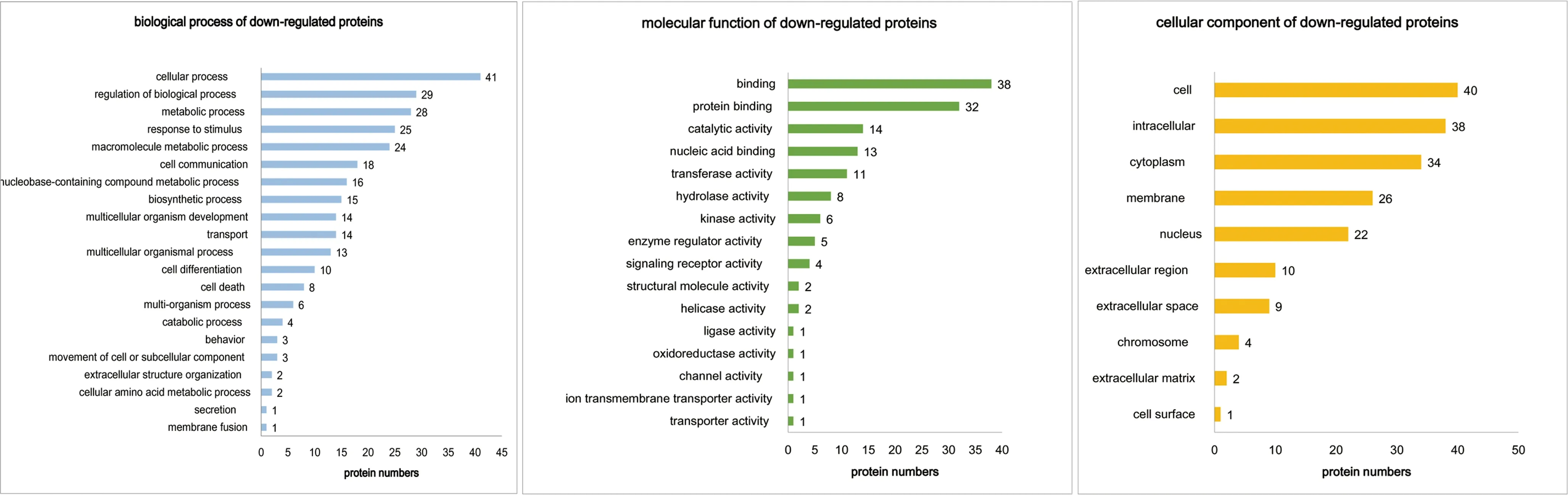
图3 下调差异蛋白的GO分析
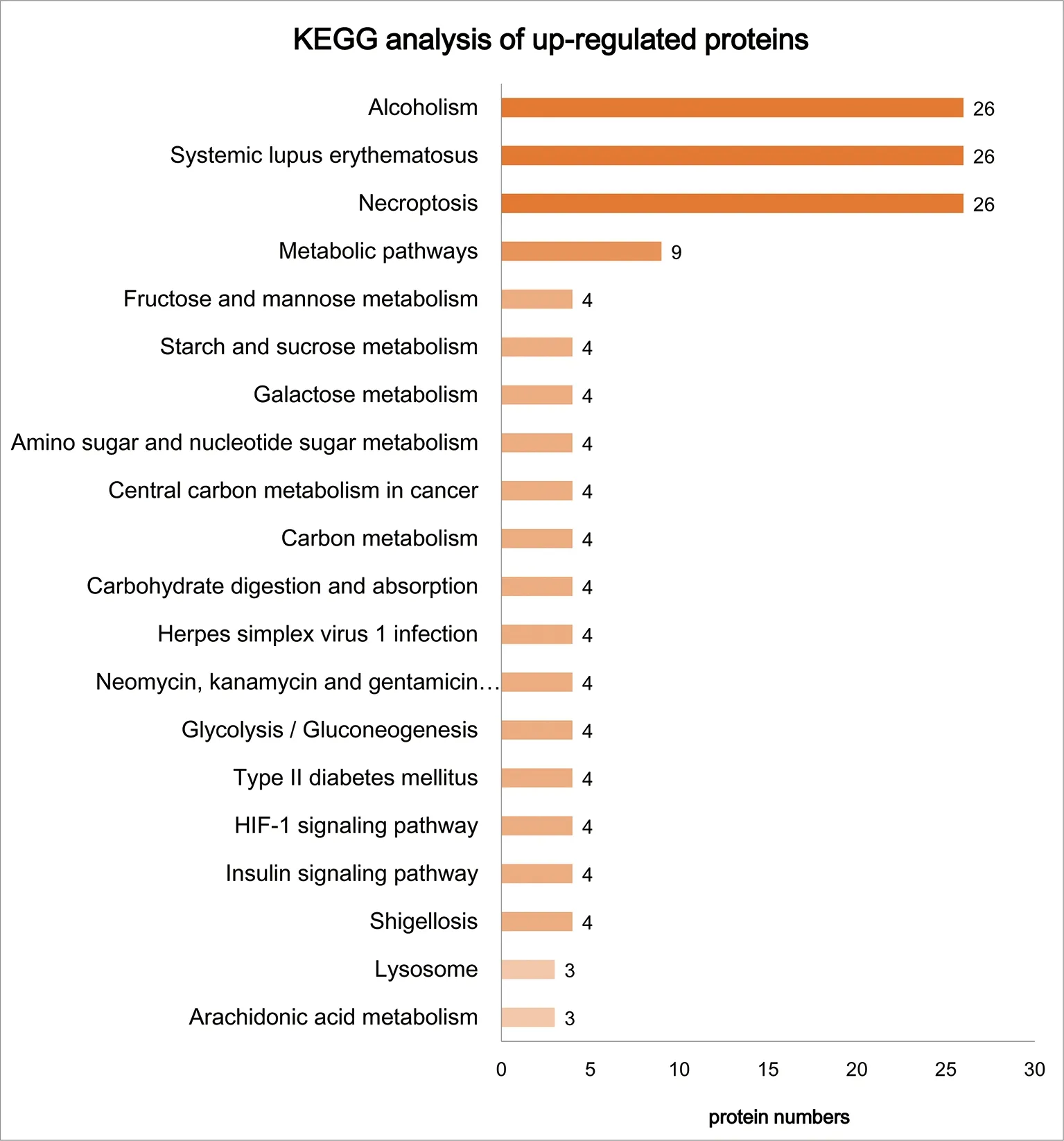
图4 上调差异蛋白的KEGG分析
2.3Crk1/2、CrkL与差异蛋白间的网络关系 为了进一步分析98个差异蛋白之间的网络关系,本研究将其上传至STRING蛋白质相互作用数据库进行分析,结果发现,这些差异蛋白与Crk1/2和CrkL之间高度互连。此外,一些软件预测的信号转导分子,如丝裂原活化蛋白激酶(MAPK)和雷帕霉素靶蛋白(mTOR)也出现在关系网中。转录因子c-Jun是MAPK的下游激活靶点,有调节细胞增殖、凋亡和分化的作用。在98个差异蛋白中,c-Jun与其他差异蛋白及被预测的蛋白质的连接数目最多,高达17个。与c-Jun相连蛋白包括SOD2、细胞间黏附分子1(ICAM1)和酪氨酸蛋白激酶等,这些蛋白质的连接为探究Crk1/2和CrkL缺失引起足细胞损伤和遗传性Digeorge综合征的机制提供了更多信息。

图5 下调差异蛋白的KEGG分析
2.4目标蛋白Western blot试验验证 本研究选择5个相关差异蛋白进行Western blot试验验证,并准备在下一步试验中继续进行深入的分子机制研究。如图6所示,上述5个蛋白的Western blot试验验证结果与蛋白质组学数据相一致,证明了蛋白质组学结果的可靠性。

注:*P<0.05,△P<0.01,#P<0.001。
3 讨 论
足细胞损伤是引起肾小球疾病的主要原因,既往研究表明,足细胞Crk家族蛋白的特异性缺失会导致伪足形成受阻[5-6]。为了研究Crk家族蛋白缺失引起足细胞功能障碍的分子机制,本研究分别对Crk1/2、CrkL单敲降及双敲降的足细胞进行了蛋白质组学研究,以识别Crk1/2与CrkL调控的差异蛋白。
通过对上调和下调差异蛋白进行生物过程分析发现,上调的大部分差异蛋白都参与了代谢途径,如氨基糖和核苷酸代谢、半乳糖代谢、碳代谢等。近年来,足细胞代谢紊乱已成为肾小球疾病的重要因素。线粒体功能障碍和代谢异常可以在糖尿病肾病、局灶节段性肾小球硬化和慢性肾脏病中观察到,并被认为是肾脏疾病进展的主要驱动因素[7]。本研究提示,在Crk1/2和CrkL缺失导致的足细胞损伤过程中,代谢紊乱是一个非常重要的损伤机制。对下调差异蛋白进行KEGG分析发现,大部分蛋白富集在信号转导通路(如Rap1、cAMP和PI3K-Akt信号通路等)上。STRING分析也显示差异蛋白与其他信号转导蛋白(如mTOR、MAPK8和MAPK9等)有密切关系。因此,生物信息学分析为Crk1/2与CrkL缺失引起足细胞功能障碍的研究提供了新思路。
在98个差异蛋白中,有5个与代谢、信号转导和肌动蛋白骨架有关的差异蛋白已被Western blot试验证实。TPM4是一种原肌球蛋白,是微丝骨架的主要结构,海马神经元LRRK2的缺失会导致生长锥中产生更多的TPM4来稳定新合成的肌动蛋白微丝[8]。然而,对TPM4在肾脏疾病中的表达情况及其生物学功能还暂不清楚。本研究结果显示,足细胞内Crk1/2与CrkL缺失导致足细胞骨架重排的过程伴随着TPM4表达增加。因此,推测TPM4的表达上调可能是肌动蛋白丝断裂后足细胞内的一种自我调节现象,其是否参与肾脏疾病的发病值得进一步探讨。
细胞代谢相关蛋白SOD2为线粒体乙酰化酶3(SIRT3)下游分子,可通过清除超氧化物来调节细胞活性氧(ROS)水平。有研究发现,经醛固酮或H2O2刺激的足细胞胞内ROS和SOD2生成增加,刺激前用人参皂苷-rg1处理足细胞可降低SOD2和ROS水平,防止足细胞损伤[9]。本研究中,SOD2在Crk1/2与CrkL单敲降及双敲降足细胞中表达上调,其可能是应对胞内ROS水平升高的调节机制,过多的ROS会导致DNA、蛋白质和脂类氧化,损害足细胞内的细胞器,Crk1/2与CrkL敲降后可能会造成足细胞内ROS的异常表达。此外,一些膜性肾病患者足细胞SOD2表达水平增加,并可作为自身抗原,导致血浆中出现抗SOD2抗体,最终激活免疫应答攻击足细胞[10]。因此,控制SOD2的表达对避免足细胞损伤有重要意义,Crk1/2、CrkL缺失导致的足细胞SOD2表达水平升高是肾小球疾病的危险因素。
LRP1是低密度脂蛋白受体家族的成员,具有超过40种不同的配体,介导多种细胞内信号通路,在Schwan细胞中,LRP1表达下调可通过抑制Rac1和激活RhoA来增加细胞黏附[11]。GO和KEGG分析表明,许多差异蛋白与代谢过程与信号通路有关[11]。TPM4在稳定微丝骨架结构中起重要作用,在3个试验组中均表达上调。SOD2是一种重要的线粒体抗氧化剂,为SIRT3的下游介质,调节ROS产生,在3个试验组中均表达上调。LRP1是LDL受体家族的一员,参与脂蛋白代谢,调节细胞增殖、迁移和肌动蛋白聚合,在3个试验组中均表达上调。在STRING分析中,c-Jun与其他已鉴定和被预测的蛋白质的联系最多,并且参与了多条信号通路,在3个试验组中均表达下调。Cdc42EP1作用于Cdc42下游,诱导肌动蛋白丝聚合和伪足形成[11],在3个试验组中均表达下调。本研究中对足细胞进行Crk1/2与CrkL单敲降及双敲降后,LRP1表达水平明显增加,其可造成Rho GTPase等信号通路改变,最终导致足细胞功能紊乱。此外,1项基于膜性肾病微阵列和蛋白质组学数据的蛋白相互作用网络分析表明,LRP1作为一个重要的靶基因,可能参与了膜性肾病的发病[12]。因此,Crk1/2、CrkL、LRP1与肾脏病之间存在重要联系。
c-Jun是一种转录因子,参与多种生物过程,包括细胞增殖、分化和凋亡,它可以形成各种各样的二聚体,识别AP-1位点和cAMP活化位点,从而调控信号转导,多种细胞外刺激对c-Jun的诱导主要是通过ERK、JNK和p38级联介导完成[13]。本研究STRING分析发现,c-Jun与其他已鉴定和预测的蛋白质有最多的相关连接。KEGG分析显示,cAMP信号通路和PI3K-Akt信号通路的明显富集与c-Jun密切相关,这一结果表明,c-Jun在接受Crk1/2与CrkL介导的信号转导后表达下调,并通过调控其他相关蛋白,在足细胞损伤中起关键作用。
Cdc42EP1是一种Cdc42结合蛋白,作用于Cdc42下游,诱导肌动蛋白丝装配和板状伪足的形成,Cdc42EP1主要通过与活化的Cdc42-GTP、RhoQ、aPKC和ERK2相互作用而被调控[14]。在颅内神经嵴细胞中,Cdc42EP1与CRIB结构域相互作用,促进伪足突起。Cdc42EP1的缺失会导致细胞形状变圆,并伴随肌动蛋白结构紊乱和黏着斑损伤[15]。本研究的蛋白质组学分析显示,Cdc42EP1在Crk1/2与CrkL单敲降及双敲降的足细胞中均表达下调,提示Crk1/2与CrkL的缺失可以通过抑制Cdc42下游的Cdc42EP1调节Rho GTPases,诱导肌动蛋白纤维结构破坏,进而导致细胞形态改变。
4 结 论
综上所述,本研究采用蛋白质组学方法探究了Crk1/2与CrkL缺失引起足细胞损伤的分子机制,为Crk1/2与CrkL在足细胞中的功能研究提供了新思路。本研究中,Crk1/2与CrkL单敲降及双敲降的足细胞与正常足细胞相比共有98个差异蛋白,其中大部分蛋白与信号转导和代谢过程相关。此外,5个关键蛋白:TPM4、SOD2、LRP1、c-Jun和Cdc42EP1已进行Western blot试验验证,证实它们在足细胞损伤过程中起关键作用,具体调控机制还有待进一步研究。
