BCAC-EMA-Rti-LAMP 非预增菌快速检测鱼肉污染活的副溶血弧菌研究
2020-11-18吴国平李盛艳
杨 珺,陈 鹄,吴国平,舒 梅,李盛艳,钟 婵
(江西农业大学食品科学与工程学院/南昌市农产品加工与质量控制重点实验室,江西南昌 330045)
【研究意义】副溶血弧菌(Vibrio parahaemolyticus,VP)是一种嗜盐革兰氏阴性食源性致病菌,广泛分布于沿海、河口环境和鱼、虾、贝类等海产品中[1-3]。该菌最适生长温度为30~37 ℃,因此夏秋季是VP 中毒事件的高发期。VP 可引起食物中毒、反应性关节炎和心脏疾病等,且发病呈世界性分布[4]。对全国43 个城市的2 531 份水产品和熟食样品进行污染水平调查,发现VP 的整体污染率高达24.26%[5]。特别在沿海城市,由该菌引起的食物中毒占细菌性食物中毒的60%以上,其引发的食源性疾病爆发是当前面临的重要的公共卫生安全问题之一[6]。因此,如何快速地检测筛查水产品中VP,防止被污染的食品进入市场,是有效防控VP 食源性疾病暴发的前提条件。【前人研究进展】目前,常用于检测VP 的方法有细菌培养检测法、免疫学方法、聚合酶链式反应等[7]。细菌培养法是“金标准”,不需要复杂的实验仪器并且实验结果可靠,但是其检测周期较长,5~7 d,而且程序繁琐、费时费力[8]。免疫学方法虽然快速,但在检测时间、灵敏度和特异性等方面略显不足。环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是一种较PCR 更新颖的核酸扩增技术,它依赖于能够识别靶DNA 上6 个特定区域的4 条引物和一种具有链置换活性的DNA 聚合酶,在恒温条件下高效扩增核酸[9-10]。相比PCR 而言,LAMP 一般对模板中干扰因子的抵抗力更强。实时荧光定量LAMP(Rti-LAMP)更是具备即时监测、灵敏和无污染的优点,具有高特异性、灵敏、高效、操作简便等快速检测特点[11]。【本研究切入点】鱼肉等食品中存在许多可溶性DNA 聚合酶抑制剂,提取样品中细菌用于核酸检测时,因难以去除,将干扰阻碍LAMP、PCR 扩增反应,从而降低其检测灵敏性。活性炭是一种具有较大表面积、复杂孔隙结构的物质,具有良好的吸附性能[12]。但由于活性炭一般也能吸附细菌,因而有文献报道用蒙脱石[12]、环糊精[13]、牛奶蛋白[14]等物质对活性炭进行封闭,使其吸附食品可溶性杂质而不吸附细菌,从而精制目标细菌用于核酸检测。此外,基于核酸扩增的环介导等温扩增,一般难以区分死、活目标细菌,容易高估活细菌污染的阳性结果。叠氮溴化乙锭(EMA)是一种具光亲和标记特性的荧光核酸染料[15]。死细胞相对来说细胞膜的通透性更高,与EMA 混合后,经高强度的曝光,EMA 与细胞DNA 共价结合,可抑制死菌DNA 的扩增,从而起到了区分死、活细胞的目的。【拟解决的关键问题】基于此,本研究以VP 特异性tlh基因为检测目标,采用Midori Green 荧光染料,联合优化蒙脱石封闭的活性炭、叠氮溴化乙锭前处理技术,建立了一种BCAC-EMA-Rti-LAMP 快速灵敏检测鱼肉污染VP 活菌的检测方法。
1 材料与方法
1.1 材料与试剂
副溶血弧菌(VP)CICC 21617购买自中国菌种网。2019年11—12月,从南昌市水产市场上购买新鲜海水鱼样品,立即用于实验检测。
胰蛋白酶大豆肉汤(TSB),美国Difco公司生产;Whirl-Pak均质过滤袋,美国Nasco公司生产;活性炭为河南祥源水处理材料有限公司生产;蒙脱石,美国Fisher公司生产;叠氮溴化乙锭(EMA),美国Sigma-Aldrich公司生产;BstDNA polymerse,新西兰Biolabs公司生产;Midori Green,美国Bulldog Bio公司生产。
1.2 仪器与设备
荧光PCR 仪,CFX Connect Real-time System,美国BIO-RAD 公司。GL-21M 高速冷冻离心机,湖南湘仪实验室仪器开发有限公司。T18 数显型高速分散器ULTRA-TURRAX,德国IKA 公司。拍击式均质机,AES chemuex公司。
1.3 方法
1.3.1 培养、计数及细菌DNA提取 将活化的VP接种于3 mL 3%NaCl TSB液体培养基中,37 ℃,150 r/min过夜培养16~18 h,以3%菌液量转接于10 mL 3%NaCl TSB 液体培养基,37 ℃,150 r/min培养1.5 h 左右至对数期细菌(OD600≈0.5)。将菌液用灭菌的3%盐水按10 倍梯度依次稀释,取100 µL 涂于平板,培养18~24 h细菌计数,测定OD600的数值,建立OD600值与细菌浓度的标准曲线。细菌于95 ℃水浴加热5 min,即为死菌样品。
细菌总DNA 制备,3%盐水稀释的细菌500µL加入500µL 2×TZ 裂解液,于99.5 ℃下加热10 min,冰上冷却后高速离心5 min,取上清即为细菌DNA模板。
实际样品细菌DNA 的制备,取细菌悬液12 000 g 离心10 min,沉淀用50 µL 1×TZ 裂解液重悬,于99.5 ℃水浴加热10 min,冰上冷却后12 000 g 离心5 min,取上清即为细菌DNA 模板。如无特殊说明,均用此方法制备鱼肉样品的DNA模板。
1.3.2 Rti-LAMP反应 研究发现tlh基因具有种属特异性,广泛分布于VP的环境与临床分离株中,可作为VP 的一种常规检验方法。参照Zhong 等[16]设计合成的6 条特异性引物用于Rti-LAMP,包括两条内引物(FIP:ACATCGCTTGTGCCTTGATGAACTCAACACAAGAAGAGATCG,BIP:GCGCAAGGTTACAACAT⁃CACGGCAGAAGTTAGCGTCTCG),两条外引物(F3:GTGCGAAGAACTTCATGTTG,B3:GATGAGCGGTT⁃GATGTCC),两条环引物(Loop F:ACTCGTTCATCTCAAGCACTT,Loop B:TGTTTGATACTCACGCCTT⁃GT)。引物及缓冲液、dNTPs、Mg2+等反应液Mix由厦门飞朔生物科技有限公司合成。
Rti-LAMP 反应体系总体积为25 µL:21 µL Mix 引物,1 µL 1∶500 稀释的荧光染料Midori Green,1µLBst 聚合酶,2µL 细菌DNA 模板。制备好的反应管放入BIO-RAD CFX Connect Real-time System 内65 ℃扩增反应60 min。每分钟读取荧光数值,设定样品荧光值出现指数增加的时间为Tt值,测定Tt值与细菌浓度之间关系函数。
1.3.3 预增菌的Rti-LAMP 方法(E-Rti-LAMP) 预增菌培养对模拟污染的鱼肉样品处理的Rti-LAMP检测方法。每份25 g 鱼肉,加175 mL 3%NaCl BPW 缓冲液于均质袋中,加入稀释至适宜浓度的VP 悬液1 mL,分别制备终浓度为10,30,100,300,1 000,3 000 CFU/g的模拟污染鱼肉样品,37 ℃水浴增菌4 h后,样品转移至离心杯800 r/min 4 ℃离心5 min,用4层玻璃棉进行过滤,取上清12 000 r/min 4 ℃离心5 min,沉淀用于细菌DNA的提取和Rti-LAMP扩增。
1.3.4 EMA-Rti-LAMP 检测活的VP 方法建立 将EMA 用去离子水稀释为0.5µg/µL,-20 ℃避光保存。取两组不同浓度活的VP(0.2 mL,1.0×106CFU/mL 和0.2 mL,1.0×104CFU/mL)样品,分别加入EMA 混匀,使EMA 终浓度分别为0,2.0,4.0,8.0,10.0µg/mL,避光处理5 min 后在500 W 卤素灯照下曝光15 min,样品经12 000 g 离心10 min,取细菌沉淀用0.2 mL 1×TZ 裂解液重悬,99.5 ℃水浴加热10 min,高速离心后,上清即为DNA 模板用于Rti-LAMP 反应。采用相似方法,对95 ℃水浴加热5 min 杀死的VP 进行EMA 处理,然后进行Rti-LAMP反应。
1.3.5 BCAC-EMA-Rti-LAMP 检测鱼肉中活的VP 方法建立 蒙脱石封闭活性炭(BCAC)的制备:参照赵远洋等[17]方法制备,即选用颗粒直径为1.25~2 mm 的活性炭16 g,用蒸馏水流洗至无色,烘干待用。取蒙脱石4 g 加蒸馏水200 mL,均质2 min 后低速离心2 min,将上清液加入上述活性炭混合,37 ℃下150 r/min,震荡3 h,55 ℃烘箱中烘干备用。
BCAC-Rti-LAMP 方法:取1 g 的鱼肉,分别加入稀释至适宜浓度的VP 1 mL 至终浓度分别为10,30,100,300,1 000,3 000 CFU/g 模拟污染鱼肉样品,静置1 h,然后加入9 mL 3% NaCl,10 000 r/min 均质1 min,800 r/min 离心5 min,用4 层玻璃棉进行过滤,取上清12 000 r/min 4 ℃离心5 min,沉淀用30 mL 0.85%NaCl重悬,加入4 g BCAC 于摇床150 rpm 吸附15 min后,玻璃棉过滤液12 000 rpm 离心10 min,沉淀用于后续细菌DNA的提取和Rti-LAMP扩增。
BCAC-EMA-Rti-LAMP 方法:人工模拟污染鱼肉样品见上,设置活细胞(V)和死细胞(D)比例(V∶D)为:0∶1 000,3∶997,10∶990,30∶970,100∶900,300∶700 和1 000∶0,其中活菌终浓度分别为0,6,20,60,200,600 和2 000 CFU/g。样品经BCAC 处理后,沉淀用0.2 mL 0.85%的生理盐水重悬,加EMA 至终浓度为6.0µg/mL,暗处理5 min 后用500 W 卤素灯光照15 min,然后12 000 r/min离心10 min,沉淀用于细菌DNA的提取和Rti-LAMP扩增。
1.3.6 市售新鲜鱼肉样品中的VP 检测 用BCAC-EMA-Rti-LAMP 检测市售新鲜海水鱼肉样品33 份,使用国标法(GB 4789.7—2013食品微生物学检验VP检验)和BCAC-Rti-LAMP进行对比检测。
2 结果与分析
2.1 VP的Rti-LAMP检测方法的建立
本研究设置了0,1,10,100,1 000,10 000 CFU/反应共6 个不同的梯度反应来建立VP 的Rti-LAMP定量检测方法,结果显示该方法可稳定检测低至1 CFU/反应。

图1 VP的Rti-LAMP扩增曲线及Tt值与Log CFU/反应的线性回归方程Fig.1 Rti-LAMP plots and linear detection plot ofVibrio parahaemolyticusderived from various numbers of log phase VP
2.2 E-Rti-LAMP检测模拟VP污染的鱼肉
预增菌4 h后,建立E-Rti-LAMP 检测鱼肉样品中VP方法,结果表明该方法检测灵敏度为10 CFU/g,检测过程约7 h(图2)。以不同的VP 梯度(Log CFU/g)与其对应的Tt值,建立回归方程为y=-7 764x+47.51,R²为0.942 4。
2.3 区分死、活细胞DNA的EMA浓度优化
如图3A 所示,当EMA 的终浓度为0、2、4、10µg/mL 时,两组36 CFU/反应和3 600 CFU/反应的EMARti-LAMP 扩增活VP,各组内的Tt值差异均不显著(P>0.05),说明EMA 处理对Rti-LAMP 扩增活细胞几乎没影响。
对热杀死VP检测结果如图3B所示,终浓度为6µg/mL EMA 能完全抑制两种含量VP死细胞DNA的扩增(设定完全抑制扩增的Tt值为60 min),而更低些浓度的EMA 处理,虽不能完全抑制死细胞DNA 的扩增,但可明显延迟甚至完全抑制DNA的扩增,说明EMA 能够有效地抑制热死的VP扩增。选定终浓度为6µg/mLEMA用于后续区分检测活的VP。
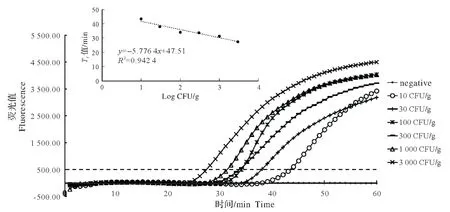
图2 Rti-LAMP增菌检测人工模拟VP污染的鱼肉样品的扩增曲线及Tt值与Log CFU/g的线性函数Fig.2 The fluorescence curves of the amplified products by Rti-LAMP with enrichment and linear detection plot ofVibrio parahaemolyticusderived from artificially contaminated marinefish
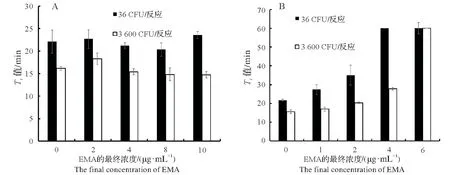
图3 EMA处理VP样品浓度的优化。Fig.3 Optimization of EMA concentration
2.4 BCAC-Rti-LAMP检测模拟污染鱼肉中VP
使用4 g BCAC 处理人工模拟污染VP 的鱼肉样品,不经过预增菌步骤,提取样品DNA 进行检测。结果显示,BCAC-Rti-LAMP 能检测4 CFU/gVP 污染的鱼肉样品,整个检测时间约4.5 h(图4)。以Tt平均值为纵坐标,Log CFU/g 为横坐标,线性回归方程为:y=-3.067 6x+19.421,决定系数R²=0.983 8,显示该方法具有良好的定量分析检测特性。
2.5 BCAC-EMA-Rti-LAMP检测模拟污染鱼肉中VP
对鱼肉模拟VP 污染后,经BCAC 和EMA 前处理后,Rti-LAMP 检测结果如图5 所示,该方法检测VP活菌的最低检出限为6 CFU/g,且整个检测时间约5 h。
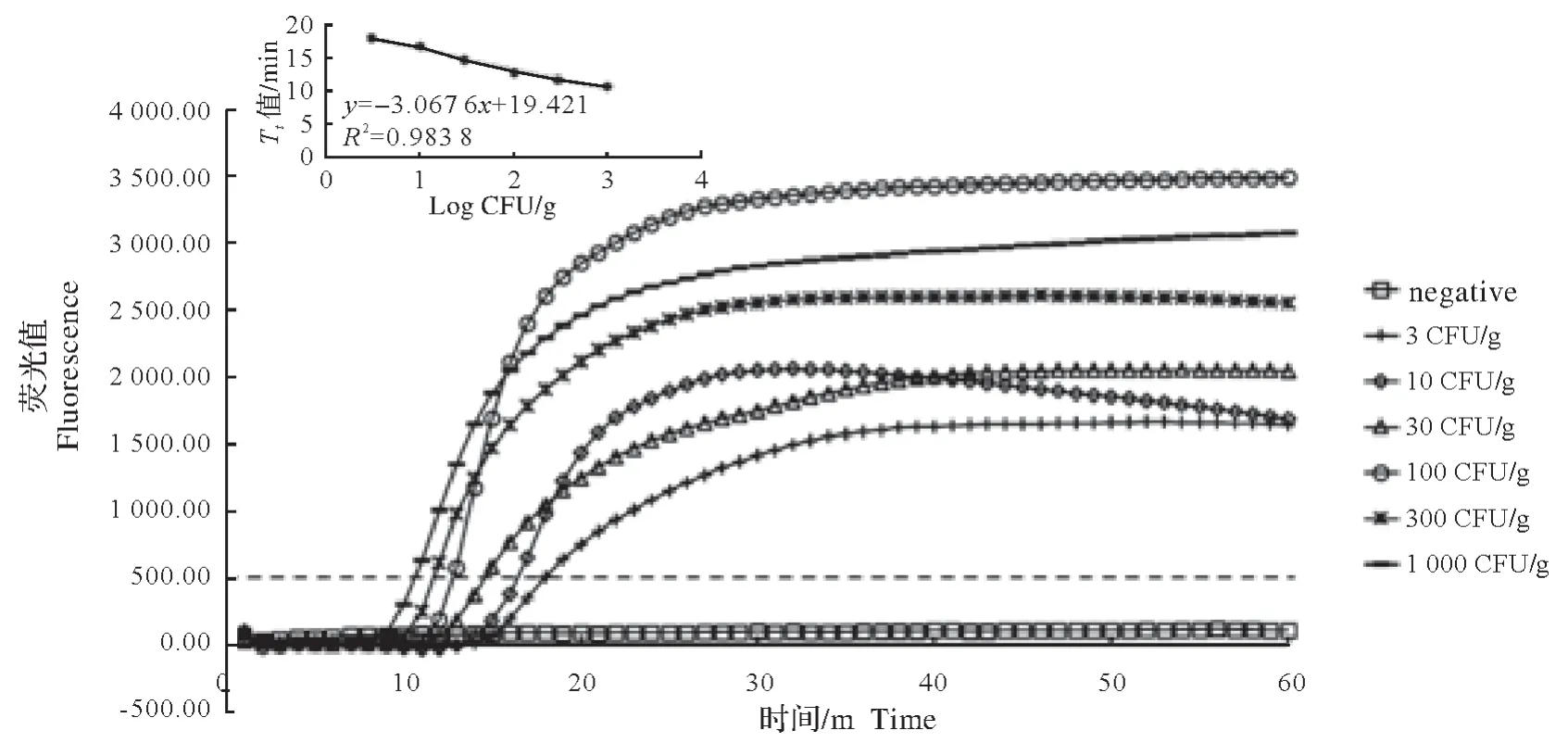
图4 BCAC-Rti-LAMP 法检测人工模拟VP污染鱼肉的扩增曲线及Tt值与Log CFU/g的线性函数Fig.4 The fluorescence curves of the amplified products by BCAC-Rti-LAMP and linear detection plot of VP derived from artificially contaminated marinefish
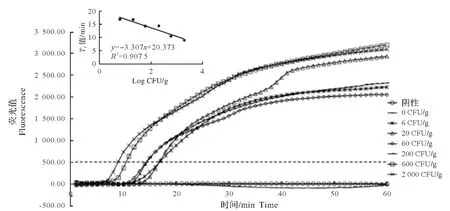
图5 BCAC-EMA-Rti-LAMP 法检测人工模拟VP污染鱼肉的扩增曲线线性函数Fig.5 The fluorescence curves of the amplified products by BCAC-EMA-Rti-LAMP and linear detection plot ofVibrio parahaemolyticusderived from artificially contaminated marinefish
2.6 市售鱼肉样品VP检测
从当地水产市场采集33 份生鲜鱼肉样品,采用BCAC-EMA-Rti-LAMP 和BCAC-Rti-LAMP 进行检测,同时用VP 国标检测法(GB 4789.7—2013 食品微生物学检验副溶血弧菌检验)作对照检测。实验结果表1 显示,国标法检测到2 份VP 阳性样品,BCAC-EMA-Rti-LAMP 法检测到3 份阳性样品,而BCACRti-LAMP法检测到6份阳性样品。
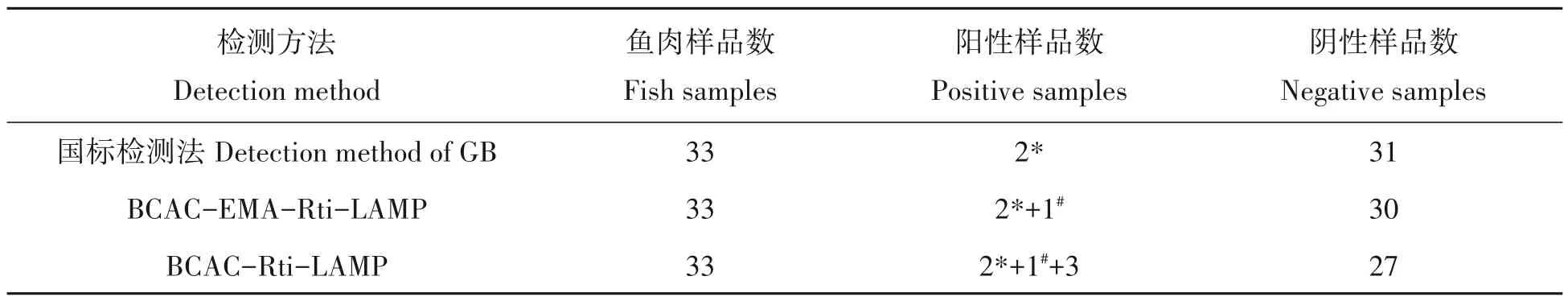
表1 3种检测方法对生鲜鱼肉样品VP的检测结果Tab.1 Detection of VP in fresh seafish samples by the three methods
3 讨论与结论
基于活菌浓度建立的线性回归方程为y=-2.392 8x+27.967,决定系数为0.971 3,表明BCAC-EMARti-LAMP 检测方法以活细胞DNA 为模板进行扩增,死细胞DNA(即使其浓度远高于活菌浓度)对DNA扩增影响很小。Cao 等[18]采用PMAxx-qPCR 方法在纯培养的细菌中,能检测到10.5 CFU/mL 的活VP,在不经过预增菌的虾样品中能检测到28 CFU/g 活的VP。Zhi 等[19]采用PMA(叠氮溴化丙锭)-Rti-LAMP方法检测活的霍乱弧菌,其检出限为110 CFU/mL。结果表明,BCAC-EMA-Rti-LAMP 方法具有较高的灵敏度。
BCAC-Rti-LAMP 和BCAC-EMA-Rti-LAMP 方法检测到同一份阳性样品而国标法未检测到,分析可能是由于超市购买的鱼肉样品中活菌的数量低,但Rti-LAMP 法更灵敏,也有可能存在活的但不可培养即VBNC 状态的VP 菌污染,国标法检测不出。相比较国标法和BCAC-EMA-Rti-LAMP 方法,BCAC-Rti-LAMP 的方法另外还检测到3 份阳性样品,推测是BCAC-Rti-LAMP 方法不能区分死、活细菌,出现假阳性结果。据牛乐耕[20]报道,海水鱼类在打捞后为了保鲜或者防止细菌生长繁殖必须进行保鲜处理,以确保运往市场时的新鲜度。保鲜贮藏方法如冷冻、盐藏、盐渍等均导致细菌活力下降进入活的非可培养状态(VBNC 状态)甚至死亡。细菌培养法只能检测活菌,因无法检出VBNC 状态的细菌而导致漏检。
本实验建立了一种VP 的Rti-LAMP 快速检测方法,其灵敏度达1 CFU/反应,进一步采用BCAC 和终浓度6µg/mLEMA 前处理后,建立的BCAC-EMA-Rti-LAMP 方法不需要预增菌培养即可有效区分死、活VP,在约5 h内实现快速检测食品样品中活的以及VBNC状态的目标细菌,检测灵敏度低至6 CFU/g相比国标检测法更快速、灵敏,有可能成为鱼肉VP污染的一种快速筛查检测方法。
