3-溴丙酮酸通过糖酵解抑制人肺腺癌H1975细胞增殖及诱导凋亡研究
2020-11-18樊红莲闵静婷吴胜男李正红
樊红莲,闵静婷,吴胜男,李正红
(蚌埠医学院基础医学院,安徽 蚌埠 233030)
肺癌是癌症死亡最常见的病因之一,每年约有180万人被诊断为肺癌,160万人死于肺癌[1]。非小细胞肺癌(non small cell lung cancer,NSCLC)占肺癌病例的85%,其中肺腺癌占40%,在非吸烟患者和女性中所占比例较高,约三分之一的患者在诊断初期即为肺癌晚期,根据病情阶段和地区的不同,肺癌患者的5年生存率在4%~17%之间,如何有效治疗肺癌,延长患者生命成为人们关注的问题[2-3]。目前临床对于肺癌治疗仍以手术治疗为优选,但是对于手术治疗无法切除的病灶以及微小转移灶,化疗则成为了更好的选择。临床针对肺癌采用的化疗药物大多数都具有严重的毒副作用,在杀死患者体内癌细胞的同时对患者的正常机体功能也造成了损伤。因此,寻找一种安全有效的化疗药物至关重要。
研究发现,细胞获取能量的方式有氧化磷酸化和无氧糖酵解两种,氧气充足时葡萄糖通过氧化磷酸化途径可以产生32分子腺苷三磷酸(ATP),而通过无氧糖酵解过程仅能获得2分子ATP[4]。正常细胞获取能量的70%都来自三羧酸循环,仅有20%来自糖酵解,而肿瘤细胞即使在氧气充足的情况下获取能量的方式也依然主要来自于糖酵解过程,产生能量有限,所以肿瘤细胞为保持增殖转移等活动会加速宿主对糖分的摄取和代谢,这一特点也成为了临床研究抗肿瘤药物的一大靶点[5]。
3-BP是一种小分子烷化剂,也是细胞糖酵解产物乳酸、丙酮酸的类似物,可以被细胞获取从而与乳酸、丙酮酸竞争阻断糖酵解过程,抑制肿瘤细胞摄取能量以杀死肿瘤细胞。近年来,3-BP被广泛用于抗肿瘤的临床前研究中,对乳腺癌、肝癌、胃癌等癌症具有明显的抗肿瘤效果[6-8],为了探究3-BP在针对肺腺癌治疗是否也能起到好的治疗效果,本实验选取肺腺癌H1975细胞,研究3-BP对肺腺癌H1975细胞的增殖及凋亡的作用及在此过程中的能量代谢变化,为3-BP在肺腺癌的临床应用提供实验依据。
1 材料与方法
1.1 细胞株人肺腺癌细胞株H1975购于北纳生物,由蚌埠医学院药学院冻存。
1.2 药品与试剂RPMI 1640培养基(Gibco,批号:C22400500BT),胎牛血清(Gibco,批号:10099141),MTT( Biofroxx,批号:3580MG250), Annexin V-FITC/PI 双染细胞凋亡试剂盒(Bestbio,批号:BB-4101-3),ATP检测试剂盒(碧云天,批号:S0026)、活性氧检测试剂盒(碧云天,批号:S0033S), HK-Ⅱ抗体(Proteintech,批号: 22029-1-AP),PDK抗体(CST,批号:3062T), MCT-1抗体(Abcam,批号:ab102678);Bax(批号:AF0120)、Bcl-2(AF0769)和β-actin(批号:AF7018)抗体均购自Affinity公司,3-BP(Sigma,批号:113-59-3)。
1.3 仪器Olympus倒置显微镜;Bio-Tek Synergy2型多功能酶标仪;BD流式细胞仪;上海天能化学发光凝胶成像系统;上海一恒科学仪器THZ-100恒温摇床。
1.4 方法
1.4.1细胞培养 非小细胞肺腺癌细胞株H1975培养于含10%胎牛血清、100 kU·L-1青霉素、100 mg·L-1链霉素的RPMI 1640培养基,于37 ℃、5%CO2恒温培养箱中培养。
1.4.2MTT法检测细胞增殖 取对数期生长良好的H1975细胞接种于96孔板中,每孔6 000个细胞;待细胞贴壁稳定24 h后,向细胞中加入不同浓度的3-BP(10、20、40、80、160 μmol·L-1)处理24和48 h,设置阴性对照孔和空白孔,每组设置3个复孔,处理时间到后向每孔加入MTT溶液(5 g·L-1)150 μL,放入37 ℃培养箱孵育4 h,弃去上层液,向每孔加入200 μL DMSO,摇床孵育20 min后放入酶标仪检测各孔OD值。细胞存活率/%=(给药孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)×100%;实验重复3次取平均值。
1.4.3集落克隆实验检测低浓度 3-BP对细胞增殖抑制能力接种对数期A549细胞于六孔板中,每孔4 000~5 000个细胞,24 h细胞贴壁后将3-BP按:0、5、10、20 μmol·L-1浓度加入各孔中,继续培养5~7 d;待显微镜下观察到细胞集落形成后,吸弃上清液,加入2~3 mL的PBS洗涤;每孔加入1~2 mL 4%多聚甲醛固定30 min,用PBS轻洗3次;吸取1~2 mL结晶紫染液对细胞进行染色,室温孵育15~20 min;用2~3 mL PBS清洗3次,将六孔板倒置放在实验台的滤纸上晾干,拍照。
1.4.4划痕实验检测细胞迁移能力 选择对数期生长的肺癌细胞接种于六孔板中,6×105个/孔,向每孔补足培养基至2 mL,放入37 ℃、5% CO2培养箱培养24 h;待细胞汇合度达90%时,用200 μL移液枪的枪头垂直六孔板底部划线,每隔0.5~1 cm划一条,每孔划3~4条直线并保持平行,显微镜下拍照记录0 h的划痕照片;按实验设计分为对照组和给药组,给药组3-BP浓度为:25、50、75 μmol·L-1;对照组为不给药组,按药物浓度给予药物,每组3个复孔,放进37 ℃、5% CO2培养箱培养24 h;培养时间到后取出六孔板,放在显微镜下观察拍照,记录数据以备后续分析处理;采用ImageJ分析计算细胞迁移的距离。
1.4.5Transwell实验检测细胞迁移能力 取生长情况良好的对数期肺癌细胞消化制成细胞悬液;将Transwell小室放入24孔板中,上室中加入稀释后的细胞悬液200 μL, 1×105个/孔,下室加入600 μL含15%FBS的新鲜完全培养基,按照实验分组给予药物浓度分别为:0、25、50、75 μmol·L-1,培养24 h;时间到后取出Transwell小室,将上室上清液弃去,用PBS小心漂洗3遍,4%多聚甲醛固定30 min,PBS漂洗后用棉签擦去上室没有迁移的细胞,加入结晶紫染液染色15 min,去除多余的结晶紫染液,倒扣小室进行晾干,随机挑选5个视野进行拍照,计算穿过膜的肺腺癌细胞的数目。
1.4.6Annexin Ⅴ/PI-FITC双染法检测细胞凋亡率 接种H1975细胞于六孔板内,每孔1.5×105个细胞,细胞贴壁后向各孔细胞内加入不同浓度的3-BP(0、25、50、75 μmol·L-1)进行处理24 h;吸弃上层废液,PBS清洗后加入胰酶消化,收集消化后的细胞加入400 μL 1×Binding buffer悬浮细胞,浓度为1×106个细胞·mL-1;吸取5 μL Annexin V-FITC加入EP管中,混匀后置于4 ℃避光孵育15 min;向管内加入PI染液10 μL,轻摇混匀后放入4 ℃ 5 min;将细胞转移至流式管内上机检测。
1.4.7流式细胞仪检测细胞内ROS水平的变化 取生长状态良好的H1975细胞接种在6 孔板中,细胞贴壁后向各孔加入不同浓度的3-BP(0、50、100、150 μmol·L-1)处理6 h,消化收集处理后的细胞离心1 000 r·min-1,5 min,用无血清培养基稀释荧光探针DCFH-DA,稀释比例为1 ∶1 000,稀释后加入收集后的细胞中,每毫升可装载1×106个细胞,放入培养箱37 ℃孵育20 min,3~5 min将试管进行上下颠倒使细胞混匀,让探针可以尽可能多地进入细胞;取PBS洗涤细胞3次以洗去多余的未装载的DCFH-DA探针,将细胞转移至流式管内上机检测,保留数据进行后续处理分析。
同学们,如果你也喜欢汉服,就来“最美汉服秀”晒一晒你身着汉服的美照吧,说不定下一期杂志上就会出现你的身影哦。
1.4.83-BP处理后H1975细胞内部ATP水平测定 接种H1975细胞于6孔板中,每孔2.0×105~2.5×105个细胞,加入2 mL培养液等待细胞贴壁;吸弃上层液,加入相应浓度的3-BP,阴性对照组不加入药物,放入培养箱处理5 h;时间到后取出培养板,吸弃上清液,每孔加入200 μL ATP裂解液,置于冰上裂解;裂解后离心,4 ℃,12 000 r·min-1离心5 min,吸取离心后的上清液于一新的EP管内;取ATP检测工作液放入黑色96孔板中,每孔100 μL,将各组待测样品加入96孔板内,放入多动能酶标仪中进行检测,保存结果用于后续分析。
1.4.9Western blot检测蛋白表达水平 接种H1975细胞于35mm中皿内,细胞贴壁后加入终浓度为25、50、75 μmol·L-1的3-BP和阴性对照组处理24 h,消化收集细胞,加入100 μL细胞裂解液置于冰上裂解1 h,4 ℃离心15 min,12 000 r·min-1,收集上清液并测定浓度。40 μg蛋白上样,电泳2 h,转膜,快速封闭液封闭20 min。加入一抗,4 ℃过夜,d 2取出膜,TBST洗涤,10 min/次,4次,加入二抗(1 ∶10 000),37 ℃ 孵育60 min,60 r·min-1摇床30 min,TBST洗涤,10 min,4次,浸入显影剂曝光,保存图片用于后续分析。采用ImageJ测定各显示条带的灰度值,以目的条带与β-actin灰度值的比值为目的蛋白的相对表达量。
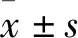
2 结果
2.1 3-BP对H1975细胞的增殖抑制作用为观察3-BP对H1975细胞增殖的影响,实验中采用不同浓度的3-BP处理肺腺癌细胞24 h、48 h,MTT结果显示,3-BP对肺腺癌H1975细胞具有明显的增殖抑制作用,并且随时间和浓度的增加而增加。集落克隆结果显示,在选用了低浓度的5、10、20 μmol·L-1的 3-BP处理后,与阴性对照组相比,3-BP给药组细胞克隆形成数目明显减少,与对照组相比差异有统计学意义(P<0.05,见Fig 1和Fig 2)。
2.2 3-BP对H1975细胞迁移能力的影响为观察3-BP对H1975细胞迁移的影响,实验中采用不同浓度的3-BP处理H1975细胞24 h,观察划痕愈合率和穿孔细胞数目。结果显示,3-BP对肺腺癌H1975细胞具有迁移抑制作用,并且随浓度的增加抑制作用更加明显。与阴性对照组相比差异具有统计学意义(P<0.05,见Fig 3和Fig 4)。
2.3 3-BP诱导肺腺癌H1975细胞凋亡AnnexinV-FITC/PI双染检测3-BP对H1975细胞凋亡率的影响,结果显示,25、50、75μmol·L-1的3-BP处理后,与对照组相比,3-BP给药组H1975细胞凋亡率明显升高,随着给药浓度的增加,凋亡率也随之上升(P<0.05,见Fig 5)。

Fig 1 Effect of 3-BP on cell proliferation of H1975

Fig 2 Effect of colony formation of H1975 cells by 3-BPA:Control group; B: 5 μmol·L-1 group; C: 10 μmol·L-1 group; D: 20 μmol·L-1 group;**P<0.01 vs control group
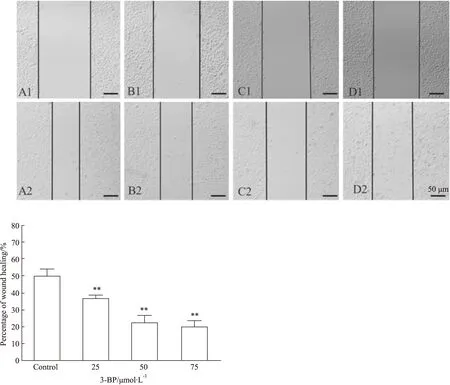
Fig 3 Scratch test results of H1975 cells with 3-BP(×100)A:Control group; B: 25 μmol·L-1 group; C: 50 μmol·L-1 group; D: 75 μmol·L-1 group.**P<0.01 vs control group.

Fig 4 Effect of 3-BP on migration of H1975 cells (×200)A:Control group; B: 25 μmol·L-1 group; C: 50 μmol·L-1 group; D: 75 μmol·L-1 group.**P<0.01 vs control group.
2.5 3-BP对凋亡相关蛋白表达的影响3-BP作为糖酵解抑制剂,为了进一步了解其作用于肺腺癌细胞过程中能量代谢及凋亡相关蛋白的变化,通过Western blot法检测糖酵解相关的HK-Ⅱ、MCT-1和PDK以及凋亡相关的Bax和Bcl-2蛋白水平的变化。由Fig 5可知,在经过3-BP处理后的H1975细胞与阴性组相比,HK-Ⅱ、MCT-1蛋白明显降低,促凋亡蛋白Bax明显升高,抗凋亡蛋白Bcl-2明显降低,在蛋白水平也可表明3-BP对肺腺癌细胞具有诱导凋亡作用。各组间差异具有统计学意义(P<0.05,见Fig 7)。

Fig 7 Changes of glycolysis and apoptosis related proteins in H1975 cells by 3-BP*P<0.05 vs control group.

Fig 6 Changes of active oxygen and ATP levels in H1975 cells by 3-BPA: Active oxygen test result; B: ATP test result.**P<0.01 vs control group.

Fig 5 Effect of 3-BP on apoptotic rate of H1975 cellsA:Control group; B: 25 μmol·L-1 group; C: 50 μmol·L-1 group; D: 75 μmol·L-1 group.*P<0.05,**P<0.01 vs control group.
3 讨论
糖酵解是肿瘤细胞获取能量的主要方式,研究发现,肿瘤细胞比正常细胞通过糖酵解获能多200倍。肿瘤细胞具有很高的葡萄糖摄取率和糖酵解代谢率,它们的大部分能量由糖酵解提供,同时保持乳酸生成速率的增加以获得更加有利的生存环境。2-脱氧葡萄糖(2-Deoxy-D-Glucose,2-DG)和3-BP是目前研究中常用的两种HK-Ⅱ抑制剂,在临床前研究中均表现出了良好的抗肿瘤作用,在最近的临床试验中,2-DG治疗前列腺癌和颅内肿瘤的临床试验已经暂停,主要原因是药物在杀伤癌细胞的同时对正常的非癌细胞也造成了损害,也可能对癌细胞有促进生存作用[4,9-10]。3-BP作为小分子药物,通过单羧酸转运蛋白(MCT)转运至细胞内抑制糖酵解来发挥抗肿瘤作用。临床前研究表明,在对肝癌大鼠采用动脉灌注3-BP治疗后,肿瘤平均坏死率高于对照组(即未给予治疗组),实验组瘤体细胞中VEGF和MMP9表达明显下降,降低肝癌细胞的转移和侵袭能力[11]。本实验结果显示,3-BP明显抑制肺腺癌H1975细胞的增殖,明显降低了H1975细胞的迁移能力。
细胞凋亡是一种程序性细胞死亡,具有不同的生化和遗传途径,有助于消除不必要的细胞,以保持机体健康平衡[12]。研究发现癌前病变中细胞凋亡受到了抑制,药物治疗后可以通过诱导凋亡来清除潜在的有害DNA损伤细胞,从而阻止癌变。因此,凋亡途径的失调可能促进肿瘤的发生,而且使癌细胞对治疗产生抵抗,如何诱导细胞凋亡也是癌症治疗的一个关键点。Bax是一种促凋亡基因,当其表达升高时可以改变线粒体膜的通透性,使其释放促凋亡的细胞因子,激活半胱氨酸天冬氨酸蛋白酶(caspase)家族,诱导细胞凋亡[13]。Bcl-2通过与Bax结合拮抗其促凋亡作用,从而抑制细胞凋亡,二者比值表明了细胞凋亡水平[14]。HK-Ⅱ的N端可以结合线粒体外膜电压依赖性阴离子通道(VDAC),阻止Bax与VDAC结合,维持线粒体稳态,阻止促凋亡因子释放,从而抑制细胞凋亡[15-16]。我们的实验结果也显示,3-BP诱导H1975细胞凋亡中伴随着ATP水平下降和活性氧水平的升高,HK-Ⅱ活性受到抑制,MCT1表达下降,Bcl-2/Bax比值下降,3-BP可能通过抑制HK-Ⅱ活性从而抑制细胞糖酵解过程诱导肺腺癌细胞发生凋亡。
综上所述,本研究证明3-BP可以有效地抑制肿瘤细胞增殖,诱导非小细胞肺腺癌H1975细胞凋亡,其机制可能是通过抑制糖酵解过程,下调Bcl-2并上调Bax的表达水平,引起线粒体膜通透性改变,进而诱导细胞凋亡。本研究表明3-BP对非小细胞肺腺癌具有潜在的治疗价值,为3-BP治疗非小细胞肺腺癌提供了重要的实验依据。
