HDAC抑制剂调控免疫细胞功能及在自身免疫病中的应用进展
2020-11-18申艳佳王金华杜冠华
申艳佳,杨 冉,陈 渺,王金华,张 莉,李 莉,杜冠华
(中国医学科学院&北京协和医学院药物研究所,北京市药物靶点研究与新药筛选重点实验室,北京 100050)
染色质组蛋白的乙酰化水平在基因的表观遗传学调控和细胞的生理功能调节中具有关键作用。组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂可抑制HDACs的活性,大量研究报道,HDAC抑制剂可以抑制肿瘤细胞的增殖和诱导细胞凋亡,发挥抗肿瘤作用,已广泛用于抗肿瘤治疗[1]。近年来,HDAC抑制剂在免疫系统中的作用研究越来越多,本文对近期HDAC抑制剂对免疫细胞的调控作用及在自身免疫病中的应用进行综述,以期为后续研究提供参考。
1 HDACs家族
迄今为止,已在哺乳动物细胞内鉴定出18种HDACs,根据其结构域和酵母蛋白序列同源性分为4类[2]。
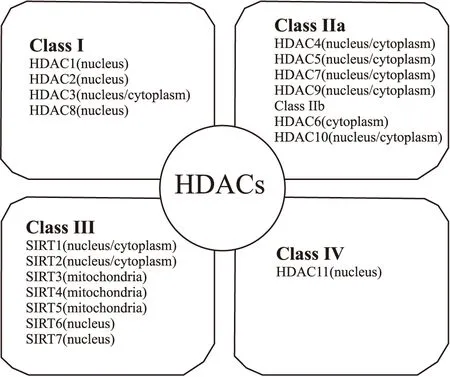
Fig 1 Classes and subcellular localization of histone deacetylase (HDAC) enzymes
Ⅰ类HDACs与酵母转录调节因子Rpd3同源,主要定位于细胞核内且具有较高的酶活性,包括HDAC1、HDAC2、HDAC3和HDAC8。
Ⅱ类HDACs与酵母Hda1蛋白同源,分为Ⅱa类HDACs和Ⅱb类HDACs。Ⅱa类HDACs包括HDAC4、HDAC5、HDAC7和HDAC9,其特点是蛋白氨基末端延伸,含磷酸化位点和蛋白结合域。Ⅱa类HDACs以磷酸化依赖性方式在细胞核与细胞质之间穿梭。Ⅱb类HDACs包括HDAC6和HDAC10,其特点是蛋白缺乏氨基末端延伸,但具有2个催化结构域。
Ⅲ类HDACs(也称sirtuins)由SIRT1-7组成,与酵母HDAC蛋白SIR2同源,是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)依赖性酶。Sirtuins调节多种生物功能,例如氧化压力、DNA修复、新陈代谢和衰老等。
HDAC11为Ⅳ类HDAC,其具有Hda1和 Rpd3的序列保守性,在脑、心脏、睾丸和肾脏中高表达。Ⅰ类、Ⅱ类和Ⅳ类的HDACs均为锌离子依赖型酶,也称为经典型HDACs。
2 HDAC抑制剂
HDAC抑制剂是一类抑制HDACs活性的分子。根据其化学结构,HDAC抑制剂可分为5类[3]:(1)异羟肟酸类,如曲古抑菌素A(trichostatin A,TSA)、伏立诺他(vorinostat,suberoylanilide hydroxamic acid,SAHA)、贝利司他(belinostat)、帕比司他(panobinostat)和Abexinostat;(2)短链脂肪酸类,如丙戊酸钠(valproic acid,VPA)和丁酸钠(sodium butyrate);(3)环状肽类,如罗米地辛(romidepsin);(4)苯甲酰胺类,如恩替诺特(entinostat, MS-275)、西达本胺(chidamide)和tubastatin A;(5)sirtuins抑制剂,如Selisistat(EX-527)和烟酰胺(nicotinamide)。
根据对HDACs的特异性,也可以将这些抑制剂分为4类[3]:(1)广谱HDAC抑制剂,如贝利司他、曲古抑菌素A(TSA)、伏立诺他(SAHA)和帕比司他,可抑制Ⅰ、Ⅱ和Ⅳ类HDACs活性;(2)Ⅰ类和Ⅱ类HDACs抑制剂:如丙戊酸钠(VPA)和resminostat;(3)Ⅰ类HDACs特异性的抑制剂:如恩替诺特(MS-275)和CXD-101;(4)选择性HDAC抑制剂:如citarinostat(ACY-241)、Ricolinostat(ACY-1215)、ACY-738、Tubastatin A、选择性抑制HDAC6活性的CKD-L和CKD-506和靶向HDAC1的pyroxamide等。
目前,美国食品药品监督管理局(Food and Drug Administration, FDA)已批准上市的HDAC抑制剂有伏立诺他、贝利司他、帕比司他、罗米地辛和丙戊酸钠,分别用于治疗皮肤T细胞淋巴瘤、复发性或耐药性T细胞淋巴瘤、多发性骨髓瘤、皮肤T细胞淋巴瘤和癫痫。西达本胺是Ⅰ类和IIb类HDAC抑制剂,于2014年被中国食品药品监督管理局(China Food and Drug Administration, CFDA)批准用于治疗复发及难治性外周T细胞淋巴瘤 。此外还有多种HDAC抑制剂目前正处于临床试验各个阶段,主要用于抗肿瘤治疗。
3 HDAC抑制剂对免疫细胞功能的调控
大量研究证明,HDACs参与调控机体的固有免疫和适应性免疫过程。HDACs主要通过调控Toll样受体(Toll-like receptor,TLR)和干扰素(interferon,IFN)信号通路影响机体固有免疫过程,而在适应性免疫过程中,HDACs可调控抗原提呈过程,淋巴细胞的生长、分化与极化等。本文以免疫应答过程中发挥作用的免疫细胞为切入点,对近年来HDAC抑制剂在免疫应答中的作用进行综述。
3.1 HDAC抑制剂对自然杀伤(natural killer, NK)细胞功能的调控HDAC抑制剂可调控NK细胞的凋亡、NK细胞对肿瘤细胞的识别和杀伤等过程。有报道广谱HDAC抑制剂TSA可促进NK细胞的凋亡,显著抑制IL-12、IL-15和IL-18共同诱导的NK细胞IFN-γ的分泌。将NK细胞与慢性粒细胞白血病细胞K562以1 ∶3比例混合,1 μmol·L-1TSA作用于混合细胞24 h可显著抑制K562细胞的凋亡,这说明TSA可抑制NK细胞对肿瘤细胞的杀伤作用[4]。
有研究显示,Ⅰ类HDAC抑制剂恩替诺特(MS-275)呈时间和剂量依赖性上调NK细胞表面的主要活化性受体NKG2D(natural killer group 2 member D)表达,促进NK细胞对人结直肠癌细胞HCT-15的识别和杀伤作用,且对NK细胞的活性无显著影响[5]。而另有研究指出Ⅰ类和Ⅱ类HDAC抑制剂VPA可通过抑制STAT3磷酸化和降低HDAC3表达水平进而下调NK细胞的NKG2D表达,抑制NK细胞对神经母细胞瘤细胞COL、结直肠癌细胞HCT-15和成骨肉瘤细胞SaOS2的杀伤作用[6]。
这些研究表明,不同HDAC抑制剂对NK细胞的作用不同,可能是因为HDAC抑制剂作用的HDACs亚型不同,HDAC抑制剂可通过调控NKG2D的表达水平控制NK细胞对肿瘤细胞的识别和杀伤作用。
3.2 HDAC抑制剂对树突状细胞功能的调控树突状细胞是专职抗原提呈细胞(antigen presenting cell,APC),机体受到外部刺激或自身发生损伤时,被激活并募集和活化其他免疫细胞,诱导适应性免疫。研究发现,HDAC抑制剂可调控树突状细胞的成熟、迁移、共刺激分子的表达,以及炎症因子分泌等。预孵育TSA可以剂量依赖性地抑制脂多糖(lipopolysaccharide,LPS)激活的树突状细胞的抗原提呈活性,其原因为TSA抑制了树突状细胞的分化成熟[7]。进一步研究发现,TSA还可以通过调控树突状细胞成熟过程,抑制趋化因子受体4(chemokine receptor 4,CXCR4)介导的树突状细胞迁移[8]。
CD40是免疫反应重要的共刺激分子,可调控T细胞活化、抗原提呈细胞激活等生物学过程。CD80、CD83和CD86是树突状细胞发育成熟的重要指标,而CD80和CD86可作为激活T细胞的重要协同刺激分子。MS-275以及VPA可显著下调CD40、CD80和CD83的表达,但对CD86的表达影响较小。VPA通过调控核转录因子κB(nuclear transcription factor-κB,NF-κB)和IFN调节因子(IFN regulatory factor,IRF)信号通路抑制共刺激物和黏附分子的表达,进而调控树突状细胞的分化以及炎症因子的分泌[9]。
细胞因子是固有免疫反应的标志,不仅可以调控免疫效应T细胞的分化,还可以激活或抑制APC。研究表明, HDAC抑制剂可以调控树突状细胞炎症因子的分泌。VPA可显著抑制LPS刺激的未成熟树突状细胞分泌IL-10、IL-17、IL-23、IL-6和TNF-α,促进IL-8分泌,从而抑制了LPS刺激的未成熟树突状细胞诱导Th17细胞极化[10]。
3.3 HDAC抑制剂对B淋巴细胞功能的调控Ⅰ类HDACs HDAC1和HDAC2对于B淋巴细胞的增殖和生长至关重要。B淋巴细胞内HDAC1和HDAC2同时缺失可阻断早期B淋巴细胞生长,诱导B淋巴细胞凋亡,单独敲除两个基因的任何一个对于B淋巴细胞生长无显著影响。然而,对于成熟未分裂的B淋巴细胞,同时敲除HDAC1和HDAC2对B淋巴细胞生长、凋亡并无显著影响[11]。Ⅱa类HDACs 如HDAC4、HDAC5和HDAC7也参与调控B淋巴细胞的活化、分化和凋亡等过程[12]。VPA可通过干扰B淋巴细胞增殖,从而抑制初始B淋巴细胞分化成为分泌免疫球蛋白的浆细胞,但是VPA对记忆性B淋巴细胞的分化及活化并无影响[13]。
3.4 HDAC抑制剂对T淋巴细胞功能的调控CD4+T细胞在诱导适应性免疫中至关重要。研究发现HDAC抑制剂对CD4+T细胞的增殖、凋亡、炎症因子生成等均具有调控作用。据报道TSA作用小鼠源CD4+T细胞可显著抑制细胞增殖,诱导细胞凋亡。TSA通过抑制NF-κB的核转位降低CD4+T细胞中IL-2的表达水平,另外它还可以改变细胞表面蛋白,如IL2Rα、IL2Rβ、LFA-1、CD11c、CD28、CD40和CD40L等的表达水平调控CD4+T细胞的功能[14]。
CD8+T细胞也可称为细胞毒性T细胞,可通过细胞裂解和凋亡等杀伤肿瘤细胞等。研究显示,Ⅰ类HDAC抑制剂恩替诺特(MS-275)可通过促进CD8+T细胞的增殖、增强其杀伤活性,以及对肿瘤细胞的识别能力来抑制肿瘤细胞增殖[15]。HDAC6特异性抑制剂ACY-1215则可通过调控CD8+T细胞的活化及功能缓解超敏反应和移植物抗宿主病,ACY-1215作用CD8+T细胞48 h可显著抑制细胞的增殖,同时ACY-1215可抑制介导初始CD8+T细胞分化为效应CD8+T细胞的关键因子IL-2和IFN-γ的表达[16]。
调节性T细胞是一类具有免疫抑制活性的CD4+T细胞亚群。研究发现,TSA可促进组蛋白乙酰化,进而诱导初始CD4+T细胞向调节性T细胞分化;另外,TSA还可增强调节性T细胞对羧基荧光素二醋酸盐琥珀酰亚胺酯(carboxyfluoroscein succinimidyl ester,CFSE)标记的初始CD4+T细胞增殖的抑制活性[17]。调节性T细胞可预防小鼠结肠炎并减轻已建立的结肠炎症状,而Ⅱa类HDACs HDAC9参与调控调节性T细胞的功能。研究发现,在葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的炎症性肠病模型中,广谱HDAC抑制剂TSA和SAHA(伏立诺他)可增加小鼠淋巴样组织中调节性T细胞数量,并增强调节性T细胞对CFSE标记的T细胞增殖的抑制活性。HDAC9敲除鼠中调节性T细胞对CFSE标记的效应T细胞的免疫抑制活性增强,FoxP3和IL-10的mRNA水平显著上调,提示减少调节性T细胞中HDAC9的表达或功能的策略可能用于治疗结肠炎或其他自身免疫病[18]。上述研究说明,Ⅱ类HDACs参与调控调节性T细胞的增殖和免疫抑制活性,而抑制Ⅱ类HDACs活性可促进调节性T细胞增殖,并增强其对效应T细胞的免疫抑制活性。
4 HDAC抑制剂在自身免疫病中的应用
HDAC抑制剂广泛用于肿瘤的治疗,也有研究报道,HDAC抑制剂可通过神经保护、神经营养、抗炎等作用治疗神经退行性疾病。HDAC抑制剂可调控机体的免疫应答,这提示其可能用于治疗自身免疫病。
4.1 HDAC抑制剂与类风湿关节炎表观遗传学如组蛋白修饰等在类风湿关节炎中发挥着重要作用。研究表明,HDAC抑制剂可通过调控炎症因子生成、T细胞分化、巨噬细胞和树突状细胞的功能、成纤维样滑膜细胞增殖等治疗类风湿关节炎[19]。
HDAC抑制剂可调控巨噬细胞炎症反应,抑制促炎细胞因子TNF-α、IL-1β、IL-6和IL-12的生成[19]。广谱HDAC抑制剂LAQ824(Dacinostat)显著降低诱导巨噬细胞和树突状细胞迁移的趋化因子及其受体(如MCP-1、MCP-2、MCP-3、CCL15、CCL23、CCR1和CCR5等)的mRNA水平。LAQ824选择性调控树突状细胞的功能,抑制树突状细胞介导的Th1细胞活化及迁移,但对Th2细胞无显著影响[20]。广谱HDAC抑制剂TSA通过抑制PI3K/Akt信号通路活化,降低类风湿关节炎成纤维样滑膜细胞的侵袭能力,诱导其凋亡[21]。
在类风湿关节炎动物模型上,Ⅰ类HDACs特异性抑制剂MS-275可以发挥抗关节炎作用[22]。Ⅱb类HDACs HDAC6参与调控类风湿关节炎的病理过程,在胶原诱导的关节炎模型中,选择性HDAC6抑制剂CKD-L显著上调Foxp3+T细胞中细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte associated protein 4,CTLA-4)的表达,并抑制效应T细胞的增殖,进而降低关节炎评分[23]。
上述研究结果提示,HDAC抑制剂有望用于类风湿关节炎的治疗,但是应注意研究HDAC抑制剂的选择性,以减少其应用过程中产生的副作用。
4.2 HDAC抑制剂与多发性硬化HDAC抑制剂对多发性硬化的治疗作用研究报道较多。在多发性硬化的经典动物模型实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型中,腹腔注射TSA可改善模型组小鼠脊髓炎症反应,抑制神经元及轴索损伤,研究发现其机制可能与TSA通过诱导T淋巴细胞耐受,抑制T细胞向脊髓浸润有关[24]。伏立诺他(SAHA)则可通过抑制树突状细胞的成熟和分化,抑制TNF-α、IFN-γ、Th1细胞极化因子IL-12p35和Th17细胞极化因子IL-6、IL-23p40的生成,进而缓解EAE模型小鼠中枢神经系统炎症反应和髓鞘脱失[25]。以上研究提示,HDAC抑制剂亦可作为治疗多发性硬化的潜在候选药物。
4.3 HDAC抑制剂与系统性红斑狼疮HDAC抑制剂具有免疫抑制作用,可通过增加调节性T细胞的数量、调控巨噬细胞活化及T细胞和B细胞的分化、抑制促炎细胞因子生成等治疗系统性红斑狼疮。腹腔注射1.0 mg·kg-1TSA可增加CD4+CD25+Foxp3+调节性T细胞的数量,降低脾脏中IL-6的mRNA表达水平并增加TGF-β和Foxp3的表达,减少肾脏中自身抗体的生成[26]。VPA则可选择性激活单核细胞来源的巨噬细胞,上调M2型巨噬细胞的Marker基因CD163和MRC-1的表达,而下调M1型巨噬细胞Marker基因IDO-1的表达,抑制促炎细胞因子TNF-α的生成,并促进抗炎细胞因子IL-10和TGF-β的产生,进而发挥抗炎免疫作用[27]。然而,非特异性HDAC抑制剂在应用过程中由于机制较为复杂,可能产生副作用,因此需要进一步注意研究HDAC抑制剂的选择性。
在系统性红斑狼疮的动物模型中,HDAC6的表达显著上调,而抑制HDAC6可显著改善疾病。HDAC6的特异性抑制剂ACY-738可抑制免疫复合物介导的肾小球肾炎、降低血清中抗双链DNA抗体的水平,降低系统性红斑狼疮相关炎症因子IL-10、IL-6和IL-1β的mRNA水平,减少肾小球中免疫复合物的生成,并增加脾脏中调节性T细胞的数量,进而改善疾病严重程度,其机制可能与ACY-738调控T细胞和B细胞的分化相关[28]。CKD-506亦是HDAC6的特异性抑制剂,在先天发病的自发性狼疮模型NZB/W小鼠中,CKD-506显著提高模型小鼠生存率,降低血液中尿素氮水平和肾小球中IgG和C3水平,抑制肾炎的发生。CKD-506还可以减少肾脏中促炎细胞因子和趋化因子如IFN-γ、IL-1β、 IL-4、IL-6、IP-10、MCP-1和CCL4等的生成,改善狼疮性肾炎而无副作用[29]。
4.4 HDAC抑制剂与炎症性肠病炎症性肠病是一种以肠黏膜反复出现慢性炎症为特点的疾病,可导致严重并发症甚至致残。在DSS诱导的炎症性肠病模型中,广谱HDAC抑制剂TSA和SAHA(伏立诺他)可缓解小鼠体质量减轻、出血、腹泻等症状,降低促炎细胞因子IL-2、TNF-α和IFN-γ的mRNA水平,增加FoxP3和抗炎细胞因子IL-10的mRNA水平,预防小鼠结肠炎。其机制可能与增加小鼠淋巴样组织中调节性T细胞数量,并增强调节性T细胞对CFSE标记的T细胞增殖的抑制活性相关[18]。丁酸盐是一种Ⅰ类和Ⅱ类HDAC抑制剂,可为结肠细胞提供能量,同时具有抗炎和抗增殖的作用,从而维持肠道稳态。丁酸盐目前被广泛用于治疗炎症性肠病,其主要作用机制包括调控调节性T细胞的活化、促进组蛋白乙酰化、抑制NF-κB活化以及促进肠上皮细胞分泌粘液等[30]。与其他炎症性疾病相似,在炎症性肠病中,HDAC抑制剂可能通过多种机制缓解疾病严重程度。
5 总结与展望
HDAC抑制剂具有免疫调节作用,其可调控免疫反应中发挥作用的免疫细胞的生成及功能。HDAC抑制剂主要通过调控树突状细胞的成熟分化、调节性T细胞的免疫抑制功能、效应T细胞诱导的免疫反应,以及细胞因子生成等方面治疗自身免疫病。然而研究发现,一些广谱HDAC抑制剂对自身免疫病的疗效显著,但因抑制多种HDAC亚型,可影响机体的多种分子进程,对机体产生不良反应。因此,确定参与疾病过程调控的具体HDACs以及研发其特异性的HDAC抑制剂,将有助于避免药物在治疗自身免疫病中发生的不良反应,是目前HDAC抑制剂研究的重要方向。
