银杏酸对肿瘤的作用研究进展
2020-11-18陶泽璋
肖 玉,李 芬,陶泽璋
(武汉大学人民医院耳鼻咽喉头颈外科,湖北 武汉 430060)
银杏属于银杏植物科。银杏树被认为是地球上最古老的生物之一,已经在森林中繁衍了1.5亿年,因此被称为“活化石”[1]。它已被用作传统药物,其叶中含有各种糖苷和萜类化合物,它们可以发挥多种药理活性,例如抗炎、光保护、保肝,以及在心血管疾病预防和治疗中的强心作用等[2-4]。现已有成熟的银杏叶提取物(ginkgo biloba P.E,GBE)制剂应用于临床,作为认知功能下降和阿尔兹海默症的治疗用药。大量药理研究表明,GBE中萜烯三内酯和类黄酮在认知功能减退治疗中发挥主要药理作用[5]。银杏酸(ginkgolic acid,GA)也存在于银杏叶提取物制剂中,由于其潜在毒性,将含量控制在5×10-6以下也成为这种提取制剂的质量控制标准。此时银杏酸的药用价值还未得到发掘跟重视,是被当成一种有害物质来认识的。自1997年发现银杏酸以来,它的分离纯化也一直在发展进步。2001年,Teris等[6]利用双柱高效液相色谱法从银杏叶中分离出5种银杏酸,分别为C13:0、C15:0、C15:1、C17:1、C17:2。这其中C15:1,C17:1以及C17:2含量相对较高。相对应的,关于银杏酸的大部分研究也是围绕C15:1和C17:1这两种来展开。
自银杏酸被作为单独化合物分离以来,关于其生物活性的研究报道不断涌现。所覆盖领域也相当广,早期主要包括抗菌活性、神经保护作用、病毒的抑制活性、抗炎活性等等。近年来,银杏酸的抗肿瘤作用被认知并逐渐受到越来越多人的关注。到底这种存在于中国传统草药银杏中的酚酸类化合物对肿瘤的抑制作用如何呢?本文将根据文献研究,从银杏酸对肿瘤细胞增殖与转移的抑制作用入手,探讨其发挥影响的深层机制,从而进一步提高我们对银杏酸的认识。
1 银杏酸的结构与生物学特性
银杏酸是银杏叶中结构相关的正烷基酚酸化合物的混合物,是6-烷基或6-烯基水杨酸的衍生物。根据侧链的不同可分为五种,结构见Fig 1,其中C15:1含量较高,在其中具有代表性。
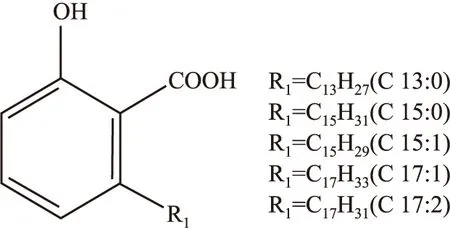
Fig 1 Molecular structures of ginkgolic acids
银杏酸具有多种生物学特性。根据文献,银杏酸可直接结合E1连接酶,通过阻断E1-SUMO中间体的形成来广泛抑制蛋白质SUMOylation(SUMO化)[7],它的许多功能也与SUMO化密不可分。例如,银杏酸作为SUMO化抑制剂,有助于抑制α-突触核蛋白和tau蛋白的聚集,为帕金森病以及阿尔兹海默症的治疗提供新思路[8-9]。银杏酸在部分肿瘤细胞中发挥作用也与其SUMO化抑制剂的角色有关。银杏酸具有破坏MDCK细胞中线粒体和溶酶体的潜在能力,可能有潜在肾毒性[10]。银杏酸还具有肝毒性, Jiang等[11]的研究表明银杏酸C15:1引起许多代谢紊乱,包括氧化应激和嘌呤代谢,引起肝损伤。另外,药物动力学分析表明,银杏酸Ⅰ和Ⅱ相代谢在人和大鼠肝微粒体中具有相似的代谢特征。参与GA(17 ∶1)代谢的药物代谢酶为人CYP1A2,CYP3A4,UGT1A6,UGT1A9和UGT2B15[12]。总的来说,银杏酸能抑制SUMO化,还可抑制部分酶的活性,但有肝肾毒性。除此之外,银杏酸具有较广泛的生物活性,其中抗肿瘤特性是近年来研究的热点及重点。实验表明,其可在结肠癌、胃癌、口腔鳞状细胞癌、肝细胞癌以及乳腺癌的治疗中发挥积极的作用,通过不同途径抑制肿瘤的发生发展。
2 银杏酸对肿瘤的抑制作用
肿瘤的生长增殖及侵袭转移受众多因素的调控。随着肿瘤发病率的日益提高,寻找高效抗肿瘤药物迫在眉睫。近年的研究发现,银杏酸作为实验中的治疗用药在抑制肿瘤方面有重要的作用。
2.1 银杏酸与细胞增殖肿瘤细胞的增殖能力关乎其生长速度,是评判其良恶程度的指标之一。对细胞增殖的抑制作用也是筛选抗肿瘤药物的一个重要方向。银杏酸以浓度和时间依赖的方式抑制结肠癌细胞系SW480细胞的增殖,当加入50 μmol·L-1银杏酸时,细胞增殖几乎被完全抑制[13]。它还显著降低肺癌细胞系A549和HI299细胞的细胞增殖[14]。在与银杏酸(10 μmol·L-1)共孵育24 h后,口腔鳞状细胞癌细胞系Tca8113和Cal-27的细胞活力分别降低了约41.79%和53.53%[15]。人胃癌细胞系,包括BGC-823、SGC-7901、MGC-803和AGS对银杏酸治疗敏感,其中BGC-823和SGC-7901比其他两个更敏感[16]。在乳腺癌中,Licciardello等[17]发现对于NOTCH1激活的乳腺癌细胞系HCC-38, HCC-1187, HCC-2218和BT-20,银杏酸可显著抑制其增殖; Lorente等[18]通过Ki67的表达评估乳腺癌细胞的增殖时,证实暴露于银杏酸(10 μmol·L-1)会导致增殖降低,并降低与乳腺癌细胞增殖有关的转录因子JUN的水平。这种现象不仅出现在体外作用中,实验表明银杏酸同样抑制乳腺癌异种移植物的生长,在体内发挥作用[18]。这种抑制作用对于正常细胞与癌细胞来说具有差异性。Yao等[12]通过实验证实了银杏酸在原代大鼠肝细胞中的细胞毒性低于HepG2细胞。银杏酸在培养4 d的原代大鼠肝细胞中无明显细胞毒性,而浓度为60 μmol·L-1的银杏酸降低了HepG2细胞90%的细胞活力。Ma等[19]发现当浓度低于100 μmol·L-1时,银杏酸可以抑制癌细胞的生长,而对正常细胞的影响很小。这表明银杏酸对癌细胞有选择性抑制作用。
2.2 银杏酸与肿瘤侵袭及转移肿瘤的细胞转移涉及多个过程,上皮-间质转化增强了肿瘤细胞的运动性和侵袭能力,是肿瘤浸润和转移的先决条件。肿瘤转移是复发的最主要因素,也是患者死亡的主要原因之一。同时抑制肿瘤侵袭及转移也是当前药物开发的重要方向。
近年来,关于银杏酸可抑制肿瘤细胞侵袭及转移能力的研究不断增加。Baek等[14]发现银杏酸可降低肺癌细胞的浸润性,抑制转化生长因子-β(transforming growth factor-β,TGF-β)诱导的A549和HI299细胞的侵袭和迁移。在银杏酸的干预下,HepG2细胞中上皮标志物(E-cadherin和ZO-1)的表达水平升高,间质标志物(波形蛋白和N-cadherin)表达水平降低[20]。相似的,在人胃癌细胞系,银杏酸降低了ROCK1,基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2),MMP-9和α-SMA蛋白的表达水平;显著下调了N-cadherin,Vimentin和Snail蛋白的表达水平;而E-cadherin和ZO-1蛋白表达水平呈剂量依赖性增加[16]。Qiao等[13]的研究表明,银杏酸在转录和转录后水平下调了SW480细胞中侵袭相关分子的表达,包括MMP-2,MMP-9,尿激酶型纤溶酶激活物和CXC趋化因子受体4型。RAC1可驱动细胞迁移和侵袭程序。研究表明,银杏酸抑制小GTPase RAC1的激活,损害乳腺癌细胞的侵袭性[18]。此外, Liu等[15]首次评判了银杏酸对口腔鳞癌细胞的迁移抑制能力,实验表明浓度为5 μmol·L-1和10 μmol·L-1的银杏酸对TGF诱导的Tca8113细胞迁移的抑制作用分别为66.3%和96.1%。目前多项研究已将银杏酸侵袭及迁移抑制潜力作为抗癌新药可开发的方向。
2.3 银杏酸与细胞周期阻滞及细胞凋亡细胞周期是指细胞从一次分裂完成开始到下一次分裂结束的一个完整过程。细胞凋亡是受多种基因精确调控的主动的、程序化的死亡过程[21]。通常,当出现DNA突变后,细胞检查点将发挥作用阻滞细胞周期,修复损伤或启动凋亡。诱导细胞凋亡也是肿瘤药物研究的一个重要方面。
Liu等[22]研究发现,银杏酸可诱导癌细胞G0/G1期阻滞及细胞凋亡从而导致细胞死亡,发挥抗癌作用。另有研究发现银杏酸诱导了MDCK细胞G0/G1和G2/M期的细胞周期停滞,还加速了Tca8113和Cal-27细胞的凋亡[10,15]。同样的,Zhou等[23]的研究表明银杏酸可剂量依赖性将细胞阻滞在G0/G1期,通过降低Bcl-2/Bax比值来诱导细胞凋亡。可见银杏酸对G0/G1期的阻滞作用在多种细胞中得到验证。另外,周大宇[24]的研究表明银杏酸C13:0可通过诱导线粒体凋亡途径,即下调Bcl-2、上调Bax和Cleaved caspase-3蛋白的表达,来抑制三阴性乳腺癌的生长。同样,在对胃癌的研究中,银杏酸显著降低了抗凋亡信号Bcl-2和Bcl-xl,而促凋亡分子Bax和Bad在mRNA和蛋白表达水平显著增加,显示其发挥了诱导细胞凋亡的作用[16],再一次证实了其潜在的抗癌活性。刘俊等[25]通过实验证实,银杏酸C17:1能调控化疗细胞的自噬与凋亡,从而增强顺铂的抗肿瘤活性,产生协同作用,这为化疗辅助药物的机制研究提供了一定理论依据。
3 银杏酸抑制肿瘤发生发展的相关机制
3.1 作为SUMO化抑制剂发挥抗癌作用SUMO化是蛋白质的翻译后修饰之一,负责许多细胞过程的调节,例如DNA复制和修复、转录、信号转导和核转运[26-27]。在SUMO化期间,SUMO蛋白通过酶促级联共价反应连接到靶蛋白中赖氨酸的ε-氨基,该级联需要E1、E2和E3酶的连续作用。研究表明,不仅细胞周期和DNA修复途径相关的许多蛋白质是已知的SUMO化靶标,而且许多人类肿瘤细胞表现出SUMO途径中相关组分的显著上调。因此,SUMOylation可能将在潜在的微环境中显著促进癌细胞的存活和增殖[28]。
银杏酸可以直接与SUMO化过程中的E1酶结合并减少E1-SUMO中间体的形成,并最终抑制蛋白质SUMOylation[29]。利用这一活性,银杏酸在多种癌细胞中发挥抑制作用。在银杏酸抑制SUMO化后,NOTCH1激活的乳腺癌细胞在细胞周期中进行得更慢并最终进入细胞凋亡[17]。Lorente等[18]发现银杏酸降低了RAC1的SUMO化,从而抑制肿瘤细胞的侵袭。在口腔鳞状细胞癌中,银杏酸通过抑制TGF-β1触发的SMAD4的SUMO化,在体内和体外有效抑制了肿瘤的生长和迁移[15]。在血液系统肿瘤方面,Iba等[30]的研究表明,银杏酸通过发挥其SUMOylation抑制剂的作用,降低致白血病融合激酶FIP1L1-PDGFRA的稳定性。它与伊马替尼同用可起到协同作用,是治疗FIP1L1-PDGFRA阳性的慢性嗜酸性粒细胞白血病的潜在靶标[30]。综上,银杏酸可作为SUMO化抑制剂发挥抗癌作用,目前这是它在肿瘤研究中的主要机制。
3.2 其他肿瘤相关信号通路研究银杏酸不仅作为SUMOylation抑制剂发挥作用,也可以影响其他肿瘤相关信号通路。首先,信号转导和转录激活因子3是一种致癌转录因子。银杏酸可抑制信号转导和转录激活因子3/Janus激酶2信号通路的激活,这是通过诱导活性氧的产生来实现的[16]。其次,银杏酸消除了基础PI3K/Akt/mTOR信号传导级联反应,减少了TGF-β诱导的肺癌细胞中PI3K/Akt/mTOR途径的磷酸化[14]。除此之外,银杏酸还可通过下调HGF/c-Met信号、激活腺苷5′-单磷酸激活蛋白激酶、减少与脂肪形成有关的关键酶的表达而达到抗肿瘤的效果[13,19-20]。但是这里面单个研究较多,机制尚未成熟,可参考价值略小。
4 总结与展望
自1997 年银杏酸被单独分析以来,科学家们对它的多种活性进行了研究,可以说是一种生物活性非常广泛的酚酸类小分子化合物。近五年来,银杏酸的抗肿瘤活性是其中的研究热点,在胃癌、胰腺癌、肺癌、结肠癌、口腔鳞状细胞癌以及乳腺癌等领域均有所报道。
从功能上来看,银杏酸主要通过抑制肿瘤生长增殖,抑制肿瘤侵袭及转移,阻滞细胞周期和诱导细胞凋亡等实现抗肿瘤的效果,并在大部分的文章中得到了验证。在机制方面,银杏酸作为SUMO化抑制剂在部分研究中起到关键作用。但是其他的肿瘤相关机制研究就比较分散,多为单篇报道,因此说服力较小。银杏酸本身具有致敏性,这一点在多篇文章中均有阐述,实际上对银杏酸的药用价值研究来说这是一个需要解决的问题。另外,银杏酸具有潜在肝肾毒性,这可能成为阻碍其药物开发利用的关键问题。然而目前关于其代谢及毒理学方面资料不多,还需更加全面深入的研究探讨。虽然有关银杏酸抗肿瘤活性的相关研究近几年才慢慢开始,研究数据还较少。但是,从目前来看,这些研究基本上都有比较深入的探索,比较完整的实验,内容较为丰富,从中我们可以看到银杏酸的抗癌能力,这让它作为一种潜在抗癌药物具有很好的研究价值和研发前景。另外,现如今表观遗传机制在肿瘤生长发展中的研究已经吸引了越来越多的目光,银杏酸作为SUMOylation抑制剂,相信在此领域有价值的科研成果会不断被发现,从而使其作为抗癌新药研发的潜在候选药物受到关注。
