梓醇抑制AGEs刺激肾内皮细胞介导巨噬细胞活化的作用研究
2020-11-18束安梅高雨嫣朱逸晖许惠琴吕高虹卢金福
束安梅,高雨嫣,朱逸晖,王 威,许惠琴,杜 秋,陈 璟,吕高虹,卢金福
(南京中医药大学药学院, 江苏省中药药效与安全性评价重点实验室, 江苏 南京 210023)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病主要的微血管并发症之一,病理表现为肾小球肥大、基底膜增厚、细胞外基质积聚,是终末期肾病的主要致死原因[1]。新近研究显示[2],晚期糖基化终末产物(advanced glycation end products,AGEs)诱导的炎症反应在DN进程中扮演着重要角色。巨噬细胞是调节肾脏炎性反应的关键炎症细胞,其会随着不同微环境极化为M1或M2型,其中M1型巨噬细胞通过分泌大量的炎性因子IL-6、IL-12和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促进炎症反应[3],M2型巨噬细胞分泌IL-10抑制炎症反应和促进组织修复[4]。肾小球内皮细胞作为主要的肾脏固有细胞,不仅是肾损伤的受害者,也是主动参与者[5]。AGEs刺激肾内皮细胞分泌单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)和细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)等[6],激活、促进巨噬细胞向肾脏趋化,加重糖尿病肾脏炎性损伤。
梓醇(catalpol,Cat)是从中药地黄的块根中提取的一种环烯醚萜苷类化合物,具有降血糖、抗炎和抗氧化应激等作用[7]。研究显示[8],Cat能够减少AGEs诱导的单核细胞炎症因子的分泌,抑制核转录因子NF-κB的转位,从而抑制AGEs介导的炎症。Cat可有效降低DN小鼠的血糖、升高血清胰岛素水平,改善肾脏的病理改变,减轻对肾脏固有细胞的损伤[9]。本实验旨在通过建立肾内皮细胞与巨噬细胞共培养模型,观察Cat对AGEs刺激肾内皮细胞介导巨噬细胞活化的抑制作用,为探索糖尿病慢性炎症的防治提供实验依据。
1 材料
1.1 细胞株小鼠肾小球内皮细胞(mouse glomerular endothelial cells,MGECs),购自北京北纳创联生物技术研究院,编号:BNCC340482;小鼠巨噬细胞(RAW264.7),南京中医药大学药理实验室惠赠。
1.2 药物与试剂Cat标准品,成都瑞芬思生物科技有限公司,批号:Z-005-190523;氨基胍(aminoguanidine,Ami),美国Sigma公司,批号:079K1734V;高糖DMEM、Trypsin-EDTA、胎牛血清,美国Gibco公司,批号:AD17497268、42F1190K、25200-056;RIPA细胞裂解液、Triton X-100、DAPI染液,Solarbio公司;MCP-1、M-CSF、TNF-α、IL-12 ELISA试剂盒,上海酶联生物科技有限公司,批号:201906;iNOS、CD206、ICAM-1、Arg-1抗体,Abcam公司;CD16/32抗体,Affinity公司;β-actin抗体,Bioworld公司;FITC-羊抗兔IgG,Boster公司;Anti-rabbit IgG,美国CST公司。
1.3 仪器二氧化碳细胞培养箱,日本SANYO公司;凝胶成像系统,美国GE公司;自动细胞计数仪,美国Countstar公司;垂直凝胶电泳仪,美国BIO-RAD公司;Ti型荧光显微镜,日本Nikon公司;高速冷冻离心机,美国BECKMAN公司;3413、3422、3450 Transwell细胞培养皿,美国Corning公司。
2 方法
2.1 AGEs的制备将牛血清白蛋白(BSA,50 g·L-1)与葡萄糖(0.5 mol·L-1)充分溶解于PBS缓冲液(pH 7.4),37 ℃避光孵育4个月,使其形成AGEs-BSA溶液(即AGEs)。同时在平行条件下配制不含葡萄糖的BSA溶液,即无糖基化的0-BSA作为阴性对照。将孵育好的AGEs装在孔径为分子量1万的透析袋中,置于PBS缓冲液(0.01 mol·L-1)中4 ℃低温透析24 h以除去未反应的葡萄糖,使用0.22 μm微孔滤器过滤以除去溶液中的细菌。BCA蛋白定量法测定AGEs浓度为20.1 g·L-1。
2.2 细胞培养MGECs和RAW264.7用含胎牛血清(体积分数占0.10)及青链霉素混合液(体积分数占0.01)的高糖DMEM置于培养箱(37 ℃、5% CO2)中培养。
2.3 ELISA法检测细胞上清液中MCP-1、M-CSF、IL-12、TNF-α的分泌取对数生长期的MGECs用培养液调整至1×108个·L-1,每孔1 mL种于24孔板,另取RAW264.7调整至2×107个·L-1,每孔0.5 mL种于0.4 μm的Transwell小室内,于培养箱孵育至细胞贴壁融合后,更换不含胎牛血清的高糖DMEM饥饿培养12 h。将细胞分为空白组、模型组、Ami组(终浓度为10.0 μmol·L-1)、Cat组(终浓度为1.0、10.0 μmol·L-1),每组设5个复孔。加入各药物预孵1 h后,用AGEs(终浓度为200 mg·L-1)刺激MGECs,并将Transwell小室移至接种MGECs的24孔板上方共培养48 h。吸取小室中RAW264.7上清液和24孔板内MGECs上清液,用ELISA试剂盒分别检测MCP-1、M-CSF和IL-12、TNF-α水平。
2.4 结晶紫染色法观察巨噬细胞的迁移调整MGECs至2×108个·L-1,每孔2 mL种于6孔板,调整RAW264.7至4×107个·L-1,每孔1 mL种于0.8 μm的Transwell小室内。分组和给药同上述“2.3”项,每组设3个复孔。取出小室并吸除培养液,用棉签轻轻擦去上层小室的RAW264.7,加入多聚甲醛室温固定30 min后用PBS洗3次,滴加结晶紫染色30 min,置于显微镜下观察单位视野下穿透膜的巨噬细胞数量。
2.5 免疫荧光法检测巨噬细胞标记蛋白iNOS和CD206的表达将细胞专用爬片置于Transwell小室中央,MGECs调整至2×108个·L-1,每孔2 mL种于6孔板,RAW264.7调整至4×107个· L-1,每孔0.5 mL种于0.4 μm的Transwell小室爬片。分组和给药同上述“2.3”项,每组设3个复孔。用事先预冷的PBS小心冲洗玻片3次,多聚甲醛室温固定15 min,PBS冲洗玻片3次。用Triton X-100室温通透20 min后,PBS冲洗3次,每次3 min。滴加100 μL山羊血清室温封闭1 h,吸除封闭液,每片滴加100 μL一抗4 ℃过夜。次日每片滴加100 μL荧光二抗,37 ℃避光孵育2 h。PBS冲洗3次,加入DAPI避光染核5 min,PBS清洗4次后,吸去玻片上残余液体,置于荧光显微镜下观察。
2.6 Western blot法检测ICAM-1、iNOS、CD16/32、CD206、Arg-1蛋白表达调整MGECs至2×108个·L-1,每孔2 mL种于6孔板,调整RAW264.7至4×107个·L-1,每孔1 mL种于0.4 μm的Transwell小室内。分组和给药同上述“2.3”项,每组设3个复孔。吸去培养液,用事先预冷的PBS分别将RAW264.7和MGECs吹打混悬,置于EP管中离心后收集细胞,加入RIPA细胞裂解液提取蛋白,用BCA蛋白含量试剂盒测定浓度。蛋白样品按体积加入5×蛋白质上样缓冲液,95 ℃煮5 min后备用。SDS-PAGE凝胶电泳后转移到PVDF膜上,加入BSA(0.5 g·L-1)室温封闭2 h后,加一抗4 ℃孵育过夜。次日用PBST洗膜4次,每次15 min。加二抗室温孵育2 h后,再用PBST洗膜4次,每次15 min,ECL显色。以β-actin作为内参对照,利用ImageJ软件分析各组条带灰度值并进行计算定量。
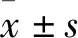
3 结果
3.1 Cat对AGEs刺激肾内皮细胞表达MCP-1、M-CSF、ICAM-1的影响与空白组相比,模型组AGEs明显提高MGECs的MCP-1、M-CSF分泌水平(P<0.01)(Fig 1)和ICAM-1蛋白表达水平(P<0.01)(Fig 2),而Ami(10.0 μmol·L-1)、Cat(1.0、10.0 μmol·L-1)可不同程度抑制其表达(P<0.05,P<0.01),且10.0 μmol·L-1浓度Cat抑制MCP-1、M-CSF分泌和降低ICAM-1蛋白表达的效果相对更好(P<0.01)。
3.2 Cat对AGEs刺激肾内皮细胞介导巨噬细胞分泌IL-12、TNF-ɑ的影响与空白组相比,模型组AGEs明显升高MGECs介导RAW264.7分泌IL-12、TNF-α(P<0.01),而Ami(10.0 μmol·L-1)、Cat(1.0、10.0 μmol·L-1)可不同程度抑制其分泌(P<0.05,P<0.01),见Fig 3。
3.3 Cat对AGEs刺激肾内皮细胞介导巨噬细胞迁移的影响与空白组相比,AGEs刺激肾内皮细胞介导共培养下的巨噬细胞明显向肾内皮细胞迁移(P<0.01),而Ami(10.0 μmol·L-1)、Cat(1.0、10.0 μmol·L-1)可不同程度抑制其迁移(P<0.01),见Fig 4。
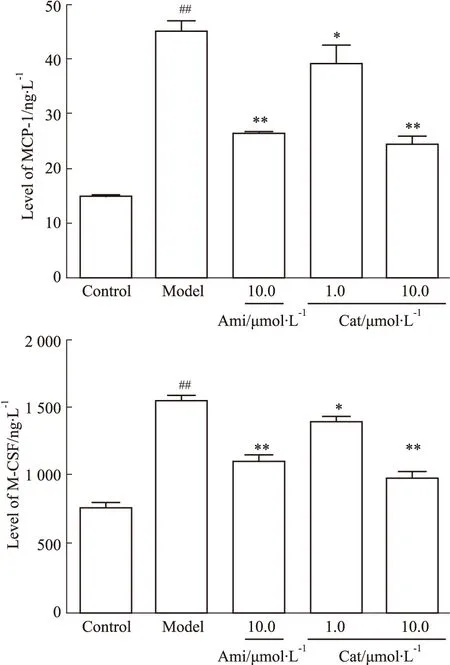
Fig 1 Effect of catalpol on level of MCP-1, M-CSF in MGECs induced by AGEs n=5)##P<0.01 vs Control; *P<0.05, **P<0.01 vs Mode
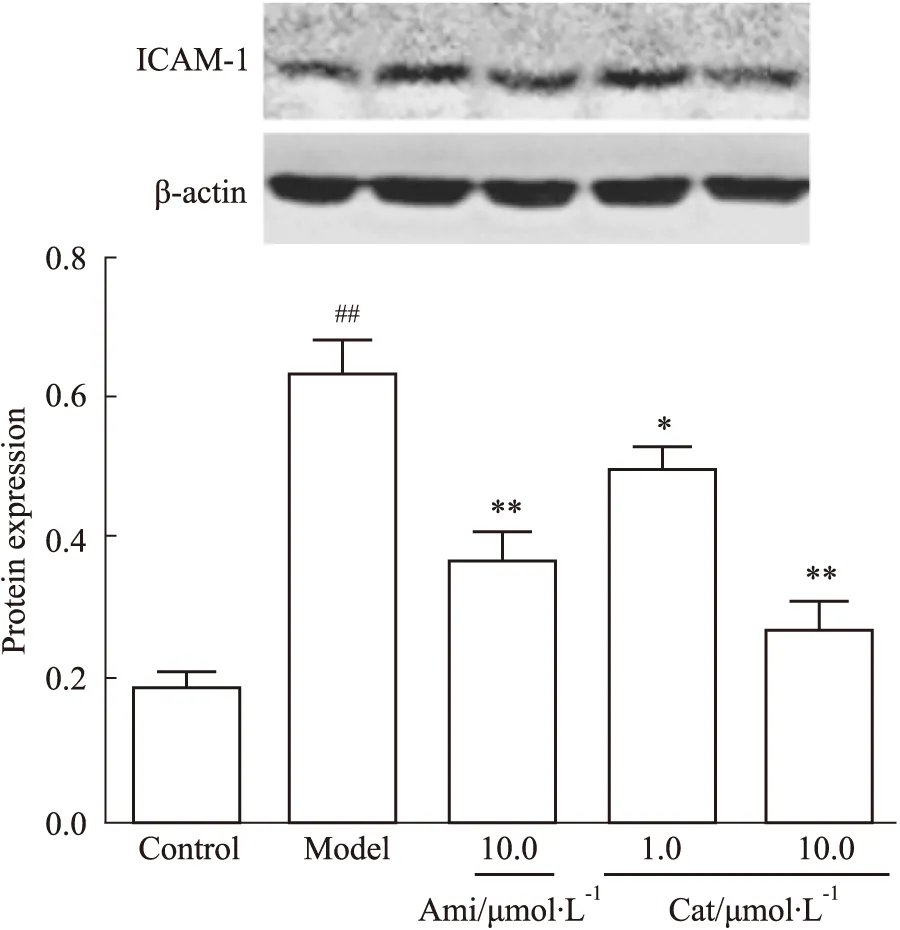
Fig 2 Effect of catalpol on expression of ICAM-1 in MGECs induced by AGEs n=3)##P<0.01 vs Control; *P<0.05, **P<0.01 vs Model
Fig 3 Effect of catalpol on level of IL-12, TNF-α in RAW264.7 mediated by AGEs-stimulated MGECs n=5)##P<0.01 vs Control; *P<0.05, **P<0.01 vs Model
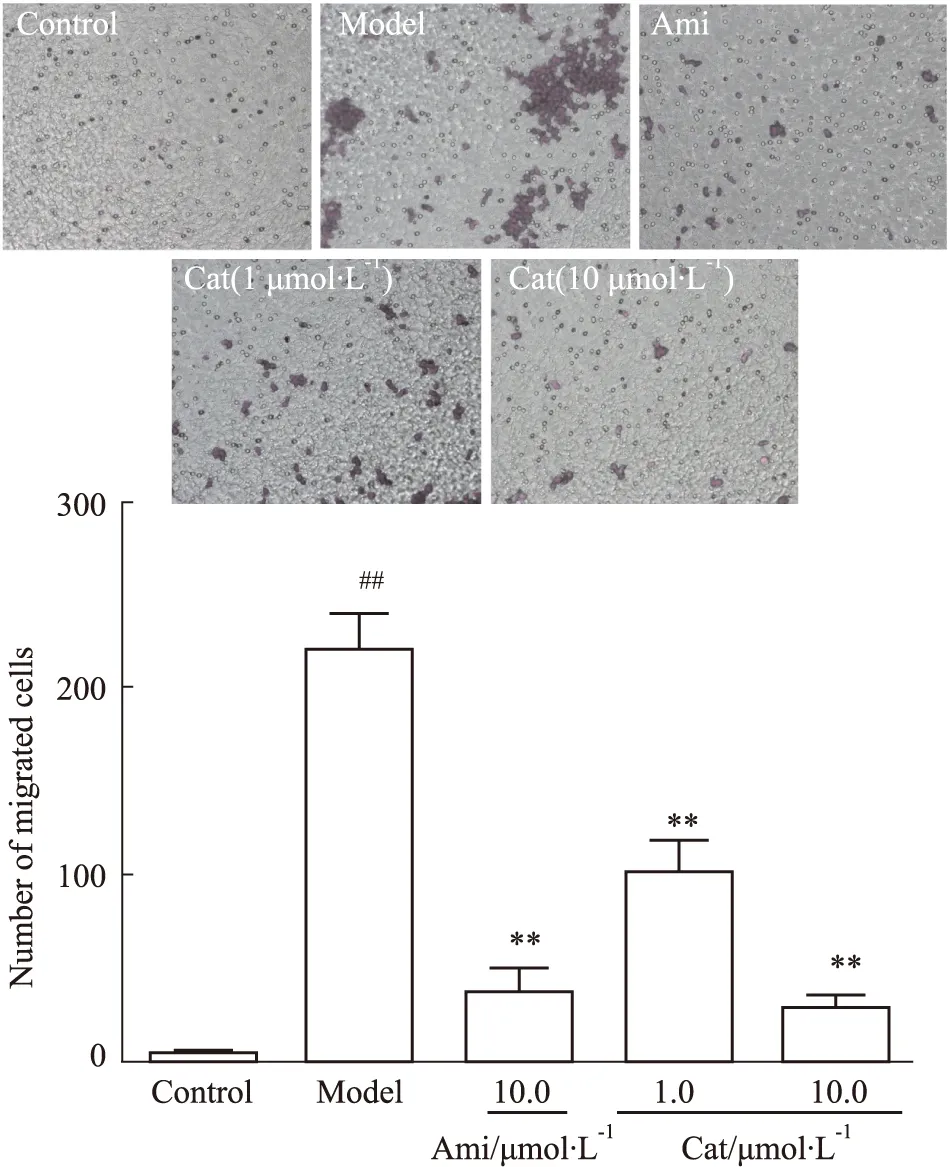
Fig 4 Effect of catalpol on migration in RAW264.7 mediated by AGEs-stimulated MGECs n=3)##P<0.01 vs Control;**P<0.01 vs Model
3.4 Cat对AGEs刺激肾内皮细胞介导巨噬细胞M1型极化标记蛋白iNOS、CD16/32的影响免疫荧光结果显示,与空白组相比,模型组AGEs明显增强MGECs介导RAW264.7 M1型标记蛋白iNOS的荧光强度(P<0.01),加入Ami(10.0 μmol·L-1)、Cat(1.0、10.0 μmol·L-1)干预其荧光强度减弱(P<0.05,P<0.01),且10.0 μmol·L-1浓度Cat减弱iNOS荧光强度相对更好(P<0.01),见Fig 5。
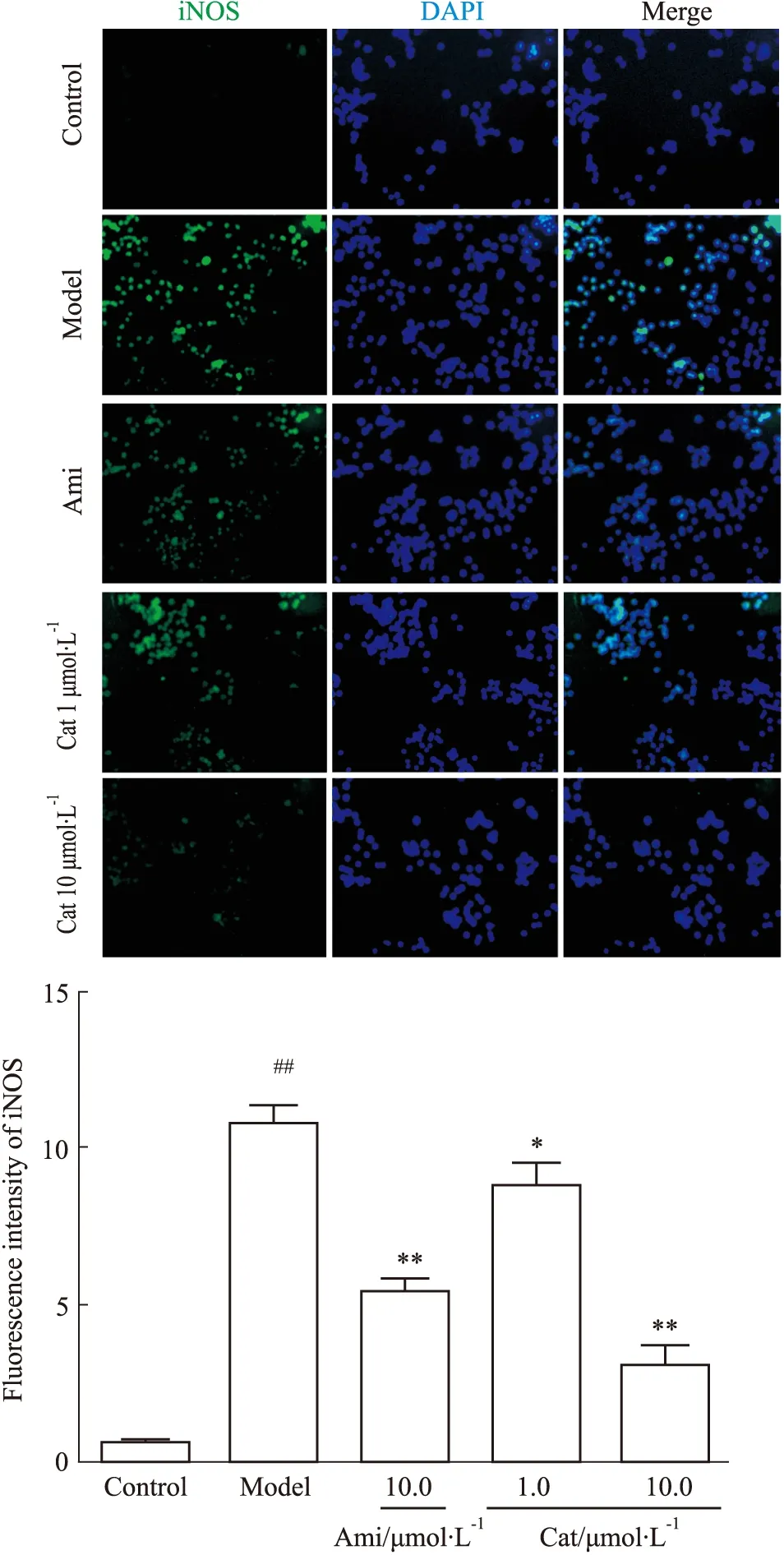
Fig 5 Effect of catalpol on fluorescence expression of iNOS in RAW264.7 mediated by AGEs-stimulated MGECs n=3)##P<0.01 vs Control;*P<0.05,**P<0.01 vs Model
Western blot结果显示,与空白组相比,模型组AGEs明显上调MGECs介导RAW264.7 M1型标记蛋白iNOS、CD16/32的表达(P<0.01),而Ami(10.0 μmol·L-1)、Cat(1.0、10.0 μmol·L-1)可不同程度下调其表达(P<0.05,P<0.01),且10.0 μmol·L-1浓度Cat下调iNOS、CD16/32蛋白表达的作用相对更好(P<0.01),见Fig 6。
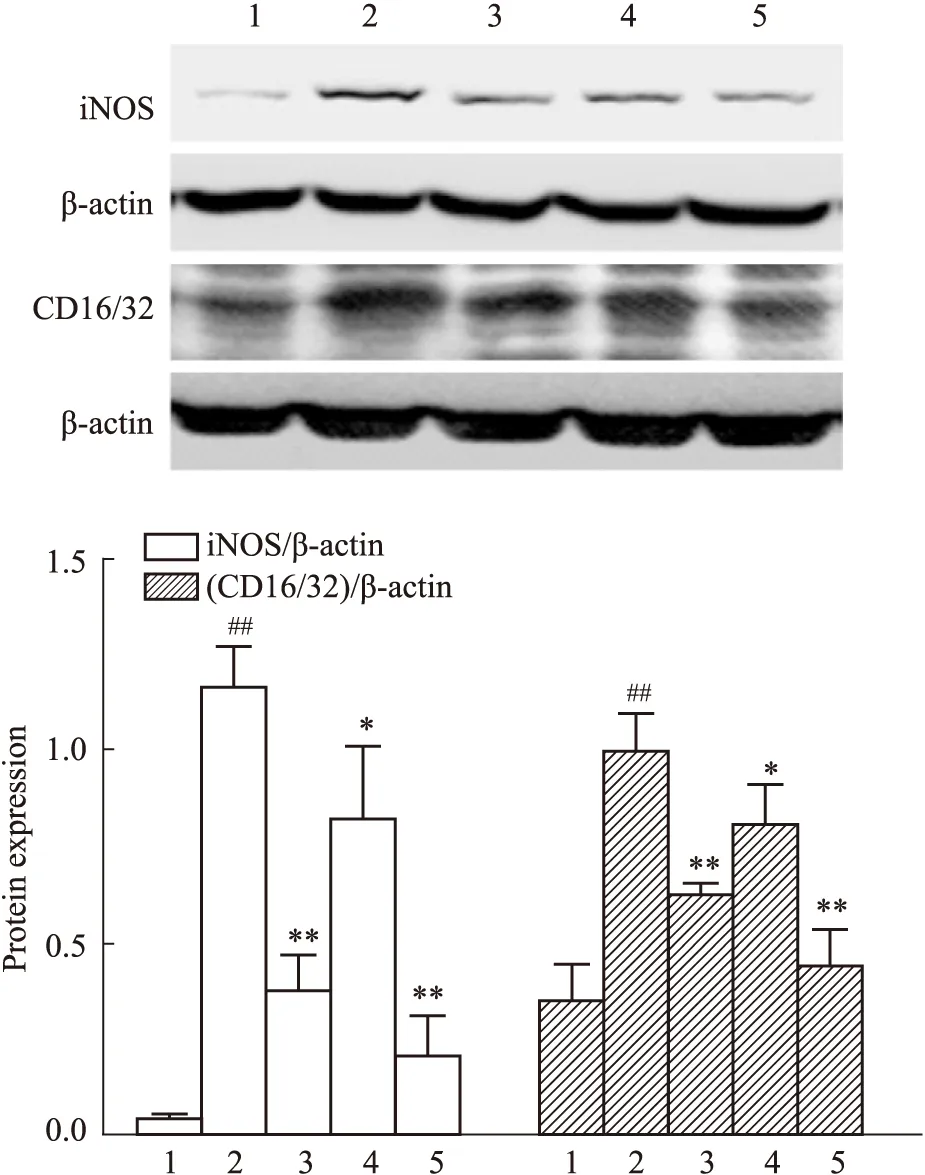
Fig 6 Effect of catalpol on expression of iNOS and CD16/32 in RAW264.7 mediated by AGEs-stimulated MGECs n=3)1:Control; 2:Model; 3:Ami; 4:Catalpol 1.0 μmol·L-1; 5:Catalpol 10.0 μmol·L-1. ##P<0.01 vs Control; *P<0.05, **P<0.01 vs Model
3.5 Cat对AGEs刺激肾内皮细胞介导巨噬细胞M2型极化标记蛋白CD206、Arg-1的影响免疫荧光结果显示,与空白组相比,模型组AGEs减弱MGECs介导RAW264.7 M2型标记蛋白CD206的荧光强度(P<0.05),加入Ami(10.0 μmol·L-1)、Cat(1.0、10.0 μmol·L-1)干预可明显增强其荧光强度(P<0.01),见Fig 7。
Western blot结果显示,与空白组相比,模型组AGEs下调MGECs介导RAW264.7 M2型标记蛋白CD206、Arg-1的表达(P<0.05),而Ami(10.0 μmol·L-1)、Cat(1.0、10.0 μmol·L-1)可明显上调其表达(P<0.01),见Fig 8。

Fig 8 Effect of catalpol on expression of CD206 and Arg-1 in RAW264.7 mediated by AGEs-stimulated MGECs n=3)1:Control; 2:Model; 3:Ami; 4:Catalpol 1.0 μmol·L-1; 5: Catalpol 10.0 μmol·L-1. #P<0.05 vs Control; **P<0.01 vs Model
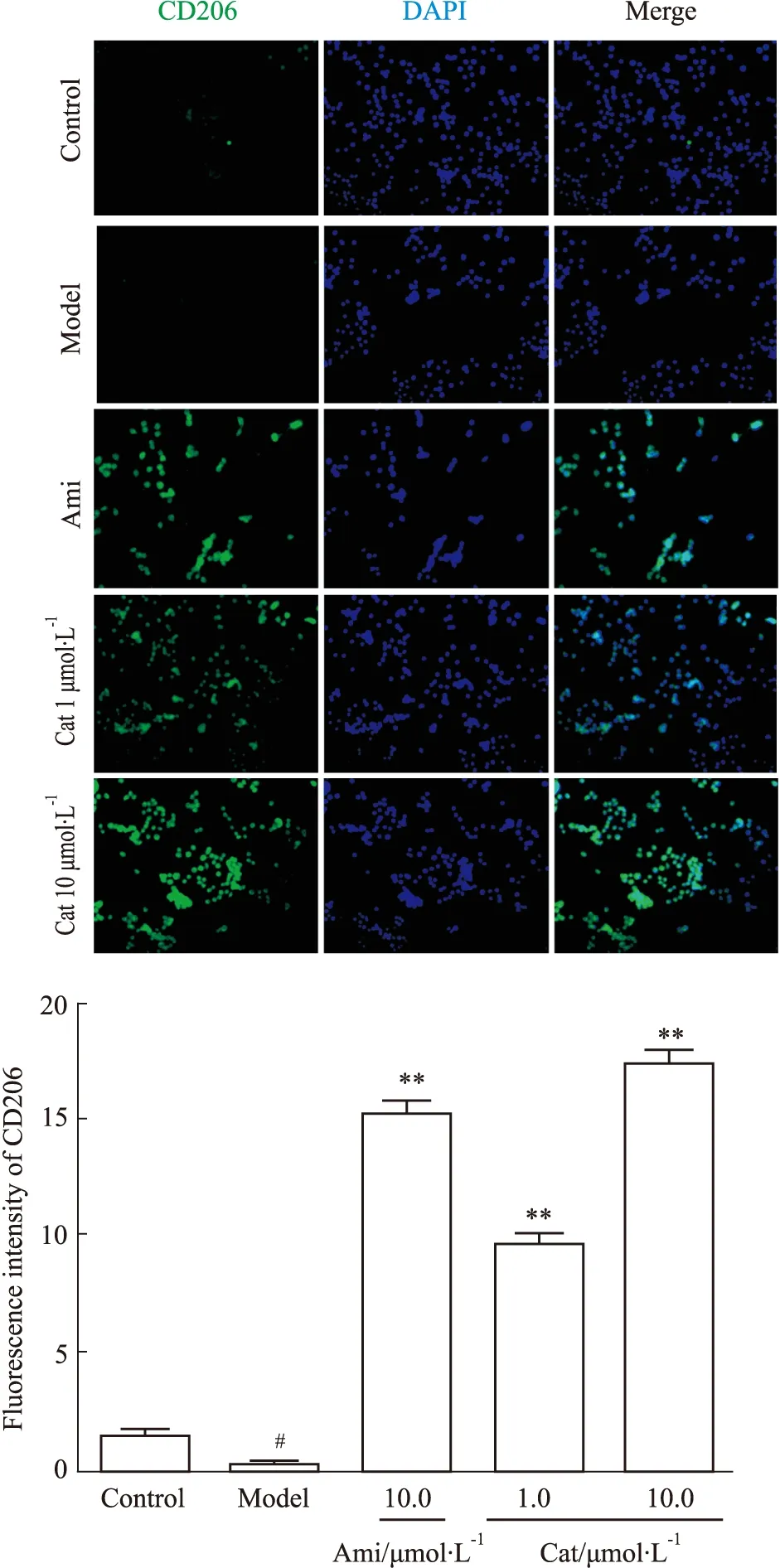
Fig 7 Effect of catalpol on fluorescence expression of CD206 in RAW264.7 mediated by AGEs-stimulated MGECs n=3)#P<0.05 vs Control; **P<0.01 vs Model
4 讨论
随着人民生活水平的提高和饮食习惯的改变,近年来DN发病率迅速增加。在DN进程中,以巨噬细胞炎性浸润为代表的低水平炎症持续存在。对DN患者各时期的肾组织活检发现,在肾小球和肾小管间质均可见巨噬细胞炎性浸润,其浸润数量与肾小球硬化、肾纤维化程度呈正相关[10]。并且,肾组织中浸润的巨噬细胞存在明显的表型比例失衡,促炎的M1型巨噬细胞占大多数,通过改变巨噬细胞M1/M2的比例可明显减轻肾损伤[11]。
在生理状态下,巨噬细胞在器官组织中的数量极少,其迁移和功能调控均有精密机制[12]。但当糖尿病环境中的高糖、多元醇和AGEs等刺激肾脏时,血管内皮细胞受损,血管通透性增加,同时内皮细胞分泌大量的MCP-1、M-CSF和ICAM-1等,进而募集血液中的单核细胞黏附,浸润入肾脏组织活化为巨噬细胞。MCP-1是β趋化因子亚家族成员,可以促进巨噬细胞募集、迁移和极化。研究表明[13],MCP-1的抑制作用与血流动力学无关,主要是通过抑制巨噬细胞的M1型极化和减弱肝素酶对糖原体的降解来降低大鼠蛋白尿。ICAM-1是免疫球蛋白超家族中的一种细胞表面糖蛋白,在DN早期即可检测到肾组织内ICAM-1的高表达,ICAM-1与巨噬细胞表面的配体LFA-1结合后,促进巨噬细胞黏附,介导巨噬细胞的迁移过程。对糖尿病ICAM-1基因敲除的小鼠研究发现,ICAM-1的缺失会使蛋白尿明显降低,伴随着肾脏中巨噬细胞的累积明显减少[14]。M-CSF是巨噬细胞存活、增殖和分化的一个主要调节因子,其调节巨噬细胞释放炎症因子如IL-12、IL-1β、TNF-α等,一方面直接导致肾脏损伤,如血管内皮细胞泡沫化、足细胞足突广泛融合、系膜细胞增生等[15];另一方面,又继续增强巨噬细胞的募集、活化,扩大炎症反应,形成恶性循环。
巨噬细胞向肾组织的迁移、极化,以及炎症因子的释放均会造成肾脏的损伤。因此,阻断巨噬细胞的活化途径,可能是预防和治疗糖尿病肾病的有效策略。本实验建立了肾内皮细胞与巨噬细胞共培养模型,AGEs刺激肾内皮细胞后,趋化因子MCP-1和黏附分子ICAM-1表达增加,从而促进巨噬细胞向肾内皮细胞迁移,且巨噬细胞M1型标记蛋白iNOS、CD16/32表达升高、M2型标记蛋白CD206、Arg-1表达降低;同时肾内皮细胞M-CSF的高表达,使巨噬细胞分泌大量的炎性因子IL-12、TNF-α,而加入Cat预保护后再经AGEs刺激可明显减缓此效应。这表明Cat可通过减少肾内皮细胞分泌趋化因子MCP-1、M-CSF和黏附分子ICAM-1,抑制巨噬细胞迁移和炎性因子分泌,调节巨噬细胞M1/M2极化平衡,从而减轻炎症反应,延缓糖尿病肾病的发生和发展,但其具体作用机制有待进一步深入研究。
