肝胰十二指肠联合移植:正常解剖及术后并发症的影像表现
2020-11-14李畅欧阳龙源黄丽杨广奇孙灿辉
李畅 欧阳龙源 黄丽 杨广奇 孙灿辉
终末期肝病患者常常合并糖尿病,术后应用糖皮质激素或长期应用钙调磷酸酶抑制剂类抗排斥药物会增加患者术后血糖控制的难度,因此对于合并糖尿病的终末期肝病患者,肝脏、胰腺联合移植将比单纯肝移植获得更大收益[1,2]。多种影像学手段,如超声(ultrasound,US),上消化道造影(upper gastrointestinal imaging,UGI)、CT、MRI 等,可以帮助医生及时、准确的判断术后恢复情况,并早期发现术后并发症,从而最大程度的改善预后。
资料与方法
1.一般资料
回顾性分析2010 年3 月~2018 年4 月在中山大学附属第一医院器官移植中心行肝胰十二指肠联合移植的24 例患者的临床和影像资料。男23例,女1 例,年龄39~72 岁,平均(56.5±8.2)岁,原发病为乙型肝炎肝硬化5 例,乙型肝炎肝硬化合并肝细胞癌13 例,肝细胞癌3 例,胆汁性肝硬化1 例,胆管细胞癌1 例,自身免疫性肝炎并肝硬化1 例。所有受者术前均合并有2 型糖尿病。
所有受者均接受来自供者的肝脏、胰腺、十二指肠器官簇,受者的病肝切除而胰腺、十二指肠保留,手术方式示意图见图1。
2.影像检查方法
CT 检查:采用Toshiba Aquillion 64 层螺旋CT扫描,2 例患者仅行平扫检查,其余22 例均行平扫和双期增强扫描。扫描条件为管电压120 kV,管电流200~250 mA,视野512 cm×512 cm,层厚为1 mm,层间距0.8 mm。增强扫描采用高压注射器经肘静脉注射对比剂碘普罗胺(300 mg I/ml),剂量2 ml/kg,注射流率3.5 ml/s,分别于注射后35 s和60 s 行动脉期和静脉期扫描。
MR 检查:采用Siemens Magnetom Trio 3.0 T超导型MR 扫描仪,腹部相控阵线圈,行腹部横轴面膈肌导航T2WI、横轴面三维容积插入式屏气序列(volumetric interpolated breath-hold examination,VIBE)平扫及6 期动态增强扫描、冠状面半傅立叶采集单层激发快速自旋回波(half-fourier acquisition single-shot turbo spin echo,HASTE)序列,扫描参数:T2WI 序列,TR 3470 ms,TE 81 ms,层厚4 mm,层间距1 mm;VIBE 序列,TR 3.41 ms,TE 1.26 ms,层 厚2 mm,FA 13°;HASTE 序 列,TR 881 ms,TE 122 ms,FA 150°。对比剂采用钆喷酸葡胺(gadopentetate dimeglumine,Gd-DTPA)或钆塞酸二钠(gadolinium-ethoxybenzyl-diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)静脉团注,剂量分别为0.1 mmol/kg 或0.025 mmol/kg,注射流率为2 ml/s,注射完毕后用30 ml 生理盐水以2 ml/s 流率冲洗。
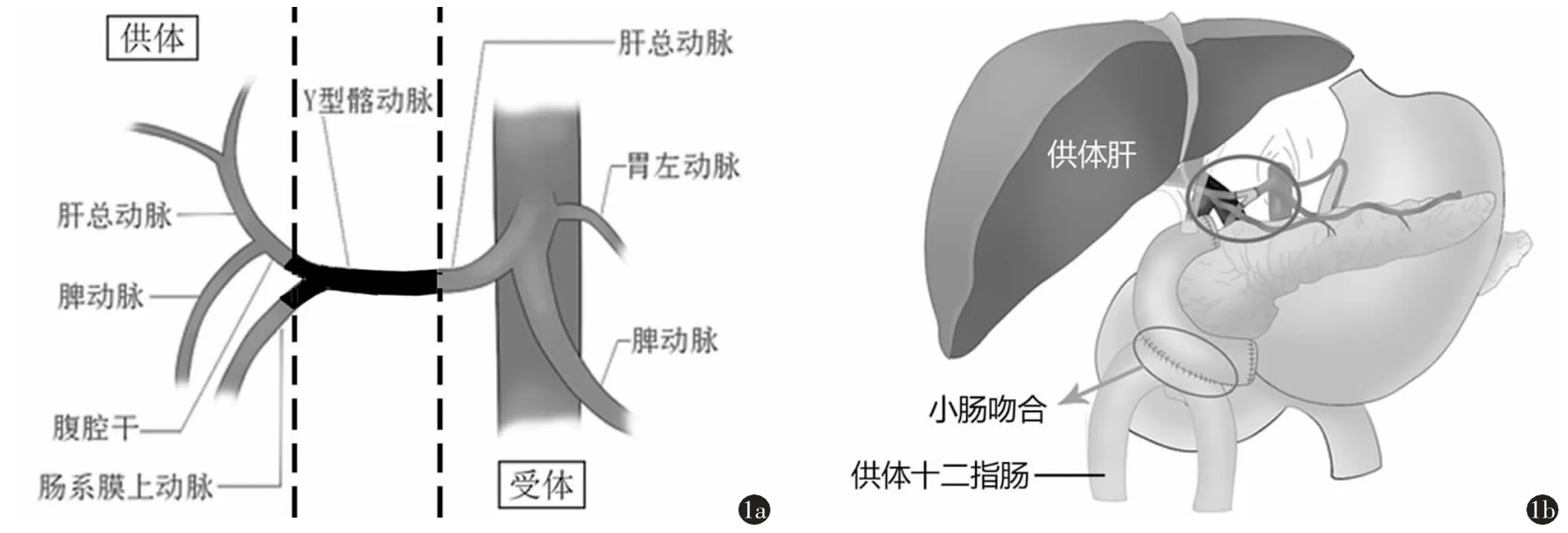
图1 肝胰十二指肠联合移植手术示意图。a)动脉吻合方式示意图;b)供体十二指肠与受体空肠吻合
结 果
1.临床表现
术后对所有受者进行了中位时间38.0 个月[(0.9~121.8)个月]的随访。随访中3 例死亡,均发生于术后3 个月内,1 例死于移植物抗宿主病,2例死于感染性休克。其余21 例患者术后2 周内均停用胰岛素,且随访过程中空腹及餐后血糖维持正常。
2.影像表现
随访中共有22 例受者行超声,24 例行CT,4 例行MR,1 例行UGI 影检查。
正常影像表现:二维和彩色多普勒超声可显示吻合动静脉管腔内血流情况(图2a)和移植物(肝脏、胰腺)情况,正常移植胰腺及肝脏呈均匀低回声(图2b)。CT 平扫及增强图像可以显示供体十二指肠-受体空肠吻合口的位置及周围情况以及移植物的情况(图3a),CTA 图像可显示血管吻合情况(图3b)。MR 图像具有更好的软组织分辨率,可以更好地将移植胰腺和周围肠管区分(图4a),细胞内对比剂(Gd-EOB-DTPA)增强后的肝胆特异性期可反映肝细胞摄取和排泄功能并显示肝内外胆管情况(图4b),磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)可反映胰胆管的情况(图4c)。
术后并发症:所有患者随访中均未出现胆道并发症。共6 例受者出现血管并发症,其中1 例为供体髂总动脉夹层形成(图5a),2 例供体肠系膜上动脉血栓形成(图5b),1 例供体门静脉血栓(图5c),2 例门脉吻合口狭窄(图5d),2 例供体脾静脉血栓;1 例受者出现肠道并发症,经上消化道造影确诊为肠吻合口瘘(图6);4 例受者出现移植物相关并发症,其中1 例移植胰腺急性失功,2 例胰腺炎(图7a),1 例移植肝脏急性排斥反应(图7b);2 例受者出现腹腔感染(图8);另有1 例患者术后出现移植物抗宿主病。
讨 论
肝胰十二指肠联合移植,又称为简化式上腹部多器官移植,目前被认为相较于单纯肝移植或胰腺移植更适合于合并糖尿病的终末期肝病患者。相较于同种异体肝移植或活体肝移植,联合移植由于保留了完整的供者胆道-十二指肠解剖结构,避免了术中对胆道供血动脉的损伤,因此术后胆道并发症发生率明显低于前者[3]。同时由于大部分动脉吻合工作在供体修整时已完成,大大缩短了手术时间和无肝期,减少了术后并发症的发生率。相比于肝移植受者,肝胰十二指肠联合移植受者术后血糖控制明显更佳[4,5]。

图2 正常US 图像。a)彩色多普勒超声图像提示正常“Y 型”供体髂动脉血流情况(*)以及邻近门静脉(箭);b)二维灰阶超声图像提示正常移植胰腺呈均匀稍低回声(*),多普勒超声可见实质内血供正常 图3 正常CT 图像。a)冠状重组门脉期CT 图像示正常移植胰腺(细箭)、供体十二指肠(粗箭)和供体十二指肠-受体空肠吻合口(黑箭);b)CTA 图像示正常动脉吻合(见图示) 图4 正常MR 图像。a)冠状位T2WI 平扫图像示正常移植胰腺形态(*),信号略高于移植肝实质;b)冠状位MR 肝胆特异性期(Gd-EOB-DTPA)图像示对比剂经胆道系统进入供体十二指肠(黑箭);c)最大强度投影(maximum intensity projection,MIP)重组T2WI-MRCP 示正常移植肝内外胆道、移植胰管(细箭)、供体十二指肠(粗箭)及受体空肠(黑箭) 图5 血管并发症。a)轴位动脉期CT 图像示供体髂总动脉(靠近吻合口处)夹层形成(箭头);b)轴位动脉期CT 图示供体肠系膜上动脉管腔内血栓形成(细箭),移植胰腺强化程度减弱(*),周围可见渗出、积液(粗箭);c)冠状重组门脉期CT 图像示门脉主干及左支内充盈缺损(箭),考虑血栓形成;d)彩超示门脉吻合口狭窄(箭),局部血流阻力升高图6 肠道并发症。上消化道造影可见对比剂于肠吻合口附近形成对比剂湖(箭),提示肠瘘

图7 移植物并发症。a)轴位平扫CT 图示移植胰腺肿胀(*),胰周渗出、积液(箭),提示胰腺炎;b)冠状位MR 肝胆特异性期图像可见肝脏形态饱满、肝缘圆钝(箭),肝实质信号弥漫性减低,肝内外胆管未见对比剂排泄,提示肝脏功能减退,穿刺病理提示急性排斥反应图8 腹腔感染。冠状重组门脉期CT 图示移植胰腺左旁腹腔内包裹性积液、积气(箭),边缘强化,局部与胰腺分界不清,考虑腹腔脓肿形成,引流液提示胰瘘
对于受者移植术后随访来说,不同的影像学检查方法具有不同的优势和劣势,应根据具体检查目的选择合适的方法。通常US 作为术后定期随访的首选筛查手段,因其操作方便、快速且无创,可以初步观察移植物及周围结构的形态和回声,并通过彩色多普勒成像协助判断吻合血管血流情况和移植物血供情况,另外US 还可用于引导穿刺。不足的是US 检查较大程度依赖于操作者,且肠道内气体常常干扰胰腺实质的观察[6],因此当怀疑移植胰腺相关并发症(如胰瘘、胰腺炎或排斥反应等)时,往往需要进一步检查。CT 检查对于胰腺炎、腹腔感染及肠道并发症的检出较为敏感,当怀疑肠瘘发生时,可嘱患者口服阳性对比剂后再行平扫,观察有无对比剂漏入腹腔。平扫时移植胰腺与肠管CT 值接近常难以区分,尤其移植十二指肠往往不会充盈,注入对比剂后行增强扫描不仅可以准确观察血管情况,排除血管并发症,同时通过观察移植物的强化程度可协助判断移植物的血供及功能。尽管CT 目前逐渐广泛应用于临床,但其具有电离辐射,且碘对比剂可能造成肾损害,因此对于一些肾功能受损或需要多次复查的患者来说,MRI 作为更安全、灵敏的选项越来越被临床医生和患者接纳。MRI 平扫相对CT 平扫对于移植胰腺的分辨率大大提高,而MRI 动态增强扫描相对于CT 双期增强扫描对于病灶的检出更加灵敏和准确。常规MRCP 和采用EOB 的MRCP 可反映肝内外胆管情况[7,8],前者还同时反映胰管情况。Gd-EOB-DTPA 增强后肝胆特异性期肝实质强化情况及胆道内对比剂排泄情况可反映肝细胞摄取和排泄EOB 的功能,提示移植肝脏的功能[9,10]。
综上所述,影像科医师在评估肝胰十二指肠联合移植术后影像资料时,首先需要了解并掌握手术方式、术后正常影像表现及常见并发症。US、CT 和MR 检查分别有其各自的适应证和优劣势,加深对正常和异常影像表现的认识有助于减少误诊、漏诊。
