模式生物黑腹果蝇在高糖诱导代谢综合征研究中的应用进展
2020-11-13吴棋芳吴明江佟海滨
吴棋芳 何 丹 吴明江 佟海滨
温州大学生命与环境科学学院,浙江温州 325000
代谢综合征(metabolic syndrome,MetS)是指胰岛素抵抗、肥胖、血脂异常、高血压、高尿酸血症等多种代谢危险因素同时发生的综合征;也是一种病理生理状态,包括2型糖尿病(type 2 diabetes,T2D)、非酒精性脂肪肝、痛风、心血管疾病与慢性肾脏疾病等[1-2]。研究表明,随着人们饮食结构的变化,高糖饮食(high sugar diet,HSD)已经成为导致代谢综合征发病率逐年增长的重要危险因素之一[3]。
糖代谢对细胞能量平衡和生物合成至关重要。从食物中摄取的糖类,一部分直接转化为能量供机体使用,其余则以糖原和脂肪形式储存[4]。然而糖摄入过量会破坏体内的代谢稳态,从而引发一系列的代谢性疾病,严重影响人类生命健康。
建立科学、稳定的动物模型有助于深入研究代谢综合征的发病机制并制定科学的干预策略。目前,啮齿类动物是研究代谢综合征应用最广泛的模式生物,常用的造模方法包括饮食诱导、化学物质诱导、外科手术和基因敲除[5]。食物诱导模型可模拟环境因素,成模率较高,但其造模时间长、动物接受度差、个体差异大,导致模型不稳定;化学物质诱导模型是通过给予特定的化学物质,如链脲佐菌素、四氧嘧啶、地塞米松等造模,操作简单、成模率高,但与代谢综合征的病理成因不同,局限性较大;基因敲除建模是借助基因工程技术修饰特定基因以获得代谢紊乱表型,但代谢综合征是环境因素与多基因互作的结果,且技术和成本较高、研制周期长。因此,选择合适的模型对于代谢综合征的研究显得尤为重要。
黑腹果蝇(Drosophila melanogaster)是重要的模式生物,具有生长周期短、操作简便、繁殖力强、基因组与人类同源性高等特点。另外,果蝇的主要代谢途径与哺乳动物具有高度的保守性,这也使其成为研究人类代谢疾病的良好模式生物。因此,本文整理了近年来相关文献报道,对果蝇的糖代谢机制以及高糖诱导代谢综合征的果蝇模型加以综述。
1 果蝇的糖代谢与调控途径
早在20世纪初,有研究将果蝇作为研究对象,创立了基因学说[6]。经过了一个世纪的研究,果蝇已成为生命科学领域中经典的模式生物。研究表明,果蝇与哺乳动物的能量代谢器官在生物进化上高度保守。果蝇存在与人体相似的代谢器官[7],如心脏、脂肪体、血淋巴等,见表1、图1。

表1 果蝇和人的代谢相关器官/组织比较
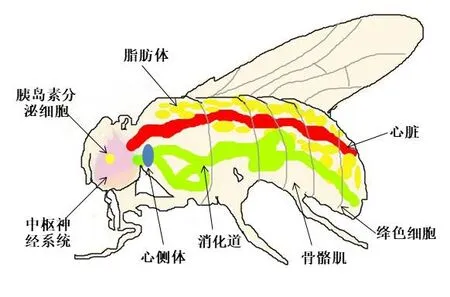
图1 果蝇身体构造图
1.1 糖代谢过程
果蝇与哺乳动物维持能量平衡的调控方式相近[8]。在哺乳动物中,当体内能量充足时,多余的葡萄糖会以糖原的形式储存在骨骼肌和肝脏中;当能量缺乏时,储存的肝糖原就会被动员和释放,同时进行糖异生作用。糖代谢受胰岛素和胰高血糖素的调节,这两种激素相互拮抗,以维持体内葡萄糖稳态。当循环中葡萄糖水平升高时,胰岛β细胞释放胰岛素,刺激细胞对葡萄糖的摄取和储存;相反,当循环中葡萄糖水平降低时,胰岛α细胞释放胰高血糖素,促进糖原分解和糖异生作用,并抑制胰岛素分泌。
在果蝇中,食物中的糖分被肠道内的糖苷酶分解为单糖,单糖经消化道吸收到脂肪体中,并转化为一种非还原性二糖-海藻糖[9]。血淋巴中葡萄糖含量极低,大约是海藻糖含量的百分之一[10],海藻糖是果蝇体内主要的循环糖,可以被储存或释放到血淋巴中。在果蝇体内有类似人体血糖调节功能的激素,分别为胰岛素样肽(drosophilainsulinlike proteins,Dilps)和脂肪运动激素(adipokinetic hormone,AKH)。胰岛素样肽是由大脑中类似胰岛β细胞的胰岛素分泌细胞(insulin-like peptide producing cells,IPCs)分 泌[11-12];脂 肪 运 动 激素是由类似胰岛α细胞的环腺心侧体(corpora cardiaca,CC)分泌[13-14]。两种激素来源不同,相互拮抗,以维持血糖稳态。
1.2 胰岛素样肽
果蝇有8种胰岛素样肽(Dilp1-8)[15]。Dilps在幼虫阶段调节生长发育;在成虫阶段主要维持机体代谢稳态,调节繁殖力和寿命等[16]。与哺乳动物胰岛素功能相似的是Dilp2、Dilp3、Dilp5,其中以Dilp2最为相似[17]。Teleman等[18]发现当果蝇处于饥饿状态时,Dilp2、Dilp3、Dilp5表达水平显著下降,这一现象与哺乳动物胰岛素含量变化趋势一致。Grönke等[19]发现 Dilp2、Dilp3、Dilp5三种突变体果蝇在生长发育方面表现出严重的迟缓。Dilp2、Dilp3、Dilp5三者功能有所不同,Dilp2主要调节体内海藻糖水平[19],Dilp3负责调节肠道干细胞的生长增殖[20],而Dilp5参与调控果蝇生长发育[21]。
1.3 果蝇胰岛素信号通路
胰岛素信号通路在调节代谢方面起着至关重要的作用。在果蝇中,Dilps可以通过与细胞膜上的胰岛素受体(insulin receptor,InR)结合而被激活(图2)。在细胞内,信号被一种叫做 Chico的胰岛素受体底物(insulin receptor substrate,IRS)转导,激活磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K),将 磷 脂 酰肌 醇 3,4- 二 磷 酸 [phosphatidylinositol(3,4)-bisphosphate,PIP2]转化为磷脂酰肌醇(3,4,5)- 三磷 酸 [phosphatidylinositol(3,4,5)-trisphosphate,PIP3]。PIP3刺激丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDK)并激活蛋白激酶B(protein kinase B,AKT/PKB),进 而 磷 酸 化 FOXO(forkhead box protein O)抑制其入核。相反,饥饿条件下,FOXO会去磷酸化并进入细胞核,在细胞核中调节靶基因的表达[22]。从分子和遗传学的角度看,果蝇胰岛素信号通路在结构和功能水平上与人类有着高度的相似性。

图2 果蝇胰岛素信号通路图
2 果蝇代谢综合征模型
2.1 糖脂代谢紊乱模型
糖脂代谢紊乱性疾病已成为全球性的公共卫生问题,其危害在于长期糖、脂代谢水平异常导致全身器官功能衰退[23]。随着人们饮食结构的变化,高糖饮食逐渐成为目前糖脂代谢紊乱性疾病大流行的主要原因之一。
当果蝇摄入富含糖类的食物时,其体内多余的葡萄糖被转化为三酰甘油储存[24]。Buescher等利用雌性果蝇来评价高糖饮食对其糖脂代谢的影响[25],在添加1mol/L蔗糖的培养基中培养雌性果蝇7d,发现高糖组果蝇体重低于对照组,但其海藻糖、糖原及三酰甘油含量显著增加,导致体脂比显著增加。因此,7d的高糖饮食引起雌性果蝇糖脂代谢紊乱。Rovenko等[26]发现在高蔗糖培养基中,果蝇幼虫消耗食物量少于对照组,蛹化速率减慢,蛹的死亡率增加,脂质和糖原水平显著提高。Musselman等[27]发现经高蔗糖培养基喂养后,果蝇脂肪体中脂肪储存增加,脂滴明显增大,同时果蝇体内甘油三酯和游离脂肪酸的水平明显增加。采用高果糖喂养的果蝇幼虫也出现了三酰甘油水平、尿酸水平增加,蛹化速率减慢,蛹的死亡率增加等糖脂代谢紊乱表型[28]。
2.2 胰岛素抵抗和2型糖尿病模型
胰岛素抵抗,会扰乱胰岛素效应组织的代谢平衡。骨骼肌和脂肪组织的胰岛素抵抗会抑制葡萄糖摄取,导致血浆中的葡萄糖滞留;肝脏胰岛素抵抗会导致肝脏葡萄糖过度合成,使血糖水平升高。高糖饮食会导致啮齿类动物出现高血糖和胰岛素抵抗的症状[29]。高糖诱导果蝇胰岛素抵抗的发生机制与哺乳动物相类似。高糖喂养果蝇幼虫会导致Dilp2、Dilp3、Dilp5表达量的增加,同时循环糖水平升高,与哺乳动物胰岛素抵抗的特征相似。另外,高糖饮食喂养的果蝇,给予外源胰岛素刺激后,并未显著增加AKT磷酸化水平,表明长期高糖饮食喂养,会抑制胰岛素信号敏感性[27]。
2型糖尿病(T2D)早期阶段是以胰岛素抵抗为主要病理特征。越来越多的证据表明果蝇非常适合用于胰岛素抵抗和T2D的发生发展机制的研究[27]。有研究已经初步建立了果蝇高糖饮食模型,并用于研究饮食对T2D发生发展的影响[30]。Michael等用高蔗糖培养基喂养野生型果蝇幼虫,其蔗糖含量是正常培养基的7倍。高糖喂养的幼虫血淋巴中循环葡萄糖和海藻糖水平显著升高,幼虫出现发育迟缓、脂肪积累增加等病理表型。当给幼虫注射哺乳动物胰岛素后,仅能部分恢复AKT磷酸化水平,未能完全恢复受损的胰岛素应答,这表明果蝇幼虫出现了胰岛素抵抗症状,同时幼虫体内Dilp2的表达量与海藻糖含量的升高相适应,这种表型类似人类高胰岛素血症[31]。此外,通过RNA-Seq分析发现,模型中FOXO转录因子的靶基因上调,这与在胰岛素抵抗小鼠和T2D患者中所观察到的肝糖异生现象结果一致[31]。Pasco等[32]利用热量为1636千卡/L的高蔗糖培养基喂养果蝇幼虫进行类似研究,也得到了相同的结论。长期高糖饮食会导致幼虫高血糖、生长迟缓、胰岛素样肽分泌增多和脂肪过度积累。同样,高糖饮食的成虫也表现出代谢功能障碍、胰岛素样肽表达量增加和胰岛素信号活性下降等表型,这些表型与人类T2D诊断标准相吻合。高糖饮食诱导的果蝇模型展现出比IPCs移除果蝇更严重的高血糖表型[13,33]。
胰岛素抵抗最终会导致应激JNK(jun-N-terminal kinase)级联的靶基因的诱导[27]。Pasco 和Leopold同样发现高糖饮食引起的果蝇胰岛素抵抗,可以通过抑制脂质运载蛋白Nlaz(Neural Lazarillo)的表达所逆转[32]。Nlaz已被证明是JNK的下游,它是一种与视黄醇结合蛋白4同源的分泌蛋白,视黄醇结合蛋白4参与人类和小鼠T2D的发生发展。Nlaz基因在高糖培养的果蝇幼虫中表达上调[32]。沉默或干扰Nlaz基因表达可以修复高糖诱导果蝇幼虫出现的代谢紊乱。这些从高糖诱导果蝇糖尿病模型中获得的研究证据有助于在哺乳动物中进行机制的验证以及治疗方案的制订。
2.3 高尿酸血症模型
高尿酸血症是一种慢性代谢性疾病,主要是由尿酸的生成增多和排泄途径受阻所导致[34]。近年来,大量研究表明,尿酸的增高不仅仅是痛风发生的主要诱因,而且与其他代谢疾病,如高胰岛素血症、高血压、糖尿病、心血管疾病等有着密切的联系[35-36]。Dam等通过调节体内水的代谢平衡[37],揭示了高糖饮食会造成果蝇出现类似糖尿病表型,并缩短了果蝇寿命。糖是嘌呤降解途径所必需的,尿酸是嘌呤的最终代谢产物,嘌呤代谢紊乱会导致尿酸含量升高,并以肾结石的形式积累。研究人员在高糖饮食的果蝇体内发现肾小管结石,作者通过测定果蝇血淋巴循环尿酸含量,发现高糖饮食导致血淋巴循环尿酸水平升高,并进一步证实了高糖饮食引起嘌呤分解代谢失调是导致尿酸积聚的主要原因。因此,高糖饮食会影响果蝇肾功能和嘌呤代谢,利用这一模型有助于探究高糖饮食与慢性肾脏疾病之间的联系。
2.4 心脏病模型
果蝇是唯一一种心脏跳动的无脊椎动物模式生物,可用于研究心脏功能[38-39]。研究发现了果蝇心脏与脊椎动物了共有基因为MEF2(myocyte enhancer factor 2)、TGF-β(transforming growth factor-β)[40]。此外,尽管果蝇管状心脏和开放的循环系统较为简单,但它们几乎与脊椎动物的心脏有着相同的生理机能。研究表明,与人类心律失常相关的HERG通道突变也会影响果蝇的心率和节律[41]。Na等结合饮食、遗传学和生理学技术手段建立了一个成年果蝇高糖饮食诱导的心脏病模型,发现高糖饮食会造成果蝇心脏功能恶化并伴随纤维化,如胶原堆积、脂肪堆积和胰岛素信号传导缺陷[42]。Birse等[43]发现高热量饮食会增加果蝇体内三酰甘油水平并改变心脏收缩模式,导致严重的心脏功能障碍。由此可见,果蝇在研究心脏疾病方面发挥了重要作用,为探讨心脏功能提供了良好的模型平台。
3 总结与展望
尽管脊椎动物(主要是啮齿类动物)代谢综合征模型具有普遍性和实用性,但其存在造模时间长、技术和成本高等缺点。与之相比,果蝇具有更为明显的优势。该模式生物具有与哺乳动物相似的胰岛素信号通路和代谢相关基因,易于操作和使用、低成本、高繁殖力、进化高度保守和同源基因背景,并且随着分析技术的日益进步弥补了果蝇作为小型模式生物的缺点,如全果蝇实时质谱分析[44],组织和血淋巴特异性质谱分析[45],基质辅助激光解吸/电离质谱成像对果蝇各器官进行综合脂质成份分析[46]等,从而使果蝇系统被广泛用于研究人类疾病。
目前,果蝇已被用于多种人类疾病的建模,这些模型揭示了果蝇和人类在代谢调控机制的诸多方面是相近的。果蝇具有保守的胰岛素信号通路和激素调节途径,可以通过高热量饮食暴露使果蝇机体产生肥胖、胰岛素抵抗、心脏相关疾病等,极大地促进人类对代谢疾病发病机制的研究。同时,果蝇强大的遗传优势和基因编辑技术(USA-GAL4二元表达系统)的运用,使分子机制研究成为可能。建立以果蝇为模式生物的代谢综合征研究体系,极大提高了药物筛选效率,并使得高效开展药物作用机制研究成为可能。
