慢病毒介导的Jagged1 RNA干扰通过抑制肥大细胞的迁移、浸润和脱颗粒减轻变应性鼻炎小鼠的炎症
2020-11-11郑国玺高天喜
夏 翠 祝 康 郑国玺 孙 斌 高天喜 赵 健
变应性鼻炎(allergic rhinitis,AR)是一种常见的异质性慢性上呼吸道疾病,是一种IgE介导的炎症[1]。在AR过敏反应中,当变应原与IgE相互作用时,肥大细胞会激活[2]。抗原-IgE刺激后,肥大细胞释放细胞因子介导急性和慢性炎症[3]。Jagged1是Notch信号中Notch配体之一,AR发病过程中Jagged1的表达明显增加,Notch1-Jagged1可能通过上调IL-6和IL-10的表达促进AR的发生和发展[4]。据报道,敲低Jagged1可抑制肥大细胞产生促炎性细胞因子[5]。在过敏性疾病中,呼吸道黏膜肥大细胞数量显著增加,上皮细胞表达的Notch配体可通过增加该细胞产生促炎性细胞因子,促进炎症的进展[6,7]。因此,在炎性组织中阻断Jagged1可能是治疗过敏性疾病的一种新策略。综上所述,本研究旨在探究Jagged1通过调控肥大细胞迁移、浸润和脱颗粒对变应性鼻炎小鼠的影响,以期为变应性鼻炎发病机制的探究及开发新的治疗策略提供新的科学资料。
材料与方法
1.材料:卵清蛋白和氢氧化铝购自美国Sigma Chemical公司;Trizol reagent、PrimeScriptTMRT reagen Kit with gDNA Eraser和SYBR®Premix Ex TaqTM Ⅱ试剂盒购自日本TaKaRa公司;Jagged1和GAPDH抗体购自武汉三鹰生物技术有限公司;shRNA阴性对照慢病毒液(sh-NC)和Jagged1 shRNA慢病毒(sh-Jagged1)购自上海吉玛制药技术有限公司;组胺(HIS)、类胰蛋白酶(TPS)、前列腺素D2(PGD2)和小鼠卵清蛋白特异性IgE抗体(OVA-sIgE)ELISA试剂盒购自上海酶联生物科技有限公司。
2.动物饲养:32只6~8周龄SPF级BALB/c小鼠购自湖南SJA实验动物有限公司。所有动物饲养于鼠房,保持室内通风,确保充足饮水及饲料。
3.变应性鼻炎小鼠模型的建立:32只小鼠随机分为4组:对照组、AR组、sh-NC组和sh-Jagged1组,每组各8只。AR组、sh-NC组和sh-Jagged1组小鼠在建模第1、8和15天腹腔注射100μg OVA,在第21~27天,每天用20μl OVA溶液鼻腔给药进行两次局部激发。对照组给予小鼠等量0.9%NaCl浓度。
4.Jagged1慢病毒干扰:在建模第1、7、14天和第21~27天每次激发前3h,AR组、sh-NC组和sh-Jagged1组小鼠分别经鼻给予20μl PBS、sh-NC慢病毒液和sh-Jagged1慢病毒液,对照组给予小鼠等量0.9%NaCl浓度。
5.鼻部症状评价及取样:在最后一次使用OVA进行局部激发后,对各组小鼠进行鼻部症状评分[8]。当症状评分>5时,AR小鼠模型被认为造模成功。症状评分结束后,处死各组小鼠,收集骨髓,外周血和鼻黏膜并保存在-80℃保存备用。
6.RT-PCR法:取各组小鼠骨髓,外周血和鼻黏膜,Trizol法提取各样品总RNA,并反转录成cDNA。按照SYBR®Premix Ex TaqTMⅡ试剂盒说明书配制反应体系,每组设置3个重复。Jagged1上游引物:5′-CTTCAATCTCAAGGCCAGCC-3′,下游引物:5′-CAGGCGAAACTGAAAGGCAG-3′;GAPDH上游引物:5′-CCTCGTCCCGTAGACAAAATG-3′,下游引物:5′-TGAGGTCAATGAAGGGGTCGT-3′。反应条件为95℃ 30s,95℃ 5s,60℃ 30s,40个循环。以GAPDH为内参,2-ΔΔCt法计算Jagged1 mRNA表达。
7.Western blot法:收集各组小鼠骨髓,外周血细胞和鼻黏膜,RIPA裂解液裂解各样品,BCA法测定上清液蛋白浓度。10%SDS-PAGE分离蛋白质,并转至PVDF膜上。5%脱脂牛奶封闭2h。一抗Jagged1 抗体(1∶5000)和GAPDH抗体(1∶10000)于4℃条件下孵育过夜,二抗室温下孵育1h。ECL化学发光反应试剂盒和化学发光成像仪检测蛋白条带。
8.HE染色和甲苯胺蓝染色:用0.9%NaCl溶液冲洗小鼠鼻黏膜组织,10%多聚甲醛固定。常规石蜡包埋、切片,常规脱蜡至水,苏木精、伊红染色或0.1%甲苯胺蓝液染色,光镜下观察其组织学变化。
9.电子显微镜分析:将小鼠鼻黏膜组织切成约1mm×1mm×1mm大小。4℃的2.5%戊二醛处理4h,1%四氯化铯中固定2h。常规脱水、组织包埋、超薄切片,2%醋酸铀染色,柠檬酸铅染色,透射电镜观察。
10.ELISA实验:各组小鼠外周血,1000×g离心10min收集血清。按ELISA试剂盒说明书,测定黏膜,骨髓和血清中组胺、类胰蛋白酶、PGD2和血清中OVA特异性免疫球蛋白E(IgE)含量。

结 果
1.Jagged1 shRNA慢病毒对AR小鼠Jagged1 mRNA水平的影响:RT-PCR结果显示,与对照组比较,AR组和sh-NC组小鼠骨髓、外周血和鼻黏膜中Jagged1 mRNA水平均升高(P<0.01,图1);与sh-NC组比较,sh-Jagged1组小鼠骨髓,外周血和鼻黏膜中Jagged1 mRNA水平均降低(P<0.01,图1)。
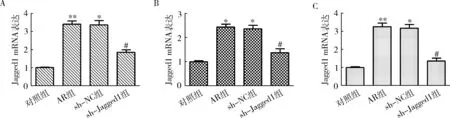
图1 Jagged1 shRNA慢病毒对AR小鼠Jagged1 mRNA水平的影响A.各组小鼠骨髓中Jagged1 mRNA水平;B.各组小鼠外周血中Jagged1 mRNA水平;C.各组小鼠鼻黏膜中Jagged1 mRNA水平;与对照组比较,*P<0.01,**P=0.000;与sh-NC组比较,#P<0.01
2.Jagged1 shRNA慢病毒对AR小鼠Jagged1蛋白水平的影响:Western blot法结果显示,与对照组比较,AR组和sh-NC组小鼠骨髓、外周血和鼻黏膜中Jagged1 蛋白水平均升高(P=0.000,图2);与sh-NC组比较,sh-Jagged1组小鼠骨髓,外周血和鼻黏膜中Jagged1蛋白水平均降低(P<0.01,图2)。
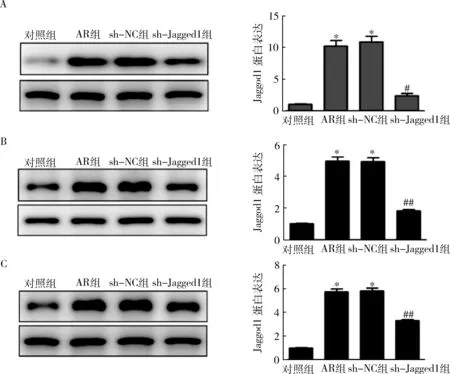
图2 Jagged1 shRNA慢病毒对AR小鼠Jagged1蛋白水平的影响A.各组小鼠骨髓中Jagged1蛋白水平;B.各组小鼠外周血中Jagged1蛋白水平;C.各组小鼠鼻黏膜中Jagged1 蛋白水平;与对照组比较,*P=0.000;与sh-NC组比较,#P<0.01,##P=0.000
3.Jagged1 shRNA慢病毒对AR小鼠模型鼻症状和OVA特异性IgE的影响:各组小鼠鼻部症状评分和ELISA结果显示,与对照组比较,AR组和sh-NC组小鼠症状评分升高(P<0.01,图3A),且均>5,表明AR小鼠造模成功,OVA特异性IgE表达升高(P<0.01,图3B);与sh-NC组比较,sh-Jagged1组小鼠症状评分和OVA特异性IgE表达降低(P<0.01,图3)。

图3 Jagged1 shRNA慢病毒对AR小鼠模型鼻症状和OVA特异性IgE的影响A.各组小鼠鼻部症状评分;B.各组小鼠OVA特异性IgE的表达;与对照组比较,*P<0.01,**P=0.000;与sh-NC组比较,#P<0.01
4.Jagged1 shRNA慢病毒对小鼠鼻黏膜组织病理学变化的影响:HE染色结果显示,与对照组比较,AR组和sh-NC组小鼠的鼻中隔黏膜基膜破碎,黏膜下血管出现明显扩张、充血现象,出现明显的炎性细胞浸润(P<0.01)。与sh-NC组比较,sh-Jagged1组小鼠的鼻中隔黏膜基膜损伤减轻,鼻黏膜水肿和黏膜下血管扩张得到改善,炎性细胞浸润明显减少(P<0.05,图4)。

图4 HE染色检测Jagged1 shRNA慢病毒对小鼠鼻黏膜组织病理学变化的影响(×400)A.对照组;B.AR组;C.sh-NC组;D.sh-Jagged1组。与对照组比较,*P<0.01;与sh-NC组比较,#P<0.05

图5 Jagged1 shRNA慢病毒对小鼠鼻黏膜纤毛结构的影响(×12000)A.对照组;B.AR组;C.sh-NC组;D.sh-Jagged1组
5.Jagged1 shRNA慢病毒对小鼠鼻黏膜纤毛结构的影响:电子显微镜观察各组小鼠鼻黏膜的纤毛结构,结果如图5所示,在对照组中可以观察到大量排列整齐、厚度均匀的纤毛,AR组和sh-NC组小鼠鼻黏膜上皮表面分泌物增多,纤毛大面积减少、排列紊乱;与sh-NC组比较,sh-Jagged1组小鼠鼻黏膜纤毛排列整齐、均匀,分泌物减少。
6.Jagged1 shRNA慢病毒对小鼠鼻黏膜肥大细胞浸润的影响:甲苯胺蓝染色结果显示,与对照组比较,AR组和sh-NC组小鼠的鼻黏膜组织中肥大细胞的数量明显升高(P<0.01);与sh-NC组比较,sh-Jagged1组小鼠的鼻黏膜组织中肥大细胞的数量明显降低(P<0.05,图6)。
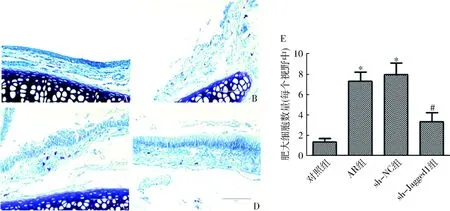
图6 甲苯胺蓝染色检测Jagged1 shRNA慢病毒对小鼠鼻黏膜肥大细胞浸润的影响(×400)A.对照组;B.AR组;C.sh-NC组;D.sh-Jangged1组。与对照组比较,*P<0.01;与sh-NC组比较,#P<0.05
7.Jagged1 shRNA慢病毒对小鼠肥大细胞脱颗粒的影响:ELISA检测结果显示,与对照组比较,AR组和sh-NC组小鼠骨髓、外周血和鼻黏膜中组胺、类胰蛋白酶和PGD2水平明显升高(P<0.01,图7);与sh-NC组比较,sh-Jagged1组小鼠骨髓、外周血和鼻黏膜中组胺、类胰蛋白酶和PGD2水平明显降低(P<0.01,图7)。

图7 Jagged1 shRNA慢病毒对小鼠肥大细胞脱颗粒的影响A.各组小鼠组胺水平;B.各组小鼠类胰蛋白酶水平;C.各组小鼠PGD2水平。与对照组比较,*P<0.01,**P=0.000;与sh-NC组比较,#P<0.01,##P=0.000
讨 论
变应性鼻炎严重干扰患者的日常生活[8]。目前,口服抗组胺药被认为是治疗AR的主要疗法。然而,可用的抗组胺药,可能会导致一系列不良反应。而鼻内皮质类固醇、白三烯受体拮抗剂和过敏原免疫疗法成本高昂,也存在一些不良反应[9]。因此,探明AR的发病机制,寻找更为有效的治疗靶点极其重要。
Jagged1是Notch配体之一,据相关报道,AR患者的Notch1和Jagged1的表达明显升高[10]。这与AR进展和变应原IgE水平呈正相关。与AR组比较,抑制Notch表达,可降低AR患者的过敏症状、IgE水平及Notch1、Jagged1的表达。Notch信号可促进AR的发生、发展[11]。橘皮素通过抑制其表达减轻变应性鼻炎症状,降低血清OVA诱导IgE的产生[12]。本研究结果显示,Jagged1 RNA干扰可改善AR小鼠症状、鼻黏膜病理学变化和鼻纤毛结构损伤,抑制IgE的产生。该研究结果与之前的研究结果一致。
相关实验证明,在过敏性鼻炎反应早期,组胺能削弱上皮细胞的屏障功能,增强致病作用[13]。芍药苷通过抑制组胺释放而在活化的肥大细胞中发挥抗过敏作用[14]。前列腺素如PGD2也可导致血管扩张引起鼻水肿,增加血管通透性[15]。此外,已有证据显示,在食物过敏小鼠模型中,敲低Jagged1可抑制食物抗原诱导的肠道肥大细胞增生,从而减轻过敏反应[16]。本研究结果显示,慢病毒介导的Jagged1 shRNA可降低变应性鼻炎小鼠鼻黏膜中肥大细胞数量,抑制组胺、类胰蛋白酶和PGD2的释放,以上结果表明,敲低Jagged1可抑制变应性小鼠肥大细胞迁移、浸润和脱颗粒。
综上所述,本研究结果表明,慢病毒介导的Jagged1 RNA干扰可能通过抑制肥大细胞迁移、浸润和脱颗粒减轻变应性鼻炎小鼠的炎症。该结果为治疗变应性鼻炎提供了新的可能靶点,为开发新疗法提供了新的科学依据。
