瘦素通过JAK/STAT途径对IL-1β诱导的软骨细胞增殖和炎性反应的影响
2020-11-11李晓淼王伟力
李 浩 李晓淼 沈 奕 王伟力
骨关节炎(osteoarthritis, OA)是一种常见的慢性关节炎[1]。其临床病理特征包括关节软骨进行性丧失,完整性破坏,关节摩擦增加等[2]。目前OA的发病机制尚不清楚,且无法确定治疗方法[3]。白介素-1β(IL-1β)是OA发病机制的关键促炎细胞因子,可诱导各种分解代谢因子的表达,如诱导刺激软骨细胞,使IL-6、IL-8和TNF-α表达升高,使炎性反应加重[4,5]。目前 IL-1β 作为体外研究中 OA 的诱导剂已被广泛地使用[6]。
瘦素(Leptin)调节骨生长的作用最早于ob/ob小鼠生长发育过程中发现[7]。除作用于下丘脑等中枢神经系统外,瘦素还可通过外周方式作用于骨组织。瘦素受体在骨组织的表达水平及部位可直接反映其功能[8]。通过Janus激酶(Janus kinase, JAK)转录子的单转导体和活化体(signal transducer and activator of transcription, STAT)转导途径影响肿瘤的生长和转移[9]。因此,笔者试图研究瘦素是否通过JAK/STAT途经对软骨细胞增殖、凋亡和炎性反应有作用并探讨其作用机制,为临床治疗OA提供新的理论依据。
材料与方法
1.材料:SD大鼠(上海交通大学医学院动物实验中心);IL-1β、瘦素(美国Sigma公司);DMEM/F12培养基、胎牛血清(美国Gibco公司);甲苯胺蓝染色试剂盒(上海如吉生物科技发展有限公司);CCK-8试剂盒、RIPA裂解液、BCA试剂盒和Ⅱ型胶原抗体(美国Abcam公司);IL-6、IL-8、TNF-α试剂盒(北京索莱宝生物科技有限公司);p-JAK抗体、JAK抗体、p-STAT3抗体、STAT3抗体和二抗(美国Cell Signaling Technology公司)。
2.大鼠关节软骨细胞的分离与培养:大鼠经乙醚麻醉后,用75%乙醇浸泡。置超净工作台分离出膝关节软骨并切成薄片(1mm×1mm×1mm),PBS冲洗3次。0.25%胰蛋白酶消化软骨薄片30min,收集细胞悬液于离心管中,1000r/min离心5min,弃上清。将细胞在含5%胎牛血清的0.1% Ⅱ胶原酶37℃消化6h,1000r/min离心5min,弃上清。细胞用含10%胎牛血清的DMEM/F12培养基重悬,并按5×104个/毫升接种于培养瓶中,置37℃、5%CO2的培养箱,2天更换一次培养基。按1∶3的比例传代,第3代软骨细胞可用于后续的实验研究。
3.甲苯胺蓝染色和Ⅱ型胶原免疫细胞染色对软骨细胞的鉴定:甲苯胺蓝染色:原代软骨细胞接种到放有无菌且无划痕玻片的6孔板(2×105个/毫升)中,培养48h后,将玻片夹出,用PBS漂洗2次。将细胞用甲醛固定2h后,用70%乙醇固定20min。1%甲苯胺蓝染色30min。梯度乙醇脱水,中性树胶封片,记录染色结果并在光学显微镜下分析。Ⅱ型胶原表达:原代软骨细胞接种、培养、漂洗方法同上。细胞用10%多聚甲醛固定40min并用0.1%TritonX-100渗透后,用3%H2O2处理10min,5%封闭缓冲液室温封闭30min。一抗(1∶200)4℃孵育过夜,PBS洗涤3次。二抗(1∶100)室温孵育30 min。待DAB显色,苏木精复染。脱水,封片后记录染色结果并在光学显微镜下分析。
4.CCK-8检测瘦素毒性和筛选最佳瘦素作用浓度:(1)瘦素毒性检测:软骨细胞以3×103个细胞接种到96孔板中,每孔100μl。细胞分为0ng/ml瘦素组[瘦素(0)组]、5ng/ml瘦素组[瘦素(5)组]、10ng/ml瘦素组[瘦素(10)组]、20ng/ml瘦素组[瘦素(20)组]、40ng/ml瘦素组[瘦素(40)组]和80ng/ml瘦素组[瘦素(80)组],每组3个复孔。置37℃、5%CO2条件下孵育24h。将10μl CCK-8试剂加入每孔。2h后使用酶标仪在450nm处测量每孔细胞的吸光度(A),计算细胞活力。(2)瘦素浓度筛选:软骨细胞以3×103个细胞接种到96孔板中,每孔100μl。细胞分为对照组(不做任何处理)、IL-1β组(10ng/ml)、IL-1β+瘦素处理组(瘦素质量浓度为5、10、20、40和80ng/ml),每组3个复孔。用药组相应剂量的瘦素预处理1h,加入IL-1β,置37℃、5%CO2条件下孵育24h。将10μl CCK-8试剂加入每孔。2h后使用酶标仪在450nm处测量吸光度(A),计算细胞活力。
5.集落形成实验检测软骨细胞的增殖能力:软骨细胞按1×105个/孔接种在6孔板中,按材料与方法中关于大鼠关节软骨细胞的分离与培养方法进行处理,并置于37℃、5%CO2的培养箱中孵育。实验结束后收集各组细胞并接种到60mm的培养皿中。3天更换1次培养基。14天后,用0.5%结晶紫染色,并计数含有≥50个细胞的集落,并进行拍照。
6.ELISA检测软骨细胞上清液中IL-6、IL-8和TNF-α的含量:实验结束后收集各组细胞上清液,按ELISA试剂盒说明书进行操作,450nm测定各孔的吸光度(A),根据A值所绘制的标准曲线查出上清液中IL-6、IL-8和TNF-α的表达水平。
7.Western blot法检测JAK/STAT信号通路相关蛋白的表达:实验结束后,弃去细胞上清液,PBS冲洗2次。加入1ml制备好的RIPA裂解液提取蛋白,用BCA法测定总蛋白含量。用12% SDS-PAGE凝胶分离蛋白质并转移到PVDF膜上。用含有5%脱脂牛奶的PBS溶液封闭1h,加入稀释后的一抗,4℃摇床过夜。TBST洗膜3次,每次10min,加入对应于一抗种属来源的HRP标记的二抗,室温摇床孵育1h,TBST洗膜3次,每次10min。使用ECL化学发光液显色发光,凝胶成像系统拍照,Image Pro Plus图像分析系统对蛋白条带进行灰度值分析。

结 果
1.软骨细胞鉴定:软骨细胞的形态呈长纺锤形,而细胞膜光滑且折射良好(图1A)。甲苯胺蓝染色显示深蓝色的细胞核,蓝紫色的细胞核,紫红色的软骨细胞质(图1B)。此外,Ⅱ型胶原免疫细胞化学染色结果显示(图1C),细胞质呈褐色,细胞核被染成蓝色,由于Ⅱ型胶原是由软骨细胞特异合成和分泌的,因此成功分离和培养了原代软骨细胞。

图1 软骨细胞的鉴定(×200)A.显微镜检查软骨细胞的细胞形态;B.大鼠原代软骨细胞的甲苯胺蓝染色;C.大鼠原代软骨细胞的Ⅱ型胶原免疫细胞染色
2.瘦素最佳浓度的筛选:CCK-8结果表明,单独用不同浓度的瘦素(0、5、10、20、40、80ng/ml)培养软骨细胞24h时,软骨细胞的细胞活力不受瘦素处理的影响(图2A)。IL-1β刺激显著抑制了软骨细胞的细胞活力,瘦素+IL-1β处理软骨细胞可削弱IL-1β对软骨细胞活力的抑制,其中当瘦素浓度为10、20、40ng/ml时,软骨细胞活力增加更明显(图2B,P<0.05),因此,后续实验瘦素浓度选择10、20、40ng/ml。

图2 最佳瘦素浓度的筛选A.CCK-8分析检测瘦素(0、5、10、20、40、80ng/ml)处理软骨细胞24h时的细胞活力;B.CCK-8分析检测IL-1β刺激软骨细胞后,不同浓度的瘦素对软骨细胞活力的影响。与对照组比较,*P=0.000;与瘦素(0)组比较,#P<0.05,##P<0.01
3.瘦素促进IL-1β刺激诱导的软骨细胞增殖:集落形成实验结果表明,与对照组比较,IL-1β刺激诱导的软骨细胞的增殖能力显著下降(P=0.000),不同浓度的瘦素使IL-1β刺激诱导的软骨细胞的增殖能力增强(P<0.05,图3)。
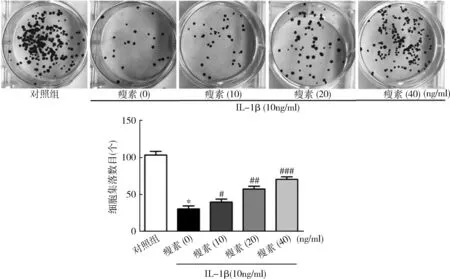
图3 瘦素促进IL-1β刺激诱导的软骨细胞增殖与对照组比较,*P=0.000;与瘦素(0)组比较,#P<0.05,##P<0.01,###P=0.000
4.瘦素抑制IL-1β刺激诱导的软骨细胞炎性细胞因子的产生:ELISA结果表明,与对照组比较,IL-1β刺激诱导的软骨细胞组的细胞培养上清液中IL-6、IL-8、TNF-α的产生增加(P=0.000),然而瘦素以剂量依赖性方式抑制IL-1β刺激诱导的炎性细胞因子(IL-6、IL-8、TNF-α)的上调(P均<0.05,图4)。

图4 瘦素抑制IL-1β刺激诱导的软骨细胞炎性细胞因子的产生A.各组细胞中IL-6的表达变化;B.各组细胞中IL-8的表达变化;C.各组细胞中TNF-α的表达变化。与对照组比较,*P=0.000;与瘦素(0)组比较,#P<0.05,##P<0.01,###P=0.000
5.瘦素抑制软骨细胞中JAK/STAT信号通路的激活:Western blot法结果表明,与对照组比较,IL-1β显著增强JAK/STAT信号转导,使JAK和STAT3的磷酸化表达显著增强(P<0.01),不同浓度的瘦素以剂量依赖性方式逆转IL-1β诱导的JAK/STA信号转导,使JAK和STAT3的磷酸化表达降低(P<0.05,图5)。

图5 瘦素抑制软骨细胞中JAK/STAT信号通路的激活与对照组比较,*P=0.000;与瘦素(0)组比较,#P<0.05、##P<0.01,###P=0.000
讨 论
OA是导致残疾的主要原因之一,严重影响着全世界约2.5亿的患者[10~12]。由于OA的保守药物治疗不能缓解或阻止OA的发展,而且在进行手术的情况下需考虑风险和经济负担[13]。因此,迫切需要寻找可以延缓或逆转OA发展的新的潜在OA药物。
研究发现,IL-1β刺激导致软骨细胞中炎性细胞因子的产生,也可以激活JAK/STAT信号通路并抑制软骨细胞增殖[14,15]。本研究发现,IL-1β刺激诱导的原代软骨细胞上清中IL-6、IL-8、TNF-α的表达量升高;IL-1β显著增强JAK/STAT信号转导,使JAK和STAT3的磷酸化表达显著增强,进而使软骨细胞的增殖能力显著下降,凋亡能力显著提高,与上述文献报道一致。瘦素通过免疫细胞产生的细胞因子影响骨转换,本研究发现瘦素能减轻IL-1β诱导刺激的软骨细胞上清中炎性因子(IL-6、IL-8、TNF-α)的表达,促进软骨细胞的增殖能力,抑制JAK/STAT信号转导,使JAK和STAT3的磷酸化表达下降[16]。
综上所述,瘦素通过OA中的JAK/STAT信号途径抑制炎性反应,增强了软骨细胞的增殖,抑制其凋亡。因此,瘦素在OA的发病过程中起着至关重要的作用,为临床上治疗OA提供新的科学理论依据。
