原位光化学还原法制备Ag-UiO-66-NH2复合物以增强其光催化性能
2020-11-11周云彩王崇臣付会芬
周云彩 王崇臣*, 王 鹏 付会芬 赵 晨
(1北京建筑大学建筑结构与环境修复功能材料北京市重点实验室,北京 100044)
(2北京建筑大学环境与能源工程学院,北京 100044)
除印染、制革等行业排放的污废水造成铬污染外,铬盐生产过程中铬渣的产生也会造成严重的铬污染[1]。铬渣经水冲刷后造成大量的六价铬离子流失、扩散,渗入地表甚至地下,对环境造成了污染,进而对水产、农业生产和人体健康产生严重危害[1]。通过光催化技术,将高毒性六价铬还原为无毒三价铬,被认为是能将有毒物质转化为无毒物质的一种很有前途的方式[2]。
UiO-66-NH2是一种经典的金属有机骨架材料(metal organic frameworks,MOFs),由 Zr6O32单元和 2-氨基对苯二甲酸酯连接组成。由于其超高稳定性、高比表面积、可设计性以及光活性等特点,受到广大研究者的青睐[3]。目前,UiO-66-NH2被广泛应用在二氧化碳还原[4]、光催化降解有机污染物及还原重金属[5-6]、荧光传感[7]、气体吸附[8]等领域。尽管UiO-66-NH2在光催化领域表现出一定的性能,人们仍致力于制备复合材料以获得更优异的光催化性能。Li等[9]将 UiO-66-NH2与酞菁锌(ZnTCPc)共价偶联,并用于提高光催化降解亚甲基蓝性能研究。Wang及其同事[10]将Cd0.2Zn0.8S与UiO-66-NH2结合以提高光催化析氢及还原二氧化碳。Wu及其同事[11]通过静电自组装法制备了RGO-UiO-66(NH2),并用于光催化还原六价铬。Wang等[12]通过离子交换将UiO-66-NH2与Ag2CO3结合并用于提高光催化还原Cr(Ⅵ)和降解有机染料性能。在MOFs中沉积贵金属纳米颗粒(metal nanoparticles particles,MNPs)作为提高光催化活性可行的方法而被广泛研究。MOFs与MNPs之间形成莫特-肖特基势垒促进了光生电子和空穴的分离。光生电子从激发的MOFs迁移到MNPs成为电子库,因此MNPs对MOFs的光催化也有促进作用。此外,MOFs与封装的MNPs之间的紧密接触和固定的空间排列有利于电荷转移,从而产生优异的光催化性能[13]。Li等[14]报道了在MIL-100(Fe)表面沉积Pt纳米颗粒获得Pt/MIL-100(Fe),实现了可见光下甲醇-水混合溶液中的水还原制氢。Wu等[15]报道了Pd@MIL-100(Fe)纳米复合材料用于光催化降解PPCPs(茶碱、布洛芬和双酚A)。Li及其研究团队[16]通过湿浸渍法制备了NH2-MIL-125(Ti)(M=Au,Pt),以三乙醇胺为牺牲剂光催化还原二氧化碳。Wang等[17]报道了通过光化学还原法制备Ag/Ag3PO4/MIL-125-NH2三元复合物并用于光催化还原Cr(Ⅵ)。
原位生长和后合成固定法是近年来制备复合材料常用的方法。原位生长与后合成固定技术相比,主要的优点是可以避免表面活性剂或额外的连接剂分子的产生,这不仅意味着简化了繁琐的生长过程,也会造成纳米复合材料的不同性能[18]。众多研究表明,原位直接生长法比后合成修饰法制备的催化剂具有更有力的分子间作用力和更充足的反应位点,从而表现出更高的催化活性[19]。Zhang及其研究团队[20]通过后合成固定的方法在甲醇溶液中通过添加聚乙烯吡咯烷酮制备了Ag-UiO-66-NH2复合物并用于还原Cr(Ⅵ)。我们以水代替有机溶剂,通过原位光化学还原沉积法制备Ag-UiO-66-NH2复合物。该法具有复合快速、简捷、绿色、节能等优点。制备所得的Ag-UiO-66-NH2光催化剂能实现高效光催化还原Cr(Ⅵ)。探究了在不同pH值的条件下,小分子有机酸和真实水体对Cr(Ⅵ)还原的影响,并对还原Cr(Ⅵ)的活性物质进行了确定,最后对光催化机理以及稳定性进行了探讨和验证。
1 实验部分
1.1 表征仪器
利用丹东浩元DX-2700B衍射仪得到样品的粉末X射线衍射图(PXRD),CuKα辐射(λ=0.154 184 nm),工作电压40 kV,工作电流30 mA,扫描范围2θ=5°~50°。在Nicolet 6700傅里叶变换红外分光光度计上(KBr压片,4 000~400 cm-1)记录了红外光谱(FTIR)。采用Perkin-Elmer-Lambda 650S分光光度计,以硫酸钡(BaSO4)为基准,在200~800 nm范围内观察了不同材料的紫外可见漫反射吸收光谱(UV-Vis DRS)。采用扫描电子显微镜(SEM,SU8020,外加电压15 kV)、透射电子显微镜(TEM,JEM 1200EX)和高分辨率透射电子显微镜(HRTEM,Tecnai G2 F20)观察材料的形貌。在Thermo ESCALAB 250XI上获得XPS。通过Brunauer-Emmett-Teller(BET)氮气吸附法在BELSORP-MiniⅡ、77 K下测定比表面积和孔径分布。在上海天美分光光度计上(FL970)记录了室温下的光致发光光谱(PL),激发波长为350 nm。在JEOL JES-FA200可见光下采用DMPO捕捉超氧自由基(·O2-)。Metrohm Autolab PGSTAT204电化学工作站以典型的三电极模式,在0.2 mol·L-1Na2SO4水溶液(pH=2.0)中记录了莫特-肖特基曲线和电化学阻抗谱(EIS)图。利用德国Seal公司的自动分析仪(AA3)采用二苯碳酰肼(DPC)法测定了光催化后的溶液中的残留Cr(Ⅵ)浓度。
1.2 光催化剂的制备
1.2.1 UiO-66-NH2的合成
UiO-66-NH2参照文献[12]改进合成。简言之:将2-氨基对苯二甲酸(0.81 g)完全超声溶解于40 mLN,N-二甲基甲酰胺(DMF)中,然后向上述溶液中分别加入1.05 g四氯化锆(ZrCl4)和17 mL乙酸(HAc)。上述过程均在100 mL含有聚四氟乙烯内衬的不锈钢高压釜中进行,最后置于烘箱保持120℃加热24 h。通过加入HAc调节UiO-66-NH2的形态。缓慢冷却至室温后,用超纯水离心并清洗数次得到黄色固体。最后,在使用前将UiO-66-NH2置于真空干燥箱中80℃处理12 h,以除去未反应的DMF以及表面的杂质。
1.2.2 Ag-UiO-66-NH2复合物的制备
如图1所示,将0.20 g UiO-66-NH2加入100 mL去离子水中,在磁力搅拌下处理60 min。取10 mL 0.1 mol·L-1AgNO3加入到上述 UiO-66-NH2溶液中,并保持磁力搅拌60 min。分散均匀后的混合溶液在500 W氙灯(北京中教金源科技有限公司)下照射(时间X=10、30、50和70 min)使附着在UiO-66-NH2表面的Ag+离子还原为Ag0。最后,通过离心收集所制备的复合物并用超纯水清洗数次,在烘箱内60℃处理12 h。所得复合物记为X-Ag-UiO-66-NH2。

图1 原位制备Ag-UiO-66-NH2复合材料流程图Fig.1 Illustration of in-situ fabrication of Ag-UiO-66-NH2 composites
1.3 光催化实验
在含有15 mgX-Ag-UiO-66-NH2复合材料(或UiO-66-NH2)的石英玻璃容器中加入50 mL浓度为10 mg·L-1、pH值为2.0的Cr(Ⅵ)溶液,在黑暗中磁力搅拌30 min以达到吸附-解吸平衡。随后,用5.00 W的LED光源(PCX50A,北京泊菲莱科技有限公司)照射Cr(Ⅵ)溶液80 min,在此过程中保持磁力搅拌。每经20 min光照间隔抽取1.5 mL溶液,经0.45 μm滤膜过滤后进行分析。滤液中残留Cr(Ⅵ)浓度采用二苯卡巴肼(DPC)法通过德国Seal公司的自动分析仪(AA3)测定。
2 结果与讨论
2.1 催化剂的表征
UiO-66-NH2及X-Ag-UiO-66-NH2复合物的PXRD如图2a所示。UiO-66-NH2的PXRD图与之前报道一致,表明UiO-66-NH2成功合成且结晶度良好[12]。从图2a可观察到X-Ag-UiO-66-NH2的PXRD图中包含了UiO-66-NH2的所有特征峰,但未发现属于Ag0的特征峰。这可能是因为X-Ag-UiO-66-NH2中Ag纳米颗粒含量较低导致结晶度低,在之前众多研究中均可发现这种现象[21-23]。UiO-66-NH2及其XAg-UiO-66-NH2复合物的FTIR图进一步证明了UiO-66-NH2骨架结构的完整性(图2b)。从X-Ag-UiO-66-NH2复合物的FTIR谱图中可以发现UiO-66-NH2的羧基官能团(约为1 582和1 382 cm-1)和Zr-O2的吸收峰(600~800 cm-1)[24]。
采用UV-Vis DRS对UiO-66-NH2及X-Ag-UiO-66-NH2复合物的光吸收特性进行了表征。原始的UiO-66-NH2峰值在200~430 nm之间出现一个宽峰,这与文献报道的峰值结果一致[12]。X-Ag-UiO-66-NH2在可见光区域的吸收峰增强(如图2c),可能是由于Ag纳米颗粒的表面等离子体效应[21]。根据带隙能量计算公式可知UiO-66-NH2及X-Ag-UiO-66-NH2复合物的Eg值分布在2.72~2.94 eV之间,表明UiO-66-NH2和X-Ag-UiO-66-NH2复合材料均能被可见光激发(图 2d)。
通过SEM和HRTEM图(图3a和4a)可看出原始UiO-66-NH2呈现大小均匀的正八面体形状(尺寸在300~400 nm之间)。X-Ag-UiO-66-NH2复合材料表面分布着经光照形成的Ag0纳米颗粒(图3b~3e和图4b、4c)。HRTEM图(图4c)进一步表征了30 min-Ag-UiO-66-NH2的微观结构。30 min-Ag-UiO-66-NH2中位于0.236 nm处的晶格间距对应着Ag0纳米颗粒的(111)晶面,证明了Ag纳米颗粒成功负载在UiO-66-NH2上[25]。上述表征结果均证明了X-Ag-UiO-66-NH2复合材料的成功合成。
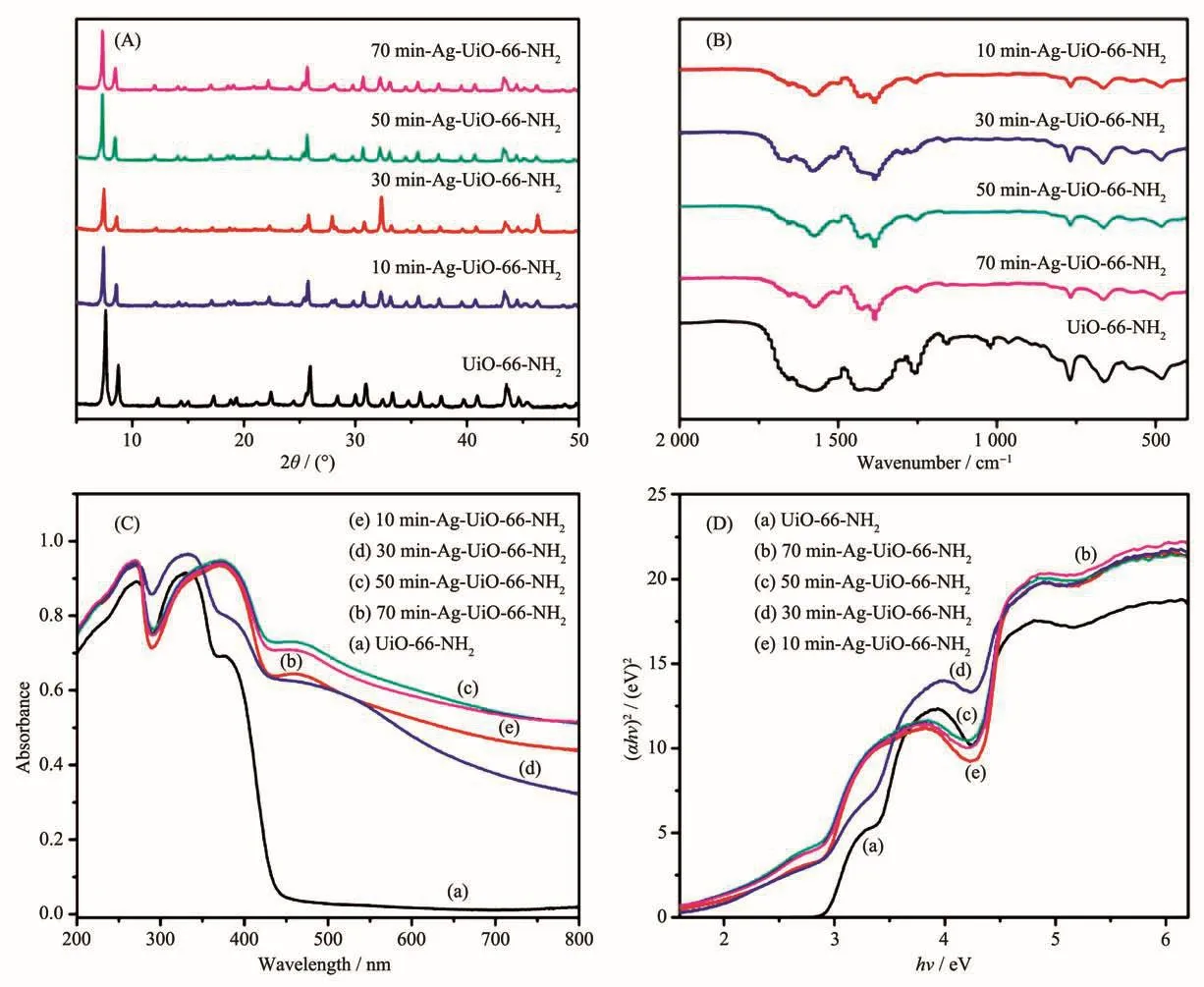
图2 UiO-66-NH2及其复合材料的(A)PXRD图、(B)FTIR图、(C)UV-Vis DRS和(D)Eg图Fig.2 (A)PXRD patterns,(B)FTIR spectra,(C)UV-Vis DRS and(D)Eg plots of UiO-66-NH2 and series of composites

图 3 (a)UiO-66-NH2、(b)10 min-Ag-UiO-66-NH2、(c)30 min-Ag-UiO-66-NH2、(d)50 min-Ag-UiO-66-NH2和(e)70 min-Ag-UiO-66-NH2的SEM图Fig.3 SEM images of(a)UiO-66-NH2,(b)10 min-Ag-UiO-66-NH2,(c)30 min-Ag-UiO-66-NH2,(d)50 min-Ag-UiO-66-NH2 and(e)70 min-Ag-UiO-66-NH2

图4 (a)UiO-66-NH2和(b、c)30 min-Ag-UiO-66-NH2的TEM图;(d)30 min-Ag-UiO-66-NH2的HRTEM图Fig.4 TEM images of(a)UiO-66-NH2 and(b,c)30 min-Ag-UiO-66-NH2;(d)HRTEM images of 30 min-Ag-UiO-66-NH2
采用XPS进一步表征30 min-Ag-UiO-66-NH2的表面组成及化学状态。30 min-Ag-UiO-66-NH2的全谱含有Ag元素及来自UiO-66-NH2的Zr、C、N和O元素。如图5所示,30 min-Ag-UiO-66-NH2在374.51和368.59 eV处的特征峰分别对应Ag3d3/2和Ag3d5/2。373.47 eV处的结合能可能来自体系中未反应的Ag-NO3中的Ag+离子,而370.03和375.36 eV处的结合能属于光还原产生的Ag0纳米颗粒[26]。位于182.84和185.23 eV处的双峰分别来自UiO-66-NH2的Zr3d5/2和Zr3d3/2[27]。30min-Ag-UiO-66-NH2在 284.70、286.02和288.58 eV处的结合能分别对应于C-C、CO、和O-C=O键。N1s在399.69和400.40 eV处的结合能分别对应延伸或伸入空腔的-NH2的N和带正电的氮(-N=+或-NH-+)[12,28]。30 min-Ag-UiO-66-NH2的O1s区在531.73 eV处的结合能归因为O-C键[12]。上述XPS测试结果进一步证明了30 min-Ag-UiO-66-NH2复合物成功制备。

图5 30 min-Ag-UiO-66-NH2的XPS谱图Fig.5 XPS spectra of 30 min-Ag-UiO-66-NH2
2.2 Ag-UiO-66-NH2复合物光催化性能探究
研究了UiO-66-NH2及X-Ag-UiO-66-NH2复合材料在pH=2时光催化还原Cr(Ⅵ)的效率。如图6a所示,Cr(Ⅵ)反应溶液首先在黑暗中吸附30 min,UiO-66-NH2及X-Ag-UiO-66-NH2对Cr(Ⅵ)的吸附去除率分布在1.2%~10.3%之间。在可见光照射下,X-Ag-UiO-66-NH2复合材料在相同条件下对Cr(Ⅵ)的光催化还原性能优于原始的UiO-66-NH2。30 min-Ag-UiO-66-NH2在40 min内能达到94.0%的Cr(Ⅵ)还原效率,高于10min-Ag-UiO-66-NH2(51.7%)、50min-Ag-UiO-66-NH2(61.4%)、70 min-Ag-UiO-66-NH2(64.9%)和 UiO-66-NH2(6.5%)的还原效率(表1)。同等条件下后合成(post synthesis)制备的 ps-30 min-Ag-UiO-66-NH2在80 min还原Cr(Ⅵ)效果仅能达到34.8%。X-Ag-UiO-66-NH2还原Cr(Ⅵ)的伪一阶动力模型进一步证明了30 min-Ag-UiO-66-NH2具有更高的还原速率常数(k值)(图6b)。不同光催化剂的还原速率常数(k值)大小依次为30 min-Ag-UiO-66-NH2>70 min-Ag-UiO-66-NH2>50 min-Ag-UiO-66-NH2>10 min-Ag-UiO-66-NH2>UiO-66-NH2。30 min-Ag-UiO-66-NH2在相同条件下表现出更优异的光催化Cr(Ⅵ)性能,这可能是因为引入适当的Ag纳米颗粒有助于改善在可见光照射下复合材料界面上的电荷转移。30 min-Ag-UiO-66-NH2在pH=2时正的ζ电位(图6c)有益于Cr2O72-被吸附在光催化剂表面从而促进下一步的光催化。30 min-Ag-UiO-66-NH2的标准N2吸附测量表明其BET比表面积约为540 m2·g-1(图6d),高比表面积也为光催化反应提供了充足的活性位点。然而,从50 min-Ag-UiO-66-NH2和 70 min-Ag-UiO-66-NH2的光催化结果可看出,经长时间高功率氙灯照射产生的Ag纳米颗粒可能会抑制有效的异质结界面,不利于电荷载流子的转移。因此,选择30 min-Ag-UiO-66-NH2作为后续实验的最佳光催化剂。

图6 (a)不同光催化剂材料对Cr(Ⅵ)的吸附和光催化性能;(b)不同光催化剂材料对Cr(Ⅵ)的光催化还原速率(k值);(c)30 min-Ag-UiO-66-NH2的ζ电位;(d)30 min-Ag-UiO-66-NH2的N2吸附-解吸等温线Fig.6 (a)Adsorption and photocatalytic performance of samples prepared toward Cr(Ⅵ);(b)Photocatalytic reduction rates(k values)of samples prepared toward Cr(Ⅵ);(c)ζ potential of 30 min-Ag-UiO-66-NH2;(d)N2 adsorption-desorption isotherm of the samples 30 min-Ag-UiO-66-NH2

表1 不同光催化剂的光催化Cr(Ⅵ)还原效率Table 1 Photocatalytic Cr(Ⅵ)reduction efficiencies(%)of different photocatalysts
2.2.1 表观量子效率测定
不同单色光下的表观量子效率(AQE)可以用来评价光催化还原Cr(Ⅵ)的活性。30 min-Ag-UiO-66-NH2在520、420、365、330和315 nm的AQE值分别为0.15%、0.18%、3.37%、6.22%和5.83%(图7a)。结果表明,30 min-Ag-UiO-66-NH2的AQE曲线与紫外可见漫反射谱图基本一致,说明Cr(Ⅵ)的还原是一种光诱导催化反应。
2.2.2 初始pH值对Cr(Ⅵ)还原的影响

图7 (a)30 min-Ag-UiO-66-NH2在不同单色光下还原Cr(Ⅵ)的AQE曲线;(b)30 min-Ag-UiO-66-NH2在不同pH值下的光催化还原Cr(Ⅵ)效率;(c)自来水、湖水和模拟海水制备的Cr(Ⅵ)溶液对光催化Cr(Ⅵ)的影响;(d)不同小分子有机酸对Cr(Ⅵ)还原的影响Fig.7 (a)AQE of Cr(VI)reduction over 30 min-Ag-UiO-66-NH2 at various monochromatic lights;(b)Photocatalytic Cr(Ⅵ)reduction efficiencies at different pH values over 30 min-Ag-UiO-66-NH2;(c)Effect of Cr(Ⅵ)solution prepared from tap water,lake water and simulated sea water on the Cr(Ⅵ) reduction;(d)Effect of different small organic acids on the Cr(Ⅵ) reduction
一般来说,Cr(Ⅵ)的初始pH值对其光催化活性有很大的影响[29]。以30 min-Ag-UiO-66-NH2作为光催化剂,研究了不同pH值对Cr(Ⅵ)还原的影响,如图7b所示,较低的pH值有利于获得更好的光催化效率和速率。尤其在pH值为2.0时,30 min-Ag-UiO-66-NH2对还原Cr(Ⅵ)具有最高的光催化效率(40 min内还原效率达94.0%,60 min去除100.0%)。在低pH值下,六价铬以Cr2O72-的形式存在,催化剂表面较高的质子化程度有助于吸附Cr2O72-离子,而丰富的 H+也促进了从Cr(Ⅵ)到Cr(Ⅲ)的转变,如公式(1)所示[2]。在碱性条件下,Cr(Ⅵ)还原反应遵循式(2)[12]。此时,生成的Cr(OH)3沉淀会掩盖催化剂表面的活性位点导致光催化效率下降。
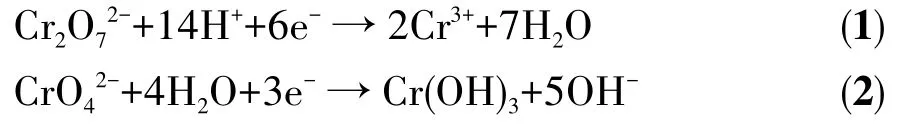
2.2.3 不同模拟废水对Cr(Ⅵ)还原的影响
为探究外来离子对光催化还原Cr(Ⅵ)的影响,选取湖水、自来水和模拟海水配制的Cr(Ⅵ)溶液为目标靶物(水质参数见表S1)[12],探究了30 min-Ag-UiO-66-NH2在pH值为2.0时光催化Cr(Ⅵ)的活性。如图7c所示,Cr(Ⅵ)经过60 min光催化反应还原效率从100%下降到60%,表明自来水中的无机盐离子抑制了30 min-Ag-UiO-66-NH2对Cr(Ⅵ)的还原。湖水中的有机物可以消耗空穴促进光生电子和空穴的分离,从而导致湖水中的Cr(Ⅵ)还原效率比自来水中的高(78%,60 min)。模拟海水配制的Cr(Ⅵ)溶液中,30 min-Ag-UiO-66-NH2光催化还原Cr(Ⅵ)的效率仅能达到54.4%,这可能是由于模拟海水中所含有的较高浓度的杂质离子造成的[2]。
2.2.4 小分子有机酸对Cr(Ⅵ)还原的影响
为进一步了解30 min-Ag-UiO-66-NH2光催化还原Cr(Ⅵ)的最适条件,选用柠檬酸、酒石酸、草酸等小分子有机酸作为空穴清除剂,探究其在pH=2.0时对Cr(Ⅵ)还原效率的影响。如图7d所示,小分子有机酸(柠檬酸、草酸和酒石酸)的加入可以提高光催化还原Cr(Ⅵ)效率,这是因为在可见光照射下有机物会消耗30 min-Ag-UiO-66-NH2光催化剂上产生的空穴,从而促进对Cr(Ⅵ)的还原。通过向光催化还原Cr(Ⅵ)体系中加入有机物会促进更多的电子逸向Cr(Ⅵ),从而有助于Cr(Ⅵ)的还原。
2.2.5 光催化还原六价铬活性物质的确定
为进一步了解光催化还原Cr(Ⅵ)的本质,通过向反应体系中加入不同捕捉剂来探究在光催化过程中起作用的活性物质。具体而言,加入乙二胺四乙酸二钠(EDTA-2Na,0.2 mmol·L-1)和溴酸钾(KBrO3,0.4 mmol·L-1)分别捕获空穴和电子,向体系中加入苯醌(BQ,0.2 mmol·L-1)捕获·O2-及充入氮气(N2,160 mL·min-1)抑制·O2-。如图8a所示,EDTA-2Na的加入促进了Cr(Ⅵ)的还原,而加入KBrO3后还原Cr(Ⅵ)效率降为64.7%,体系中加入BQ和充氮气后均明显抑制了Cr(Ⅵ)的还原,表明·O2-和电子均参与了可见光催化还原Cr(Ⅵ)[2]。如图8b所示,在可见光照射下,30 min-Ag-UiO-66-NH2在Lande因子g=2.004 2处观察到强度为1∶1∶1∶1的·O2-的ESR 信号[2]。此时,光照10 min时的ESR信号强度比在5 min时强,而在黑暗条件下未检测到该信号,这证实了光催化过程中产生了·O2-[12]。
图8 (a)不同的捕捉剂对Cr(Ⅵ)还原的影响;(b)30 min-Ag-UiO-66-NH2在可见光照射下DMPO(5,5-二甲基-1-吡咯啉-N-氧化物)捕捉·O-2Fig.8 (a)Effect of different scavengers on the Cr(Ⅵ)reduction;(b)ESR of radical adducts trapped by DMPO(5,5-dimethyl-1-pyrroline-N-oxide)to detect·O2-over 30 min-Ag-UiO-66-NH2 under visible light
2.3 Ag-UiO-66-NH2的可重复利用性和稳定性
为考察光催化剂实际应用的可能性,对30 min-Ag-UiO-66-NH2光催化还原Cr(Ⅵ)进行了5次循环实验(图9a)。经过5次循环后,30 min-Ag-UiO-66-NH2依然保持了优异的光催化活性(80 min,100%),并且光催化还原Cr(Ⅵ)后的PXRD和FTIR与反应前的一致(图9b和9f),说明30 min-Ag-UiO-66-NH2光催化剂在经过循环实验后仍保持很高的稳定性。光催化反应后的XPS进一步证实了30 min-Ag-UiO-66-NH2表面化学状态的完整性(图9c和9d)。XPS的Cr2p轨道中观察到了Cr(Ⅲ)2p3/2轨道,这对应着经Cr(Ⅵ)还原生成的Cr(Ⅲ)。循环后的UiO-66-NH2形貌没有明显的形状变化(图9e)。在相同的反应条件下,30 min-Ag-UiO-66-NH2与其他光催化剂相比仍保持了较高的光催化活性(表2)。同之前文献报道一致[19],原位合成比后合成固定制备的材料往往表现出更优异的催化活性。综上所述,经原位光化学沉积生成的30 min-Ag-UiO-66-NH2光催化剂具有良好的可重复利用性和稳定性。
2.4 光催化反应机理探究
利用光致发光技术探究复合材料光催化过程中光生载流子的分离效率。较高的荧光发射强度意味着光诱导电子和空穴的快速复合,表现出较低的光催化性能[12]。以350 nm为激发波长对UiO-66-NH2和30 min-Ag-UiO-66-NH2进行激发,结果表明30 min-Ag-UiO-66-NH2复合材料相对于UiO-66-NH2发射峰发生了轻微的红移,分别位于451和442 nm处。与原始UiO-66-NH2相比,30 min-Ag-UiO-66-NH2的发光强度在442 nm处发生明显淬灭,这表明30 min-Ag-UiO-66-NH2光生电子和空穴复合得到了有效抑制(图 10a)[34]。

图9 (a)可见光下30 min-Ag-UiO-66-NH2的可重复利用性;(b)30 min-Ag-UiO-66-NH2光催化还原Cr(Ⅵ)前后PXRD的比较;光催化还原Cr(Ⅵ)后的(c)XPS全谱图和(d)Cr2p高分辨图谱;(e)30 min-Ag-UiO-66-NH2经过5次循环后的SEM图像;(f)5次循环前后30 min-Ag-UiO-66-NH2的FTIR对比图Fig.9 (a)Reusability of 30 min-Ag-UiO-66-NH2 under visible light;(b)Comparison of PXRD before and after five cycles of photocatalytic Cr(Ⅵ)reduction by 30 min-Ag-UiO-66-NH2;(c)XPS survey spectrum and(d)Cr2p spectrum of 30 min-Ag-UiO-66-NH2 after photocatalytic Cr(Ⅵ)reduction;(e)SEM image of 30 min-Ag-UiO-66-NH2 after five cycles;(f)FTIR spectra of 30 min-Ag-UiO-66-NH2 before and after five cycles
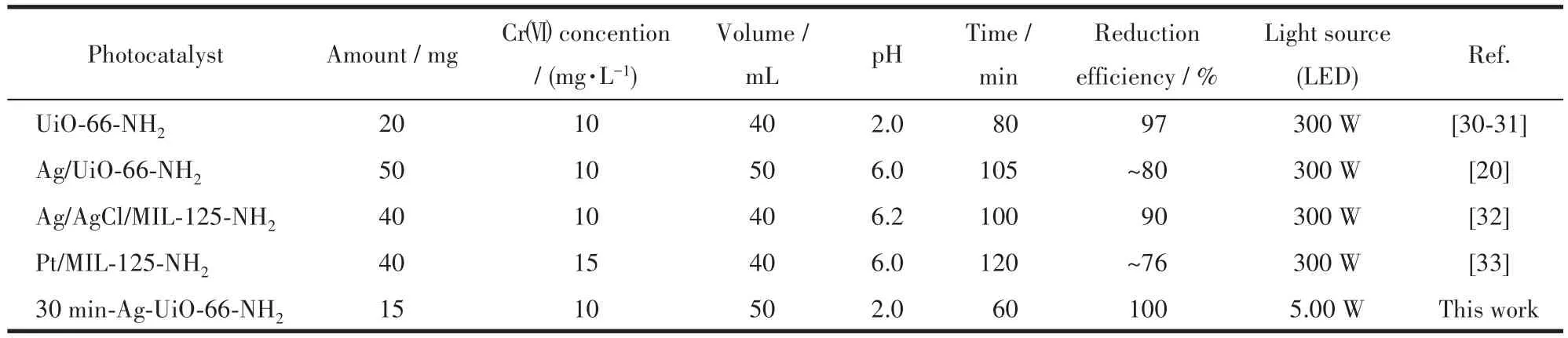
表2 光催化剂还原Cr(Ⅵ)的性能对比Table 2 Performance comparison of several photocatalysts for Cr(Ⅵ)reduction

图10 (a)不同光催化剂的光致发光光谱;(b)不同光催化剂的电化学交流阻抗;(c)UiO-66-NH2在不同频率下的莫特-肖特基曲线;(d)30 min-Ag-UiO-66-NH2在可见光下光催化还原Cr(Ⅵ)可能的机理Fig.10 (a)PL spectra of different photocatalyst;(b)EIS of different photocatalyst;(c)Mott-Schottky curves of UiO-66-NH2 at various frequencies;(d)Proposed mechanism for the photocatalytic Cr(Ⅵ)reduction over 30 min-Ag-UiO-66-NH2 under visible light
使用电化学交流阻抗验证了光生电荷转移和复合。交流阻抗谱图上的尼奎斯特弧直径等于半导体-电解质界面上的电荷转移电阻,尼奎斯特弧半径越小对应电荷转移电阻越小[12]。如图10b所示,30 min-Ag-UiO-66-NH2复合材料的弧半径远小于 UiO-66-NH2,这表明 30 min-Ag-UiO-66-NH2上的光致空穴和电子对被有效地分离,验证了30 min-Ag-UiO-66-NH2具备更高的光催化活性。
UiO-66-NH2的莫特-肖特基曲线(图10c)中的C2值与电位值之间呈正相关,表明UiO-66-NH2属于n型半导体[12]。由莫特-肖特基曲线可大致推断UiO-66-NH2相对于Ag/AgCl电极的平带电位为-1.25 eV。因此,在pH=2.0时,UiO-66-NH2的最低未占分子轨道(LUMO)为-0.95 eV。根据UiO-66-NH2的LUMO值及带隙值(2.83 eV)可知,UiO-66-NH2最大占据分子轨道(HOMO)应为1.88 eV。
在上述实验和性能探究的基础上,提出了可见光照射下还原Cr(Ⅵ)可能的光催化机理(图10d)。众所周知,在可见光照射下,UiO-66-NH2最大占据分子轨道(HOMO)中的电子将被激发到最低未占分子轨道(LUMO),从而在HOMO上留下空穴(h+)。由于UiO-66-NH2的LUMO电位比金属Ag0(2.3 eV)的费米能级要低,光诱导的电子(e-)会由LUMO很容易地通过肖特基势垒迁移到Ag0纳米颗粒上(电子转移路径:UiO-66-NH2LUMO→Ag0),从而促进了UiO-66-NH2上的光生空穴和电子对的分离。转移到Ag0纳米颗粒上的电子可直接参与Cr(Ⅵ)的还原,也可以将O2还原成·O2-。·O2-将通过式(3~5)参与光催化还原Cr(Ⅵ)[35],这可通过BQ和N2捕捉·O2-实验证明(图 8a)。在X-Ag-UiO-66-NH2复合材料的还原反应中,Ag0纳米颗粒促进了光致空穴和光诱导电子的有效分离,提高了光催化性能。
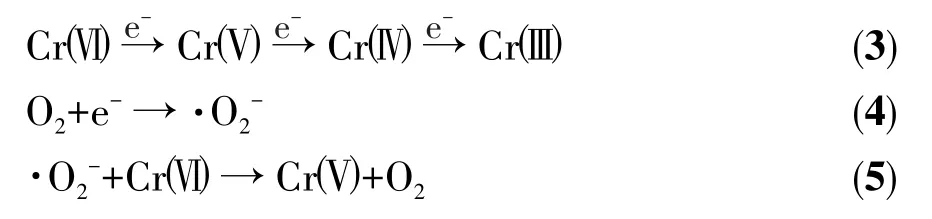
3 结论
通过原位光化学沉积法制备了一种高效稳定的可见光催化剂Ag-UiO-66-NH2,其中30 min-Ag-UiO-66-NH2复合材料在pH=2.0时表现出优异的Cr(VI)的光催化性能。研究发现,湖水中溶解性有机物和小分子有机酸可以加速Cr(Ⅵ)的还原,而自来水中的无机盐离子以及模拟海水中的高浓度离子可以抑制Cr(Ⅵ)的光催化活性。30 min-Ag-UiO-66-NH2光催化活性的提高归因于Ag0纳米颗粒促进了光生电子和空穴的分离。ESR和活性物质捕获实验证明,·O2-和光生电子均参与了Cr(Ⅵ)的还原。30 min-Ag-UiO-66-NH2在光催化还原Cr(Ⅵ)中具有良好的可重复利用性和稳定性。研究结果表明,通过光化学沉积法简便快速地制备Ag基MOF可大幅度提高光催化效率,为水处理提供了备选的新材料。
Supporting information is available at http://www.wjhxxb.cn
