2个具有四重穿插框架和dia网络的5-羟甲基间苯二甲酸类Zn(Ⅱ)配位聚合物的合成、结构和荧光性质
2020-11-11徐中轩李立凤徐仕菲陈雪婷
徐中轩 李立凤 徐仕菲 陈雪婷
(遵义师范学院化学化工学院,遵义 563002)
配位聚合物(coordination polymers,CPs)是由有机配体与金属离子或簇利用配位键形成的晶态材料。其精致的结构和在催化、分离、气体吸附、磁性以及荧光等方面的应用,成为了化学、材料学和物理学等领域的研究热点[1-5]。经过多年发展,虽然大量不同结构的功能化CPs已被合成出来,但得到特定结构的CPs仍然是一个挑战。这是由于CPs合成过程中,配体、金属离子、温度、pH值、溶剂体系以及抗衡离子等诸多因素会影响最终结构,成功筛选到构筑目标结构的反应条件是非常困难的[6-12]。在这些因素中,配体在合成CPs时发挥了关键作用,一直备受关注[13-16]。在CPs领域,芳香羧酸类化合物以其丰富的配位模式和刚性的骨架,成为构建CPs的高效有机配体[17-18]。此外,在羧酸化合物与金属离子反应时,引入一些氮杂环化合物作为辅助配体参与构建CPs,也是获得结构多样性CPs的有效手段之一[19]。
在前期工作中,我们已经尝试用5-羟基间苯二甲酸(5-(hydroxymethyl)isophthalic acid,H2HIPA)来构建CPs[20]。作为一种新型的羧酸配体,H2HIPA具备芳香羧酸的优点,理应合成出结构各异的CPs。然而,基于H2HIPA的CPs却非常罕见,其研究还处于起始阶段[21-22]。这里,我们继续之前的研究,利用氮杂环辅助配体1,4-双(2-甲基-1氢-咪唑-1-基)苯(1,4-bis(2-methyl-1H-imidazol-1-yl)benzene,1,4-BMIB)以及1,2-二(吡啶-4-基)乙烯(1,2-di(pyridin-4-yl)ethene,dpee)分别与 H2HIPA 和 Zn(Ⅱ)构建 CPs(图1)。在相似的溶剂热条件下,合成了2种不同的配合物,也就是[Zn(HIPA)(1,4-BMIB)]n(1)和{[Zn(HIPA)(dpee)]·0.5dpee}n(2)。下面就报道它们的合成过程、结构细节和荧光性质。

图1 配体H2HIPA、1,4-BMIB和dpee的结构Fig.1 Structures of H2HIPA,1,4-BMIB and dpee
1 实验部分
1.1 试剂和仪器
H2HIPA参照之前的报道合成[20],其它的试剂和溶剂为分析纯,购自上海安耐吉化学有限公司,没有进一步纯化,直接使用。粉末X射线衍射(PXRD)和热失重分析(TGA)分别在Rigaku MiniFlex600粉末衍射仪(电压40 kV,电流15 mA,以CuKα为辐射源,λ=0.154 056 nm,收集范围5.00°~50.00°)和Netzsch STA 449F5热重分析仪(氮气气氛下测试,测试范围为室温至800℃,升温速率10℃·min-1)上获得。红外光谱和C、H、N含量分别在FTIR650型红外光谱仪和Perkin-Elmer 240C型元素分析仪上得到。固体紫外-可见吸收谱和荧光发射谱分别在Shimadzu UV-3600 Plus分光光度仪和FL7000光谱仪上收集。
1.2 配合物[Zn(HIPA)(1,4-BMIB)]n(1)的合成
将 Zn(NO3)2·6H2O(0.045 g,0.15 mmol)、H2HIPA(0.021 g,0.10 mmol)、1,4-BMIB(36 mg,0.15 mmol)、N,N-二甲基乙酰胺(DMA,3 mL)、乙醇(1 mL)和水(1 mL)的混合物加入23 mL的聚四氟乙烯反应釜内胆中。室温下搅拌5 min后,在120℃条件下反应48 h,过滤得到无色块状晶体。经乙醇洗涤,干燥后产率为45%(基于配体H2HIPA)。元素分析实测值(%,括号内为按C23H20N4O5Zn计算值):C 54.62(55.49),H 4.22(4.05),N 10.96(11.25)。IR(KBr压片,cm-1):3 422 m,1 630s,1 566m,1 503s,1 417w,1 355s,1 305w,1 163m,1 145w,1 088w,1 002w,773w,736w,668w,536w。
1.3 配合物{[Zn(HIPA)(dpee)]·0.5dpee}n(2)的合成
合成条件与1相似,只是用dpee替代1,4-BMIB。得到无色块状晶体,产率为30%(基于配体H2HIPA)。元素分析实测值(%,括号内为按C23H20N4O5Zn 计算值):C 58.92(60.74),H 4.02(4.15),N 7.56(7.87)。IR(KBr压片,cm-1):3 329w,1 695w,1 603s,1 559m,1 429m,1 335s,1 249m,1 219m,1 027m,1 002w,835m,785w,736w,550m。
1.4 配合物结构测定
配合物1和2衍射数据在Rigaku 003型单晶衍射仪上以MoKα射线(λ=0.071 073 nm)为辐射源分别获得。然后用Rigaku OD 2015软件还原数据,在Olex2-1.2软件中用SHELXT-2017和SHELXL-2017程序对配合物进行结构解析和精修[23-25]。非氢原子坐标及其热参数通过全矩阵最小二乘法修正,晶体学数据见表1,部分键长和键角见表S1(Supporting information)。
CCDC:2000801,1;2000802,2。

表1 配合物1和2的晶体参数和结构精修细节Table 1 Crystallographic parameters and structure refinement details for 1 and 2
2 结果与讨论
2.1 配合物1和2的晶体结构
单晶结构解析证实1结晶于正交的Ibca空间群,不对称单元由半个Zn(Ⅱ)中心、半个去质子的HIPA2-和半个1,4-BMIB配体组成。如图2a所示,Zn(Ⅱ)中心采用四面体的配位模式分别与2个羧基O以及2个咪唑N配位,导致每个Zn(Ⅱ)中心同时连接2个HIPA2-配体和2个1,4-BMIB配体。按照上述连接方式,Zn(Ⅱ)中心、HIPA2-和1,4-BMIB配体一起形成一个具有蜂窝状纳米孔道的三维框架(图2b)。纳米通道孔径达到了2.0 nm×1.2 nm,在如此空旷的框架中,结构穿插是难以避免的。进一步分析可发现配合物1的框架是由4个独立网络形成的四重穿插结构(图2c)。在框架中,Zn(Ⅱ)中心为四连接的节点,HIPA2-和1,4-BMIB配体为简单连接体,达到一个四连接的dia网络(图 2d)[26]。
配合物2结晶于单斜的P21/n空间群。每个不对称单元由一个Zn(Ⅱ)中心、一个去质子的HIPA2-、一个dpee配体和半个作为客体分子的dpee组成。Zn(Ⅱ)中心采用五角双锥构型,与来自2个HIPA2-配体的3个羧基O以及2个吡啶N配位(图3a)。HIPA2-和dpee配体将Zn(Ⅱ)中心连接在一起,同样得到一个具有纳米通道的三维框架(图3b)。在框架中,通道的孔径为1.6 nm×1.3 nm,与配合物1一样,结构穿插同样不可避免,也是一个四重穿插的dia型网络结构(图 3c和 3d)[26]。
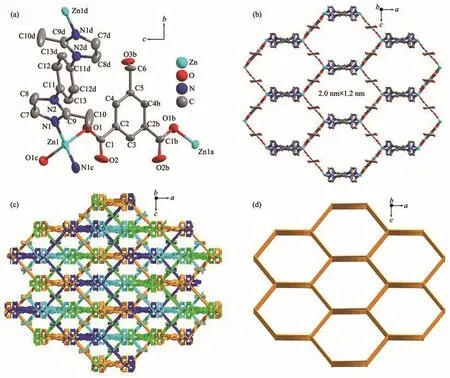
图2 配合物1结构示意图:(a)Zn(Ⅱ)中心的配位环境;(b)具有蜂窝状纳米孔道的三维框架;(c)沿着b轴方向的四重穿插结构;(d)4-连接的dia网络Fig.2 Schematic illustrations of 1:(a)Coordination environment of Zn(Ⅱ)center(Ellipsoid probability level:30%);(b)3D framework with honeycomb-like nanochannel;(c)4-Fold-interpenetrating structure along b axis;(d)4-Connected dia net

图3 配合物2的结构示意图:(a)Zn(Ⅱ)中心的配位环境;(b)具有纳米孔道的三维框架;(c)四重穿插的三维结构;(d)4-连接的dia网络Fig.3 Schematic illustrations of 2:(a)Coordination environment of Zn(Ⅱ)atoms(Ellipsoid probability level:30%);(b)3D framework with nanochannel;(c)4-Fold-interpenetrating 3D structure;(d)4-Connected dia net
从以上结构描述可发现,1和2中Zn(Ⅱ)离子都是四连接中心,HIPA2-、1,4-BMIB以及dpee为简单连接体,最终都形成dia网络。这是由金属离子和有机配体的特征决定的。此外,尽管在配合物1和2的合成过程中,羧酸配体、金属离子、溶剂体系和温度都是相同的,但Zn(Ⅱ)中心配位模式、晶胞体积、晶系和空间群等都不同,应归因于辅助配体结构的不一样。
2.2 PXRD和TGA表征
为了检验配合物的相纯度和热稳定性,对所合成的1和2进行了PXRD和TGA测试。PXRD测试结果显示,实验所得XRD图与晶体结构模拟所得的非常吻合,证实宏量制备产物是单晶结构代表的纯相(图S3)。在TGA测试过程中,配合物1从室温到391℃之间的曲线几乎呈一条直线,说明化合物在此温度区间非常稳定。391℃后,配合物开始分解,急剧的失重发生,失重现象持续到实验结束。配合物2在室温至320℃之间也没有明显的失重现象,320℃后,曲线急剧下降,配合物开始分解,失重现象也持续到实验结束(图S4)。
2.3 配合物的固体紫外-可见吸收谱和荧光发射谱
1和2的紫外-可见吸收光谱如图4a所示。从红外区到可见光区,配合物1和2的吸收强度逐渐增加,在紫外区的200~400 nm和200~313 nm处,分别各有一个强的吸收峰。其特征吸收峰应是配体或配体与金属离子之间的π-π*电子转移导致的。
锌、镉等d10类型金属离子的荧光特质是令人感兴趣的研究对象。因此,我们对配合物1和2进行了荧光测试。在波长330和380 nm激发光作用下,1和2分别在414和440 nm出现最大发射峰。为进一步理解配合物荧光形成机理,对配体H2HIPA和dpee也做了荧光测试。发现在362和342 nm激发光作用下,H2HIPA和dpee分别在430和392 nm处有最大发射峰。相对于配体发射光谱,配合物1发生了明显的蓝移,而配合物2则发生了红移现象(图4b)。锌离子非常稳定,难于被氧化和还原,配合物1和2的荧光特征应归因于配体间的n-π*或π-π*相互作用[4]。
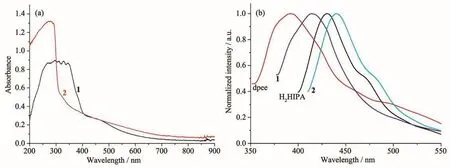
图4 配合物1和2的固体紫外-可见吸收谱(a)以及1、2、H2HIPA和dpee的固态荧光发射谱(b)Fig.4 Solid UV-Vis spectra of 1 and 2(a),and fluorescent emission spectra of 1,2,H2HIPA and dpee(b)
3 结论
H2HIPA作为主配体,在辅助配体1,4-BMIB和dpee的存在下与锌离子组装得到2个三维的配合物[Zn(HIPA)(1,4-BMIB)]n(1)和{[Zn(HIPA)(dpee)]·0.5dpee}n(2)。结构分析揭示配合物1和2都具有四连接的dia网络和四重穿插的框架,这应该归因于配体的结构和金属离子特征。此外不同辅助配体的引入,有助于得到不同结构的CPs。所以,作为一种新型的有机配体,H2HIPA在构建不同结构的配合物时具有好的合成前景。
Supporting information is available at http://www.wjhxxb.cn
